【Nat. Rev. Cancer】研究早期癌症生物学的新策略
摘要:
早期癌症或癌前病变的检测与干预对于提升患者生存率具有极大的潜力。然而,癌症的启动过程以及正常组织向癌前状态和癌症状态的转变,在非癌组织背景下仍然不甚明确。这部分是由于缺乏早期阶段的临床样本或适合研究早期癌症的模型。在本篇综述中,作者介绍了临床样本和模型系统,例如自发性小鼠模型和源自类器官或干细胞的模型,这些模型允许对早期癌症发展进行纵向分析。作者还展示了增强我们对癌症启动和早期进展理解的新兴技术和计算工具,包括直接成像、谱系追踪、单细胞和空间多组学技术,以及人工智能模型。这些模型和技术共同促进了对特征不明确的早期恶性转化过程的更全面理解,为揭示癌症发展的关键驱动因素和早期生物标志物提供了巨大潜力。最后,作者讨论了如何将这些新见解转化为基于机制的早期癌症检测和预防策略。
引言:
癌症的早期发现与治疗对于提高患者的生存率至关重要,但遗憾的是,许多癌症病例在晚期才被诊断出来。为了实现癌症的早期检测与干预,深入理解癌症早期的生物学机制是关键。早期癌症的发展通常是一个多阶段的过程,涉及恶性转化的连续步骤。在这一过程中,一个单一的祖细胞(起源细胞)获得关键的癌症驱动突变,这些突变在正常组织中经历正向选择,导致克隆性扩张,最终可能重塑整个组织。在这一过程中,某些克隆可能获得额外的遗传或表观遗传变化,从而进入癌前状态。这种状态可能表现为形态学上的改变,例如结肠息肉和肺结节,或者它们可能在没有明显异常的情况下保持隐匿(癌前细胞)。这些癌前状态的细胞有潜力进一步发展成恶性肿瘤。
在这篇综述文章中,作者将“早期癌症”定义为从最初的突变细胞到晚期癌症的早期发展阶段,涵盖了癌前病变和癌前细胞。这一定义有助于我们更好地理解癌症的早期阶段,并为早期干预提供了理论基础。
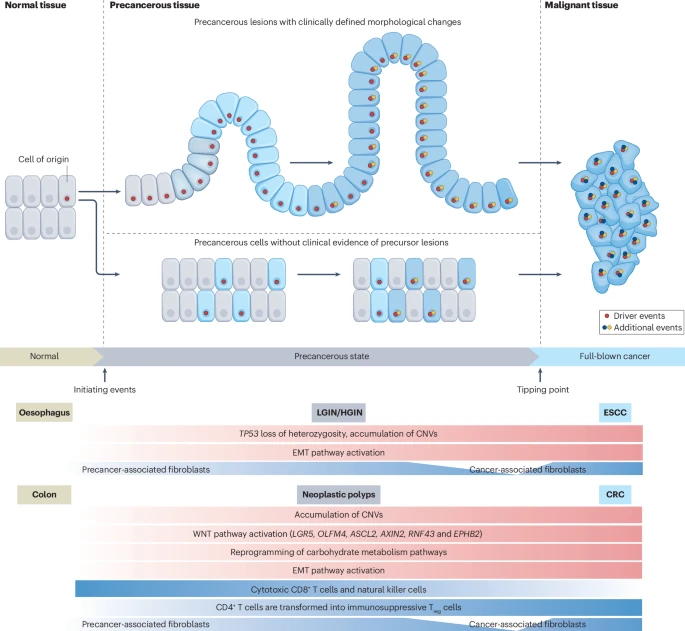
图1:癌症从起源细胞到全面癌变的早期发展过程示意图。 癌症发展的起始点是单个细胞中驱动基因的变异(如图中红圈所示),这些变异随后被正向选择,引发克隆在正常组织中的扩增。在此过程中,非突变的克隆细胞会被具有突变的克隆系所取代。随后,这些克隆细胞中的一些可能会经历额外的癌症驱动事件(如图中黄圈所示),进而形成癌前状态,这些状态可能伴随着形态学上的异常,也可能没有明显的形态变化。 进一步地,由转化基因组改变(内在因素)以及宏观环境和微观环境信号(外在因素)共同驱动的选择和克隆进化(如图中蓝色圆圈所示)促使癌前细胞或病变向恶性肿瘤的转变。这些因素的相互作用和动态变化决定了病变是否不可逆地进展为恶性肿瘤的关键时刻。 以食道癌前病变(如低度上皮内瘤变(LGIN)或高度上皮内瘤变(HGIN))和结肠癌前病变(如肿瘤性息肉)为例,它们向食道鳞状细胞癌(ESCC)或结肠直肠癌(CRC)的发展涉及到一系列关键的分子和细胞变化。这些变化包括拷贝数变异(CNV)、上皮-间质转化(EMT)以及调节性T细胞(Treg细胞)的作用等。这些生物学事件不仅标志着癌症发展的不同阶段,也为癌症的早期诊断和治疗提供了潜在的靶点。
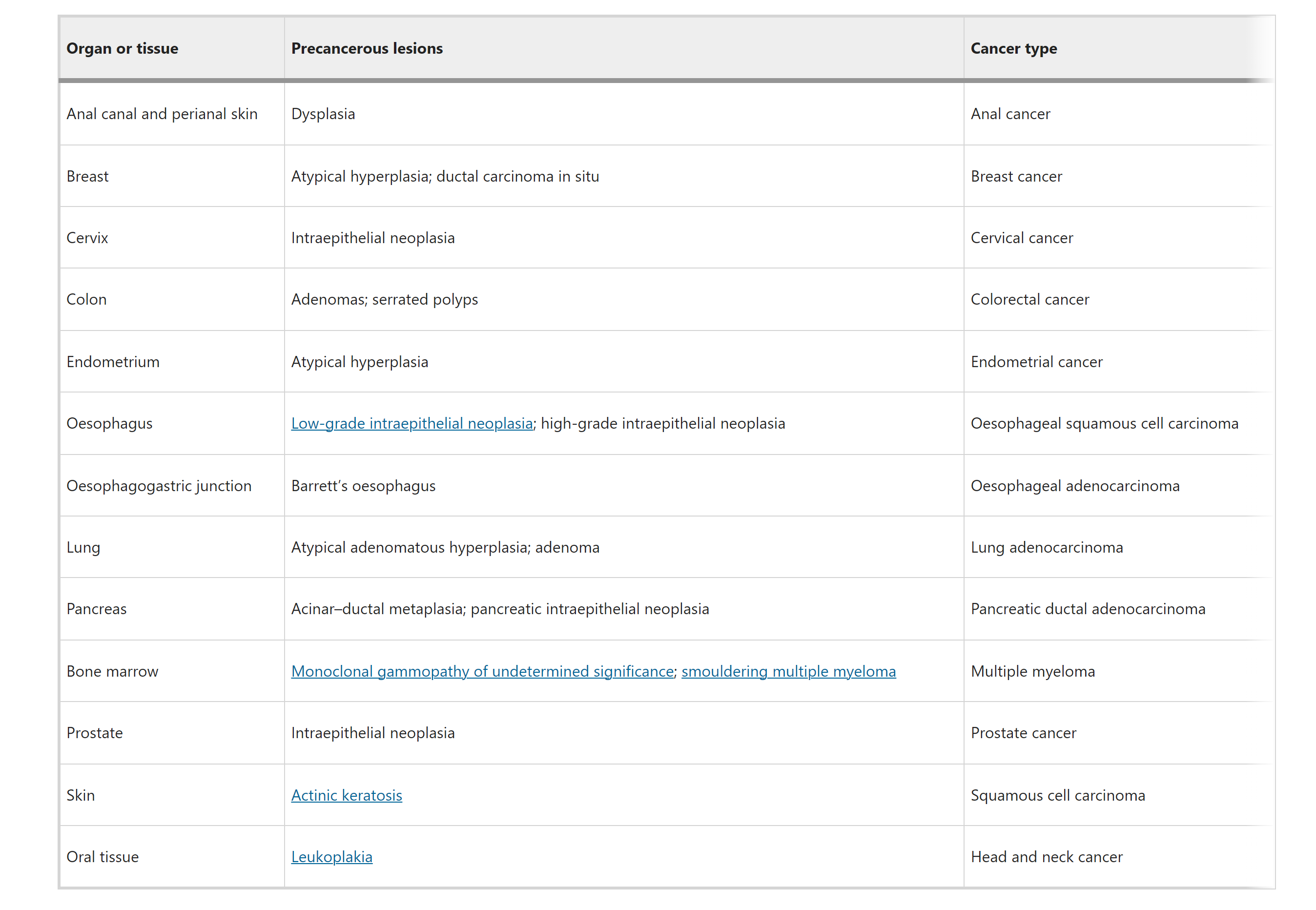
表1:来自各种组织的癌症前体病变的选择性例子
尽管我们对晚期癌症有着广泛的了解,但对早期癌症的认识仍然存在不足。我们现在意识到,驱动突变虽然是必要的,但并不足以推动早期癌症的进展。在肿瘤发生的过程中,遗传、表观遗传以及宏观环境和微环境变化的复杂相互作用才刚刚开始被阐明,这可能与晚期癌症截然不同。这些因素各自的贡献仍然未知,可能在肿瘤发生过程中动态变化。免疫监视和早期癌症阶段的免疫逃逸也知之甚少。最重要的是,确定携带致癌突变的细胞何时以及如何达到癌变轨迹上的“临界点”,这些细胞注定会成为癌症,并将其与其余会“正常”自我更新、分化或死亡且永远不会发展成癌症的突变细胞区分开来。这种理解将是定义早期检测和干预的正确时机和目标的关键。
这些知识空白源于早期癌症检测和研究中面临的特殊挑战。与晚期癌症相比,早期阶段的临床样本通常稀缺,并且仅对某些癌症类型可用。此外,许多广泛使用的癌症模型,如癌细胞系和患者衍生的异种移植物(PDX),不适合研究早期癌症,因为它们通常来源于完全发展的癌症。早期癌症研究通常需要高分辨率检测和纵向追踪少量癌症启动细胞,并涉及在原始器官中剖析内在和外在的致癌驱动因素。最后,研究早期癌症的模型和分析工具的稀缺使得建立因果关系和评估早期干预策略变得具有挑战性。
近期在早期癌症的临床和临床前模型构建方面的进步,加上一系列分析工具的发展,现在提供了理解早期癌症发展复杂性的机会。在本篇综述中,作者介绍了适合分析癌症发生早期步骤的模型,强调了直接成像、谱系追踪、空间和单细胞多组学以及人工智能等技术如何被用来理解早期癌症生物学,并讨论了每种模型的局限性。作者总结了如何将获得的新见解可能转化为早期癌症检测和预防的潜在策略。
通过临床样本了解早期癌症
对于某些癌症类型,早期疾病阶段甚至癌前病变是可以被采样的,这些样本是研究临床环境中早期癌症的宝贵资源。例如,血液癌症通常可以在多个疾病阶段进行重复采样。同样,许多实体癌症类型根据组织病理学有临床定义的癌前病变,这使得获得早期阶段甚至有时纵向样本成为可能。此外,某些癌症,如食管、皮肤或口腔鳞状细胞癌(SCC),在同一个患者体内从癌前病变到完全发展的癌症有空间连续的进展,提供了在更晚期采样早期病变的独特机会。将这些癌前病变与正常组织和晚期癌症进行比较,可以识别恶性进展的候选驱动因素和风险因素。大规模倡议,如国家癌症研究所的人类肿瘤图谱网络(HTAN)癌前图谱项目,旨在详细描述癌前病变及其微环境,是实现这一目标的有希望的步骤。通过这些项目,研究人员可以更深入地理解癌前病变向癌症转变的分子机制,为早期癌症的检测和预防提供科学依据。
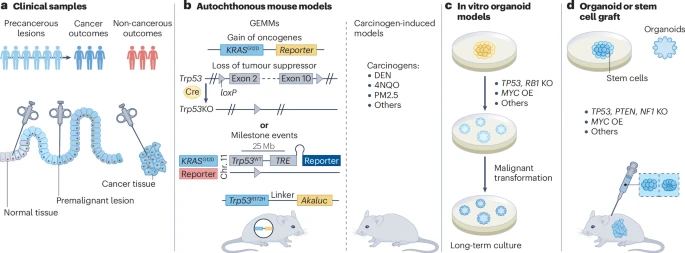
图2:早期癌症的临床样本和临床前模型。
表2:具有早期阶段临床样本和组学数据集的癌症类型 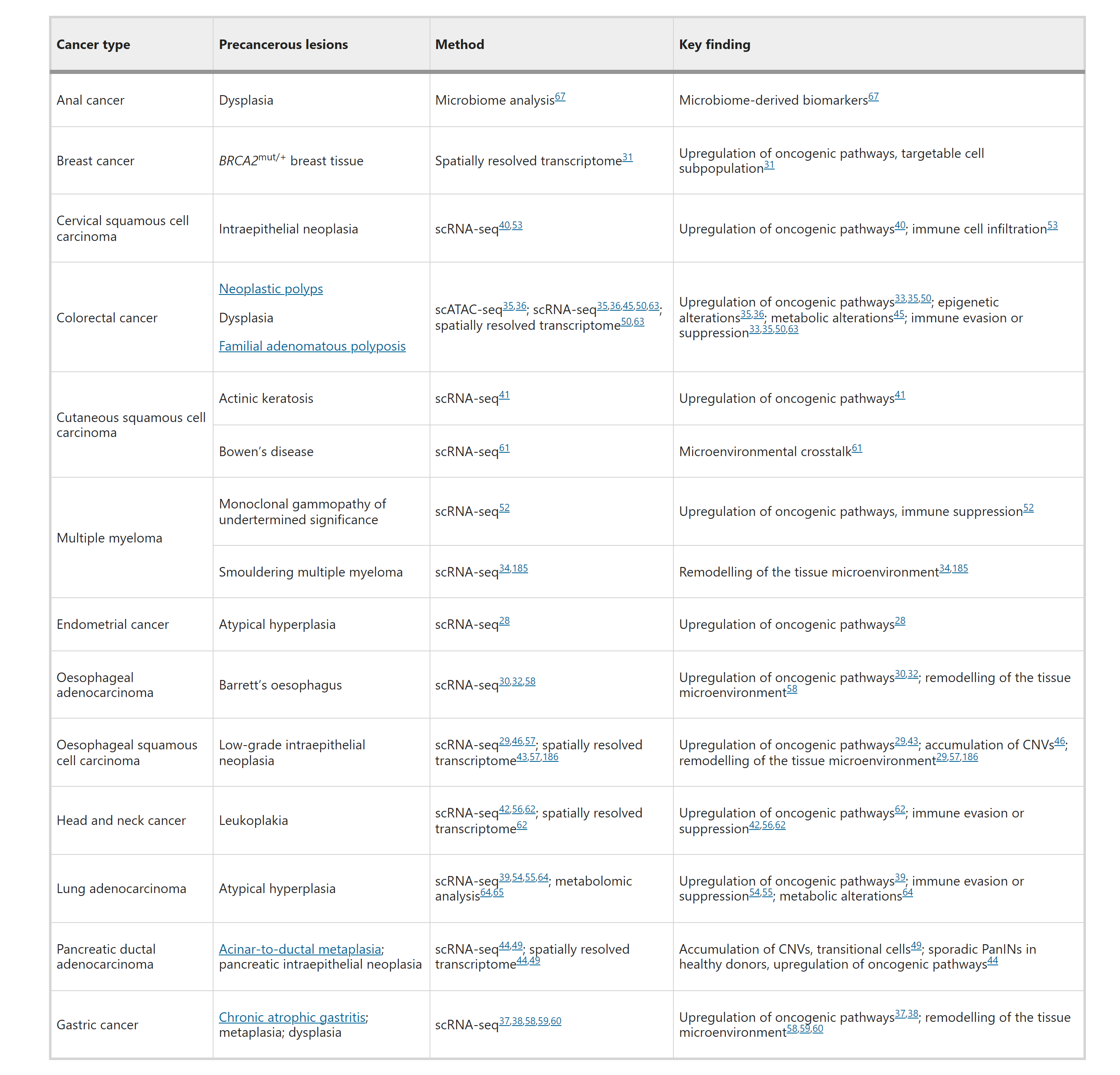
许多研究已经开始使用单细胞和空间组学结合人工智能模型来描述临床样本中癌症发展的早期步骤。
单细胞和空间组学
单细胞基因组学、转录组学和空间转录组学的技术进步极大地增强了我们对癌症发展早期步骤的分子特征的时空分辨率。通过对多个人类器官的正常组织进行单细胞基因组分析,研究者能够揭示肿瘤发生的潜在最早步骤。在表型正常、非癌组织中发现携带常见癌症驱动突变的细胞频率之高出乎意料,这表明在正常组织中获得驱动突变和随后的克隆扩张并不一定导致癌症。例如,尽管正常食管中TP53的突变负担在中年时可达5-10%的细胞,并在70岁及以上的个体中上升到15-30%,但食管癌的终生风险不到1%,这表明需要额外的事件,通常与衰老、环境侵害和/或炎症相关。这些观察与以突变为中心的经典致癌观点不同,强调了通过比较分析癌前病变来识别额外驱动因素的必要性。
单细胞和/或空间组学分析已经在多种癌症类型的癌前病变上进行。这些分析表明,癌前病变通常包含与正常细胞类型密切相关的细胞群体,但已经表现出恶性特征,可能作为癌症启动细胞。单细胞RNA测序和转座酶可访问染色质测序(ATAC-seq)对正常组织、癌前病变和晚期癌症的分析揭示了这些细胞类型在结肠癌的致癌轨迹中的表观遗传和转录转换的连续性,这可以通过伪时间分析来模拟。在结肠息肉中,大量上皮细胞表现出与结直肠癌中相似的干细胞样表型。在胃癌、肺腺癌和宫颈癌的癌前病变中也发现了干细胞样细胞群体。癌前病变中的干细胞样细胞可能来自组织干细胞的克隆扩张和选择,或者来自获得干细胞样特征的非干细胞。相反,也发现了特定于阶段的转录特征,例如在皮肤、头颈、食管和胰腺的癌前细胞中,这些分析可以帮助识别恶性进展的候选转录驱动因素。值得注意的是,代谢重编程可能已经在这些早期阶段发生。例如,三羧酸循环途径在癌前腺瘤中最初被下调,但在结肠癌中略有升高,而能量代谢途径在不典型腺瘤样增生中被上调。
除了转录异常,癌前细胞可能开始积累额外的基因组改变。例如,基因组分析揭示了包括SOX9和ARID1A在内的26个肠上皮化生驱动基因,而在食管鳞状细胞癌相邻的癌前病变中观察到TP53杂合性丧失。此外,癌前细胞可能基因组不稳定并积累拷贝数变异(CNVs),这可以从单细胞或空间转录组数据中使用inferCNV或siCNV算法推断出来。在食管鳞状细胞癌、头颈癌和胰腺导管腺癌(PDAC)的癌前病变中已经鉴定出带有CNVs的细胞,但在结直肠腺瘤中没有,表明在肿瘤形成过程中特定于癌症或阶段的CNVs的获得。除了突变或CNVs,对Barrett食管患者的临床样本进行的深度基因组测序在早期癌前病变中鉴定出了染色体外DNA(ecDNA)。在Barrett食管活检中检测到ecDNAs与食管腺癌(EAC)的发展强烈相关。这些ecDNAs扩增了多种癌基因,包括ERBB2、KRAS和MYC,以及免疫调节基因,如MHC类II转录激活因子(CIITA)和细胞因子信号传导抑制因子1(SOCS1),并在EACs中被正向选择,可能驱动癌前向癌症的转变。
除了这些细胞内在机制外,单细胞和/或空间转录组学也开始揭示癌前细胞与微环境细胞的共同演化,包括免疫细胞、成纤维细胞和基质细胞。癌前病变中的微环境细胞也表现出早期阶段特异性的细胞组成和转录组特征。在结肠、宫颈和肺癌以及多发性骨髓瘤的癌前病变中,免疫细胞的丰度经常增加,与炎症和/或免疫监视的概念一致。然而,在结肠和肺的癌前病变或口腔癌和多发性骨髓瘤中,CD4+ T细胞经常转化为免疫抑制性调节性T(Treg)细胞,而细胞毒性CD8+ T细胞和/或自然杀伤细胞被耗尽或功能丧失。与癌症相关的成纤维细胞(CAFs)类似,在胰腺内皮瘤(PanIN)和胃、食管和口腔癌的癌前病变中发现了促进恶性进展的前CAFs,它们在抑制细胞毒性免疫反应中发挥突出作用。单核细胞或巨噬细胞亚群也可能参与结肠和口腔癌以及多发性骨髓瘤的癌前病变中的免疫抑制。这些研究共同揭示了从免疫监视到免疫逃逸的转变,这是恶性转化开始的基础。
尽管蛋白质组学和代谢组学通常无法与转录组学的通量和细胞分辨率相匹配,但它们对于识别早期阶段生物标志物和开发早期检测方法至关重要。例如,对肺腺癌及其前体的代谢组学分析已经鉴定了癌前病变中的异常代谢途径,并且发现三个血浆代谢物小组或一组九个脂质可以预测恶性进展。同时,通过宏基因组学可以确定癌症发生时微生物群落组成的改变,它捕获微生物遗传物质以区分不同的细菌物种。最近的一项研究结合了宏基因组和蛋白质组分析,以鉴定出在高级别鳞状上皮内病变中微生物组衍生的钴胺素和琥珀酰辅酶A水平增加作为肛门癌的早期阶段生物标志物。
人工智能模型预测癌症进展
来自临床样本的日益增长的数据为训练人工智能(AI)模型预测早期癌症提供了丰富的资源,即使在没有癌前病变的情况下。使用深度学习或机器学习算法或大型语言模型的AI模型现在促进了早期癌症研究,特别是在早期癌症检测和诊断方面,通过整合包括放射学、成像、组织学、多组学数据和电子健康记录在内的广泛的多模态数据,识别这些不同数据类型内部和跨数据类型的预测特征。
癌前病变可以通过包括CT、MRI、PET-CT和内窥镜在内的医学成像技术直接成像,用于检测早期癌症的基于图像的AI模型已经开发并进入临床实践。与患者的临床结果信息相关联,AI模型还可以预测癌前病变发展成癌症的可能性。例如,一个名为CancerRiskNet的机器学习模型,它在包括急性胰腺炎和其他胰腺疾病的患者临床病史上进行训练,以及额外的风险因素,如体重减轻和2型糖尿病,被建立用于预测胰腺癌风险。另一个例子是为低剂量CT成像开发的一种深度学习算法,重点关注关注区域,用于肺癌风险预测。一些AI模型比传统方法更早地识别癌症的有效性已经通过临床试验得到验证;例如,在一项随机临床试验中,展示了一个用于补充MRI的AI模型比传统的乳房密度测量方法高出四倍的早期乳腺癌检测效率。
AI模型也越来越被应用于整合多组学临床数据集,以提高风险预测和模式识别的准确性。例如,利用遗传和代谢数据的机器学习被用来识别从血浆样本中非侵入性早期检测胃癌的代谢签名。同样,DeepTrace结合无末端修复的酶甲基化测序的循环DNA和预训练的神经网络,被开发用于早期检测肝细胞癌。AI模型还可以推断在没有已知癌前阶段或样本的癌症中早期遗传改变的顺序。例如,PhylogicNDT可以分析晚期头颈鳞状细胞癌的外显子测序数据,使用全基因组扩增作为里程碑事件和已知的突变率来重建癌症突变历史。这个算法可能被潜在地应用于其他也缺乏早期样本的癌症类型。
临床样本的局限性
尽管早期阶段的临床样本对早期癌症研究非常宝贵,但它们有重要的局限性。许多癌症类型在没有临床证据的癌前病变的情况下被诊断为晚期疾病阶段,因此对于许多肿瘤类型,早期疾病阶段的临床样本不可用。
对于有前体病变的癌症,主要挑战在于区分哪些病变会进展,哪些不会,鉴于只有相对较低百分比的病变会发展成癌症。由于早期阶段采样的快照性质(由于病变的移除),很难预测哪些病变或细胞会发展成癌症。因此,仅基于早期阶段样本很难建立早期病变中识别的特征与晚期癌症出现之间的直接联系。此外,患者的特定遗传构成、生活方式和环境暴露可能会使建立因果关系的任务变得复杂。
对于基于临床数据集的AI模型,一个主要关注点是整个训练和决策过程发生在一个“黑箱”中,通常缺乏可解释性。此外,一些AI模型设计不佳或由单一中心的数据训练,可能导致偏见和过拟合。这些问题需要在未来的研究中得到改进,以允许对AI输出进行功能性验证。
自发性小鼠模型研究早期癌症
包括自发性小鼠模型和类器官及干细胞衍生模型在内的临床前模型,可以克服临床样本的一些局限性。首先,在临床前模型中,更容易在不同时间点进行纵向采样,为没有癌前病变的癌症提供充足的早期阶段样本。此外,这些模型除了组学方法外,还可以进行谱系追踪和先进的成像技术,允许剖析谱系可塑性并在不同癌症发展阶段追踪癌症启动细胞。临床前模型在研究多种风险因素与癌症发生之间的因果关系方面也具有独特的优势,通过各种干扰实验。可以对癌症启动细胞、癌前细胞或早期驱动事件进行预防性治疗,并在这些模型中评估早期检测策略。
自发性小鼠模型包括基因工程小鼠模型(GEMMs)和致癌物诱导模型,这些模型可以用来分析在原始器官微环境中的整个致癌过程。它们允许作者原位监测癌症启动细胞的转化过程,一直到晚期癌症,涉及与基质细胞、免疫细胞、血管和宏观环境暴露的适当相互作用。
表3:选择性自发性小鼠模型和早期癌症的组学数据集 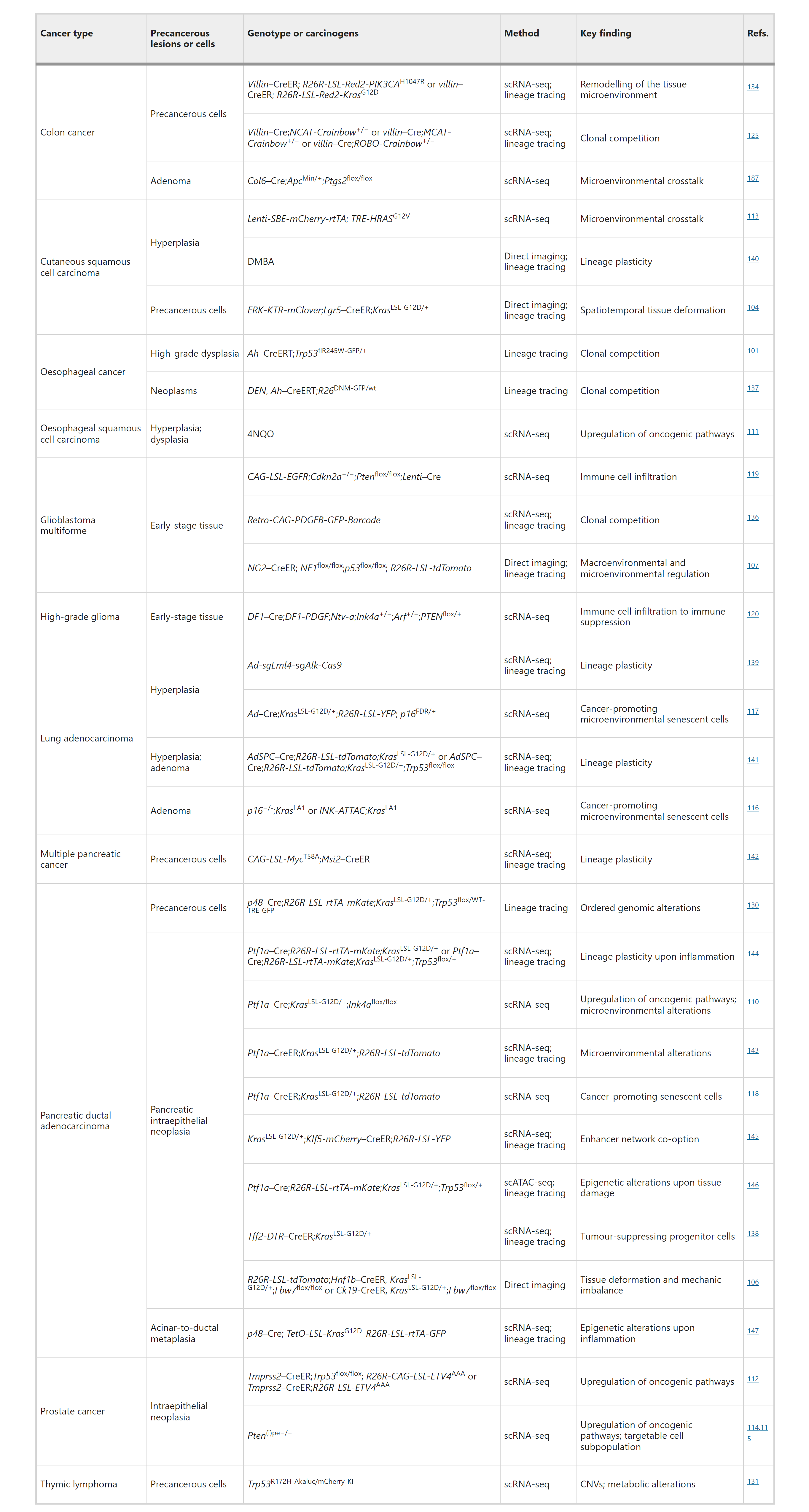
GEMMs是通过将癌基因和/或肿瘤抑制基因(驱动因素)的遗传改变引入体细胞来启动癌症。基于CRISPR–Cas9的基因组编辑大大加快了这些模型的生成。一方面,通过基因组测序发现的新的候选遗传驱动因素可以在小鼠模型中进行验证;另一方面,使用在患者中不常见的驱动突变的模型(尽管它们重现了疾病的某些方面)被遗传上更忠实的模型所取代。此外,发展了如重组酶和识别位点对Cre–loxP、Dre–rox和Flp–FRT以及诱导系统的遗传工具,允许在特定时间点对特定细胞类型进行遗传改变,并以顺序或可逆的方式引入这些改变。GEMMs比人类癌症在遗传上更明确,因此更容易剖析个体因素对癌症启动和早期进展的贡献。通过遗传和药理学方法逐一改变个体风险因素,可以在自发性模型中建立这些因素与癌症之间的因果关系。以胰腺癌的GEMMs为例,已经显示在KrasLSL-G12D/+;PDX–Cre或KrasLSL-G12D/+;p48–Cre小鼠中胰腺特异性Kras突变自发发展为早期PanINs,其中低比例继续发展为PDAC。额外的突变或Trp53或Cdkn2a的丧失将PDAC的穿透率提高到近100%。这些GEMMs的研究建立了PanINs作为PDAC的明确癌前前体,并与组织病理学相关联的遗传事件序列。这些模型被广泛接受为研究PDAC启动和进展的遗传实验的“金标准”。
致癌物诱导模型是通过直接将致癌物应用于感兴趣的组织来诱导癌症。大多数致癌物诱导模型使用可以引起组织损伤、炎症和/或DNA损伤的突变剂。通过整合新识别的、现实生活中的环境化学物质或污染物,如空气污染物颗粒物2.5(PM2.5),这些模型可以更好地模拟致癌物诱导的癌症。尽管致癌物诱导模型通常在遗传上没有定义,但它们对于剖析环境因素对癌症启动的贡献很有用。当与GEMMs整合时,它们可以用来研究早期癌症中不同的癌症启动细胞、遗传驱动因素和环境因素之间的复杂相互作用。例如,口服二乙基硝胺(DEN),一种在烟草烟雾中发现的致癌物,导致食管上皮发生领域性癌症化,产生突变克隆的拼贴画,其中一部分在数月的潜伏期后发展为食管鳞状细胞癌。SCC的穿透率与持续DEN暴露的时间相关,在携带食管p53突变的小鼠中显著增加。DEN诱导的食管鳞状细胞癌模型发展出与老年人相似的突变景观,这些模型通常用于研究肿瘤启动和逐步癌症演变过程中的克隆竞争和合作遗传事件。
小鼠模型中的直接成像
带有荧光或生物发光转基因报告基因的自发性小鼠模型可以在癌症发展的早期阶段直接成像。癌症启动和早期进展通常发生在一个定义的位置或生态位,允许通过活体显微镜(IVM)进行直接和连续的4D观察。多光子显微镜已成为常用的IVM方法,因为它提供了比其他成像技术更高的灵敏度、穿透深度和细胞或亚细胞分辨率。在小鼠模型中,癌症启动细胞可以通过荧光蛋白标记并通过植入的成像窗口进行监测,这经常用于成像晚期癌症和转移。监测早期癌症更具挑战性,部分原因是由于癌症发生的长期周期需要植入足够深以达到癌症启动生态位的稳定成像窗口,这对于许多内部器官如肺、胰腺和结肠来说很难实现。在皮肤中,IVM用于纵向追踪活体小鼠的毛囊,证明KrasG12D突变将干细胞中的脉冲ERK信号转换为持续激活,导致空间和时间上特定的组织变形,这是SCC启动的基础。
除了IVM,组织或器官中的癌症启动细胞和癌前细胞可以通过组织清除和光片显微镜直接在3D中成像。尽管组织清除是一个快照策略,但它允许对感兴趣的所有器官中的癌前细胞和病变进行绝对定量,包括数量、形状和体积。它还允许详细描述3D生态位架构和恶性转化中涉及的物理力量。例如,3D全器官成像技术表明,张力失衡和组织曲率驱动胰腺中的癌症启动。类似地,组织清除和光片显微镜被用来监测胶质瘤在嗅球神经生态位中的启动。
尽管生物发光成像非常适合非侵入性体内监测晚期癌症,但它通常缺乏捕捉深部器官早期病变的分辨率和灵敏度。开发高度敏感的生物发光酶和底物对,如Akaluc和AkaLumine和NanoLuc和CFz,可以检测到低至10到1000个细胞在深部器官如肺和大脑中,为早期癌症研究的更广泛应用打开了大门。当用作谱系追踪报告基因时,它们可以非侵入性地标记癌前细胞的出现,并监测它们在原始微环境中向癌症的进展,允许研究早期癌症开始时的稀有细胞及其与组织微环境的相互作用。
单细胞转录组学
各种自发性小鼠模型发展出与人类病变病理学上相似的癌前病变,如胰腺、肺、食管、前列腺和皮肤癌小鼠模型。这些癌前病变可以通过单细胞RNA测序直接在单细胞分辨率下进行研究,揭示早期阶段特异性的转录组特征和上皮细胞与微环境细胞亚群之间的相互作用,在PDAC、食管鳞状细胞癌、前列腺癌和皮肤鳞状细胞癌的前驱病变中表现出增加的细胞可塑性和免疫细胞浸润,类似于临床样本。此外,已经显示SCC的癌前病变中的干细胞样细胞可以重塑微环境细胞以促进从良性到侵袭状态的进展中的血管生成。单细胞RNA测序还可以识别癌前病变中的管腔细胞亚群,这些细胞可以作为癌症预防的靶点,例如在前列腺癌模型中的两项研究。此外,单细胞RNA测序被用来识别早期病变中的衰老细胞作为恶性进展的驱动因素。例如,在突变Kras驱动的肺癌模型中,已经显示衰老的巨噬细胞通过抑制细胞毒性T细胞反应促进早期肿瘤发生,它们的清除可以改善肺癌的发展。同样,单细胞RNA测序识别了表达Cox2的衰老PanIN细胞,这些细胞被证明可以促进肿瘤发生。
自发性小鼠模型还允许对没有临床上定义的癌前病变的癌症类型通过时间序列单细胞分析进行早期阶段分析。例如,单细胞免疫分析揭示了在表皮生长因子受体(EGFR)或血小板衍生生长因子(PDGF)过表达以及失去周期依赖性激酶抑制剂2A(Cdkn2a)和Pten的胶质母细胞瘤(GBM)模型中,免疫细胞组成的纵向变化,突出了在发展中的GBM中早期炎症微胶质细胞和T细胞的浸润。
谱系追踪
临床前癌症模型中的谱系追踪涉及标记和随时间监测细胞及其随后的后代,为癌症启动细胞和癌症演变过程中的克隆动态提供重要见解。基于重组酶的谱系追踪系统通常涉及由组织特异性启动子驱动的Cre重组酶以及GEMMs中的Rosa-loxP-stop-loxP-荧光报告基因,特别标记表达Cre的癌症启动细胞及其后代。在GEMMs中使用该系统的谱系追踪被广泛认为是在体内环境中识别癌症起源细胞的金标准。在GEMMs中使用可诱导和双重重组酶以及多色报告基因,允许以顺序方式在特定时间点引入驱动突变,进一步提高了该系统在解剖早期癌症发展过程中克隆演变的时间、遗传和克隆分辨率。
使用合成或外源条形码允许区分成千上万的单个细胞,提供高吞吐量的临床前模型谱系追踪,提高了准确性并降低了成本。多达10^10形式的多样化合成条形码库可以通过病毒感染与致癌驱动因素一起整合到细胞中,允许体内追踪单个突变细胞的谱系。或者,癌症启动细胞可以用相同的外源条形码序列标记,随后由伴随的突变器如CRISPR–Cas9识别并随机突变,以生成多样化的谱系条形码池,以区分单个细胞。合成或外源条形码通常被设计为与单细胞RNA测序和空间转录组学兼容;因此,它们不仅描绘克隆关系,还揭示了单个克隆的基因表达谱。
最近,作者和其他研究者开发了一类新的基于事件的谱系追踪方法,用于监测和分析在癌症进展过程中达到重要里程碑的细胞子集。这些事件的例子包括第二个野生型Trp53等位基因的杂合性丧失、突变型p53蛋白的稳定化、由致癌KRAS引起的持续ERK激活、肿瘤抑制因子腺瘤性息肉病蛋白(Apc)丧失后RAC活性的增加,以及在新兴肿瘤和微环境中p16水平的升高。每一个都标志着通往恶性的不可逆和促进恶性进展的重要里程碑。这些事件可以通过GEMMs中的基因工程荧光或生物发光报告基因进行标记,并通过荧光激活细胞排序(FACS)或直接成像进行检测。例如,在由胰腺特异性激活致癌KrasG12D和Trp53单等位基因失活驱动的PDAC小鼠模型中,经历额外Trp53杂合性丧失的细胞在自发肿瘤发生过程中将变为单个mKate阳性,将它们与其余的mKate+GFP+ KrasG12D;Trp53杂合突变细胞区分开来,允许对这些在癌前组织中将导致癌症的罕见细胞进行单细胞基因组调查。同样,蛋白水平的突变p53荧光和生物发光报告基因可以识别在非癌组织中稳定化突变p53蛋白的低频癌前细胞,将它们与各种p53突变GEMMs癌症模型中的其余p53突变细胞区分开来。因此,基于事件的谱系追踪系统已被用于检测注定要在非癌组织中成为癌症的前体细胞,将它们与大多数不会引发癌症的突变细胞区分开来,并从时间上对齐来自个体小鼠的独立致癌轨迹。这些系统可以潜在地与其他谱系追踪方法整合,以提高解剖早期克隆动态驱动致癌的精度。
在自发性模型中,各种谱系追踪工具可以与组学分析一起使用,以研究早期癌症发展过程中的克隆竞争。例如,多色报告小鼠模型Red2Onco被开发并用于同时追踪和分析小肠内的突变型和野生型克隆,表明致癌克隆可以通过旁分泌信号破坏野生型组织的稳态,促进领域性癌症化。在基于Cas9和条形码的Kras;Trp53 (KP)-tracer系统中,在Kras突变和Trp53突变的肺癌模型中识别了带有CNVs和不同适应度特征的罕见扩展亚克隆。合成DNA条形码和单细胞RNA测序揭示了在PDGFB驱动的胶质瘤模型中早期胶质瘤发生的大规模克隆差异,并确定Myc作为克隆竞争力的关键调节因子。令人惊讶的是,致癌物诱导的癌前病变被相邻正常食管中的突变克隆所取代。沿着这条线,胰腺中的Tff2阳性的过渡放大祖细胞对KRAS驱动的致癌作用具有抵抗力和保护作用,突出了癌症启动过程中的谱系特异性。在基因组水平上,谱系追踪和p53突变细胞的深度基因组测序定义了在胰腺和食管癌症模型中Trp53丧失后的遗传事件序列。这些研究表明,大多数突变细胞不会引发癌症,需要在特定谱系中增加遗传和转录事件以促进恶性进展。
谱系追踪和单细胞RNA测序还可以描绘特定谱系中细胞的分子轨迹,揭示早期癌症发展过程中增加的谱系可塑性。谱系追踪将俱乐部细胞指定为肺腺癌的起源,单细胞RNA测序识别了俱乐部细胞的致癌轨迹,这些轨迹与肺再生中的轨迹相似。在突变诱导的皮肤癌症模型中,在早期阶段,富含亮氨酸的G蛋白偶联受体6(LGR6)阳性细胞中发现了高塑性与增殖性干细胞状态的汇聚。通过从增生到腺癌的七个阶段采样带有Kras和/或Trp53突变的tdTomato标记细胞,观察到在肺癌演变过程中高塑性细胞状态的出现。在胰腺中,MYC过表达可以将不成熟的RNA结合蛋白Musashi同源物2(MSI2)阳性的胰腺细胞转化为多种亚型胰腺癌的多谱系癌前细胞。一些谱系追踪研究使用单细胞RNA测序、单细胞ATAC测序或染色质免疫沉淀后测序(ChIP–seq)分析Kras突变和Trp53突变的胰腺癌症模型中的正常、炎症、癌前和恶性组织,这些研究表明胰腺上皮细胞在炎症后增加表观遗传可塑性,进入区分转化和再生的独特染色质状态,并通过与免疫细胞的异常交流促进恶性进展。
自发性小鼠模型的局限性
尽管自发性小鼠模型在早期癌症研究中很重要,但它们也有显著的缺点。建立和维护自发性小鼠模型通常既昂贵又耗时,对于某些罕见或研究较少的癌症,尚未开发出忠实的自发性模型。尽管自发性模型为早期癌症提供了重要见解,但将发现直接转化为人类患者并不总是直接的。小鼠和人类之间在免疫系统、代谢和组织结构上存在差异。因此,小鼠模型中的发现理想情况下应通过人类样本进行验证。此外,GEMMs通常向大量体细胞(通常是整个谱系)引入遗传改变的组合,与主要在选定克隆中随时间积累这些改变的自发性人类癌症不同。
在自发性小鼠模型中对早期癌症的研究通常涉及基于两个假设的纵向分析。首先,在同一阶段或时间点收集的样本是等效和可比的;其次,早期阶段收集的样本将发展成更恶性的阶段。然而,即使对于遗传上定义明确的临床前模型,情况往往并非如此。例如,在GEMMs中,个体小鼠中癌症的发病可以显著变化,间隔有时跨越数月甚至超过一年。结果肿瘤的遗传和表观遗传谱在个体小鼠之间可以显著变化。此外,在早期阶段或时间点的组织中的大多数突变细胞不会发展成癌症。因此,至关重要的是要注意,即使具有相同的起始驱动突变的体细胞,在每个受试者中也走上了通向恶性的不同进化路径。因此,分析大量早期阶段样本对于得出有意义的结论至关重要。使用p53杂合性丧失、突变型p53稳定化和全基因组扩增等在致癌轨迹中的关键里程碑事件来对齐早期样本,除了形态学和时间,也可以提高一致性。
类器官和干细胞衍生模型
类器官是一种自组织的3D组织或迷你器官,重现了实际器官的关键功能、结构和生物学复杂性,通常从人类或小鼠的多能、胎儿或成体干细胞中生长。通过遗传操作、致癌物暴露或致癌病毒感染,可以从类器官中的细胞亚群启动癌症。这些癌症启动细胞随后在体外进化,生成3D类器官环境中的癌症。例如,使用基因组编辑在人类胰腺类器官中顺序引入癌基因或删除肿瘤抑制因子,重现多步骤致癌。迷你乳腺腺泡类器官忠实地重现了正常的腺体结构,引入PyMT基因导致形成导管原位癌样结构异常,这是乳腺癌的前驱病变。对于某些器官,可以直接从癌前病变如非典型子宫内膜增生中建立类器官。尽管体外培养的携带遗传工程驱动因素的类器官可以发展出类似癌症的表型,但它们通常缺乏体内的复杂基质和免疫微环境。为了克服这一点,它们可以被异位或原位移植到小鼠中,以更好地模拟体内癌症进化。已经为许多癌症类型建立了突变类器官移植模型,如结肠癌、肺癌和肝癌。
表4:选择性类器官和干细胞模型用于早期癌症的组学数据 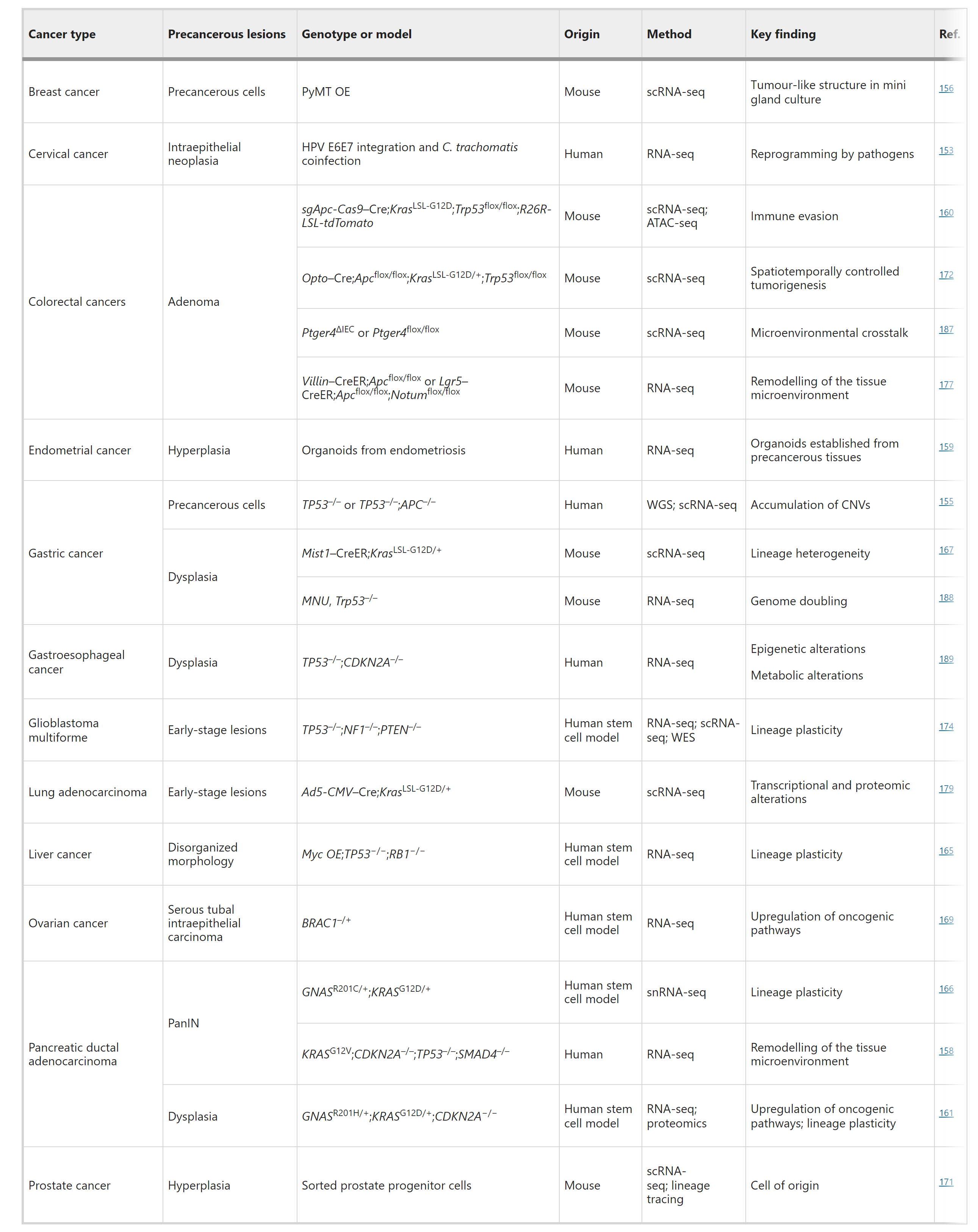
表5:早期癌症模型的优点和缺点 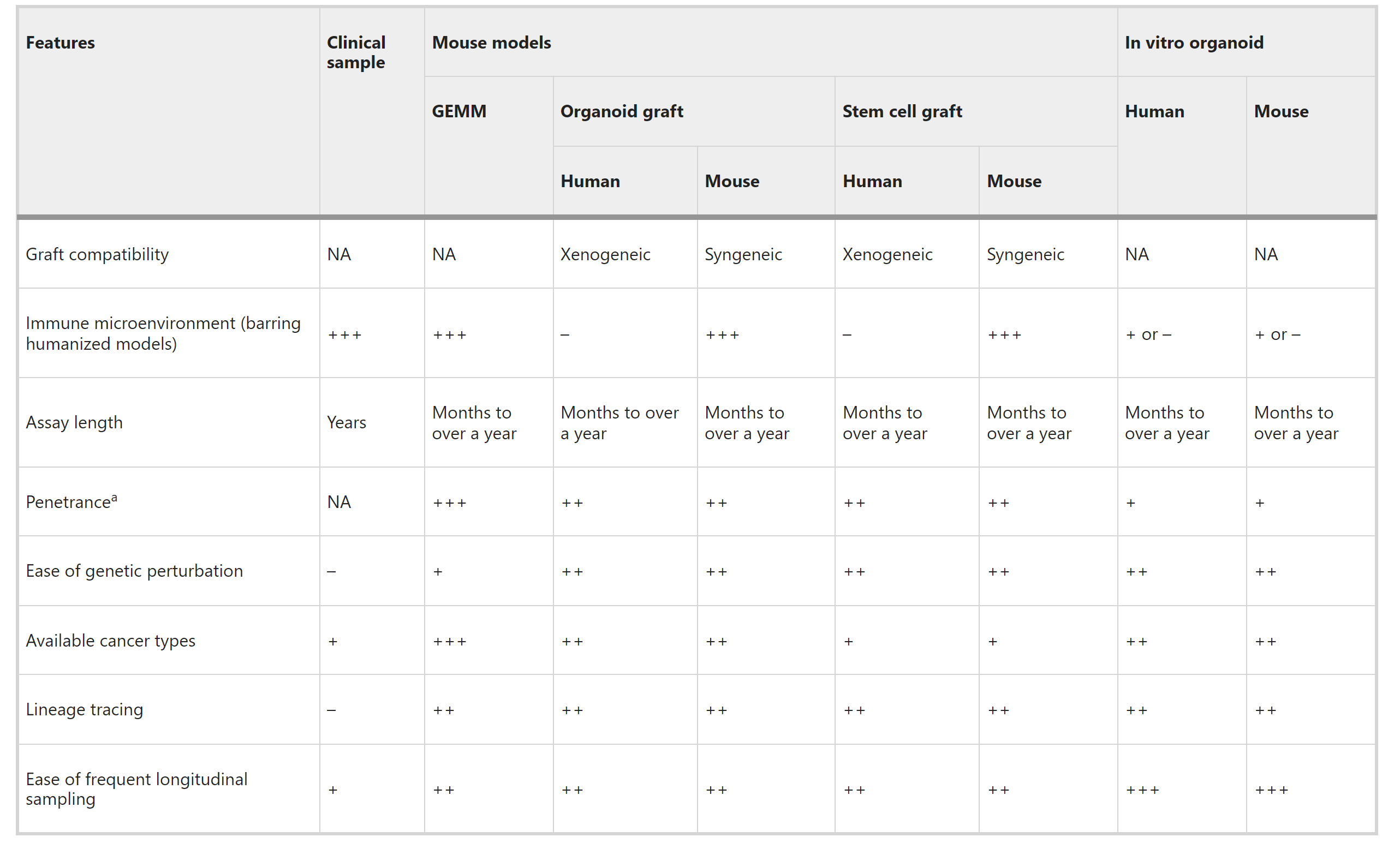
类器官衍生模型在早期癌症研究中具有独特的优势,因为它们便于在模拟健康器官的环境中体外观察癌症启动和早期进展。人类类器官模型提供了在接近人类器官的环境中追踪整个致癌过程的唯一途径。使用患者衍生的诱导多能干细胞,理论上可以重现个体患者的致癌轨迹。与动物模型相比,类器官可以相对快速地建立,伦理问题较少,为早期癌症研究提供了成本效益高的替代方案。此外,许多3D类器官模型,包括癌前模型,已被美国典型培养物收藏中心(ATCC)存储供公众使用。在技术上,进行纵向采样、成像和谱系追踪以研究早期癌症进化也容易得多。一个值得注意的例子是最近开发的拓扑复杂的迷你结肠,它整合了光遗传学和组织工程技术,可以在特定位置和时间点通过蓝光诱导的致癌基因激活启动癌症。
除了类器官衍生模型外,基因修饰的组织特异性干细胞的异种移植长期以来被用来模拟癌症启动,因为许多癌症类型起源于突变的组织干细胞。携带致癌驱动因素的造血干细胞的移植已成为血液癌症研究的常规建模方法。随着干细胞技术的进步,现在可以通过移植修改的组织特异性干细胞,如神经干细胞,为实体瘤开发模型。
组学和/或谱系追踪
使用类器官和干细胞衍生模型研究早期癌症时,会收集培养类器官或植入类器官或干细胞的时间序列样本。为了评估早期癌症发展过程中的克隆竞争,经常进行组学分析和/或谱系追踪。基因组分析和谱系追踪揭示了在培养超过2年的TP53突变人类胃类器官中癌前病变的克隆进化和选择。共培养野生型和Apc-null类器官揭示了Apc突变的肠道干细胞通过分泌WNT拮抗剂诱导邻近野生型干细胞分化,促进癌前克隆扩张。
在不同时间点对突变类器官进行转录组和表观遗传分析,揭示了肿瘤发生的分子动态。例如,在人类和小鼠肺类器官中用Kras突变模拟了早期肺癌,并且在AT2细胞中,通过单细胞RNA测序揭示了失去分化谱系身份。与GEMMs类似,在Kras或Gnas(编码Gαs)突变的胰腺类器官中观察到致癌基因诱导的谱系可塑性。在Kras突变的胃异型增生模型中,识别了一个具有谱系可塑性的异型增生干细胞群体,驱动肿瘤转化。时间序列单细胞RNA测序还描绘了移植干细胞的致癌轨迹,突出了命运转换和白血病或胶质瘤预防的早期转录目标。从老年组织中建立的类器官也有助于阐明衰老对早期癌症发展的影响。例如,比较从年轻和老年小鼠中建立的结肠类器官,揭示了与衰老相关的表观遗传异常,使老年类器官更容易启动癌症。为了研究癌症启动细胞与免疫微环境的相互作用,可以将小鼠类器官原位移植到免疫能力小鼠中。使用这种方法,最近的一项研究确定SOX17是Apc/Kras/Trp53突变小鼠类器官衍生移植物早期癌症形成中免疫逃逸的关键介质。
类器官和干细胞衍生模型的局限性
类器官的局限性之一是它们的可用性有限,因为并非所有器官都能成功建立类器官。此外,类器官通常缺少参与癌症启动的器官微环境中的关键细胞类型,如免疫细胞、内皮细胞和某些类型的基质细胞。最近开发的血管化和免疫类器官或整合多谱系细胞类型的集合体可以帮助更好地模拟早期病变的异质性。然而,它们在多大程度上重现体内环境需要仔细评估,特别是对于在免疫环境之外生长的类器官。体外类器官培养系统观察到的结果理想情况下应通过体内模型和临床样本进行验证。对于类器官衍生或干细胞衍生的异种移植模型,理想情况下应将类器官和干细胞移植回体内生态位,以模拟它们的原生微环境,这对于许多器官来说是一个挑战。
另一个重要问题是引入一个或两个驱动基因可能不足以在工程化类器官中诱导癌症。例如,在大脑类器官中引入18个单基因突变或扩增或15个这些的组合,只有涉及三个以上遗传改变的三种组合才能诱导类似GBM的表型。与GEMMs类似,同时引入多个遗传驱动因素可能无法反映自然疾病进展。因此,在未来的研究中应考虑逐步引入类器官模型中的癌症驱动因素。
迈向精准早期癌症检测和预防
目前,大多数癌症类型尚无法实现早期检测和预防。即使对于可以早期诊断的癌症类型,也存在过度诊断和过度治疗不会进展的病变的实质性问题。因此,迫切需要开发创新的精准早期检测和治疗策略,这些策略可以基于对早期癌症的临床和临床前模型的综合分析所获得的知识。
识别局部和全身早期癌症生物标志物
识别早期癌症生物标志物的一个关键挑战是在非癌症组织背景下检测癌前细胞的小分子信号和微妙的形态学变化。鉴于癌前克隆的小尺寸,它们显示、分泌或脱落的任何生物标志物都将限量。由AI驱动的成像技术有可能通过数据集训练识别出人眼无法察觉的更微妙的组织病理学改变,并将临床记录整合以揭示与早期癌症相关的多模态变化。
此外,多组学方法可以用来放大液体活检和早期阶段样本的局部信号,增加细胞和克隆分辨率。免疫系统也可以作为放大器来信号早期癌症。事实上,两项最近的研究发现了与胶质母细胞瘤进展平行的时间分辨免疫轨迹,并识别了早期阶段特异性的免疫细胞组成和转录特征。因此,有可能识别与癌症相关的免疫学变化作为早期癌症的局部或全身生物标志物。
理想的早期生物标志物应该既敏感又特异,最小化假阴性和假阳性。因此,目标可能不在于检测少数细胞的最早癌症,而是在于精确定位一个可操作的阶段,其中诊断和干预既是必要的也是可行的。早期生物标志物可能或可能不直接参与推动早期癌症。随着下一代临床前模型变得更加与疾病相关,现在可以在临床试验环境中定量测试所提出的早期生物标志物的敏感性、特异性和功能,然后才在昂贵且耗时的前瞻性临床研究中进行测试。
针对早期阶段途径进行癌症预防
早期癌症通常被认为比它们的晚期原发性癌症对应物更均匀、更不多变。位于癌症进化树的根部附近,早期癌细胞可能依赖于更明确的驱动途径。因此,即使晚期癌症可以耐受,靶向治疗药物也可能在早期癌症上取得更好的疗效,如两项关于乳腺癌和淋巴瘤癌前病变的最新研究所例证。也有例子表明,癌前细胞依赖于早期阶段特定的途径,这些途径在完全发展的癌症出现时不再需要。早期癌症的分子分析可以识别候选途径,这些途径可以作为预防性治疗的靶点,可以在各种模型系统中进行验证。然而,关键再次在于确定干预的时机和标准,特别是关于在有癌症风险的“健康”患者中应用预防性治疗。
结论
在建模和分析技术方面的最新进展扩大了作者探索早期癌症各个方面的工具箱,不断提高时空分辨率,现在使作者能够绘制从单一突变细胞到癌前状态,最终到恶性肿瘤的里程碑生物学事件和分子相互作用。
展望未来,作者预计临床前模型将进一步改进,以更准确地再现人类疾病,从而在临床环境中验证假设,同时提供更相关的平台来评估早期干预策略。在自发性小鼠模型和基于类器官的模型中,可以更加关注最终会成为癌症的少数细胞,作者可以预见发展更高分辨率的技术来识别、监测、表征和靶向这些细胞,整合直接成像、谱系追踪以及单细胞和空间基因组学、转录组学和蛋白质组学。此外,作者预计将获得更广泛的早期阶段临床样本,这些样本富含详细的成像、组学和预后数据,将允许多模态分析以识别更具体的早期生物标志物和预防靶点。在不久的将来,IVM的应用应该扩大到包括更广泛的癌症模型,以更精确地阐明具有更高空间分辨率的肿瘤发生。将AI与能够追踪癌前阶段的临床前模型(如p53突变小鼠模型)整合,可以显著提高液体活检的灵敏度。此外,多组学方法可以提供对罕见克隆扩张、肿瘤发生过程中与适应度相关的基因程序以及早期阶段肿瘤相关抗原的全面见解,从而为开发更有效的癌症预防和诊断策略提供信息。这些未来的进展可以为作者早期癌症研究的最终目标铺平道路:从对抗晚期癌症转变为预防其出现,从而保护生命,减少对个人和医疗系统的疾病负担。