【Nat. Biomed. Eng.】🚀13秒获取78乳房图像,分类AUC达0.89:全景PACT助力乳腺病变精准识别
近年来,乳腺癌的发病率持续攀升,筛查与早期诊断成为降低死亡率的关键。传统的X线钼靶检查在致密乳腺中敏感度受限,超声检查则缺乏特异性并受操作者经验影响,磁共振成像成本高昂且受患者排斥。为弥补这些短板,研究者将光声计算断层成像(Photoacoustic Computed Tomography,PACT)引入乳腺病变评估。该技术通过激光激发血红蛋白所产生的超声信号,既具备高分辨率,又不依赖离子辐射,可实现对肿瘤血管生成和低氧状态的敏锐捕捉。
一、乳腺影像诊断的痛点与PACT的契机
在美国,约有12%至13%的女性一生中会被诊断出乳腺癌,且乳腺癌已成为女性第二大致死性肿瘤。筛查流程通常以钼靶X线为首选,发现异常后再做超声或MRI检查。然而,钼靶在高密度乳腺的敏感度不足,有研究显示,其在致密乳腺的检出率仅约50%;超声图像质量与操作经验息息相关,常常出现假阴性或假阳性;MRI虽然不依赖离子辐射,但需要注射对比剂并且对幽闭恐惧者不友好。与此同时,综合成本和患者依从性也制约了其大规模应用。正是在此背景下,PACT凭借其无创、非离子辐射、对血管和低氧微环境十分敏感的优势,被提到乳腺筛查的研究前沿。
二、全景式PACT:技术原理与系统实现
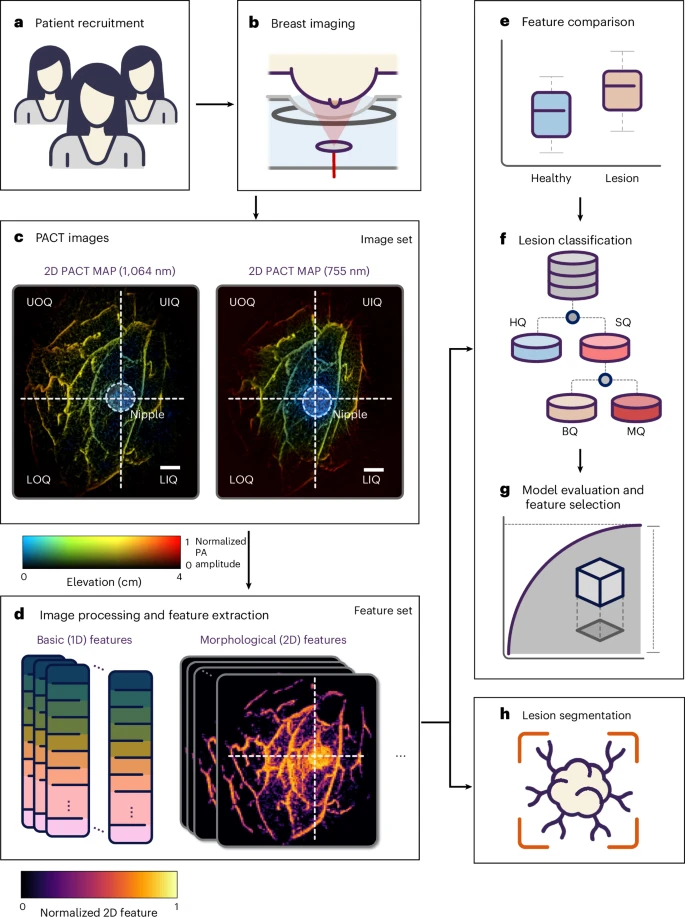
全景PACT系统的核心在于采用一个大视野环形超声换能器阵列,同时使用1064纳米和755纳米两种激光交替照射。血红蛋白在近红外波段具有良好的吸收特性,肿瘤周围新生血管以及缺氧区会产生更强的光声信号。患者俯卧于专用成像床上,将待检乳房轻轻放置于环形阵列中心。激光通过漫射器均匀照射胸壁,超声换能器环绕一周采集光声波形,然后经三维重建得到整个乳房的最大信号投影图(MAP图)。每次成像仅需13秒呼气屏气便可完成,无需注射任何造影剂,适合常规筛查和多时相随访。
三、临床研究设计与患者招募
为了验证全景PACT在临床实际中的可行性与诊断价值,研究团队在为期两年的临床研究中招募了39名符合条件的女性患者,累计对78侧乳房进行了成像。这些患者均在常规钼靶筛查或超声评估后被评为BI-RADS 3以上,需要进一步诊断或监测。在初次成像后,对于BI-RADS 4或5的高风险病灶,均在PACT扫描后进行了病理活检,并对有疑义者开展了6个月、12个月甚至24个月的多次随访。成像数据先后被分割为四个象限,每个象限均保留原始深度编码信息,供后续定量分析和分类模型训练。
四、定性对比:PACT与钼靶、MRI的差异与互补
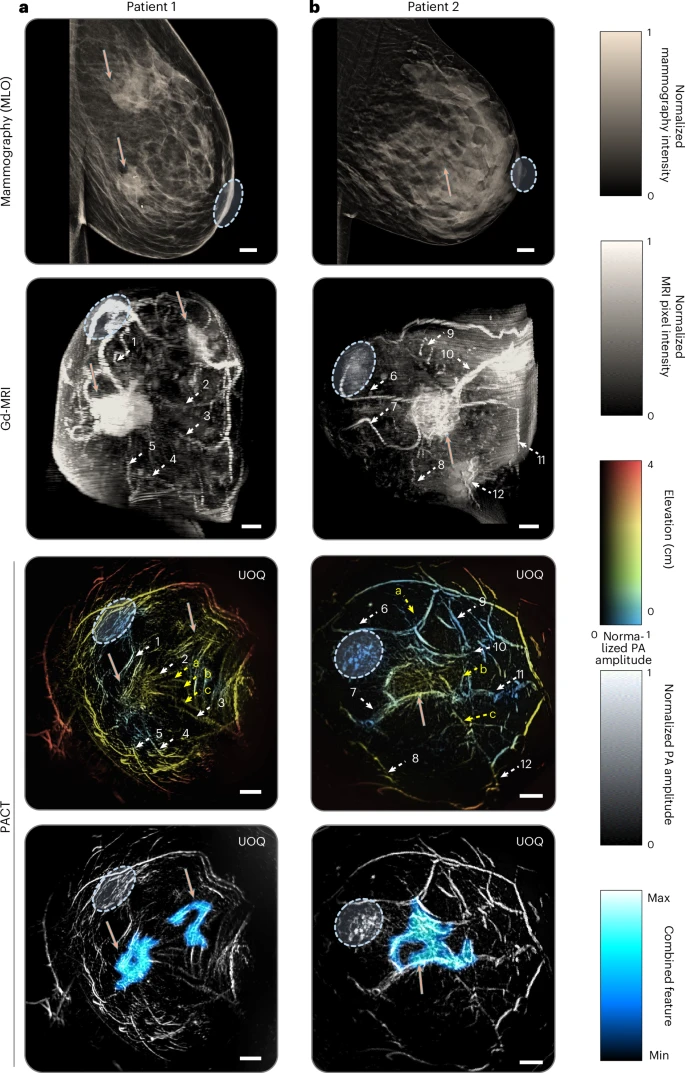
研究者在典型病例中对比了PACT与钼靶X线、Gd增强MRI以及常规B超的成像结果。对于一例直径3.5厘米的浸润性导管癌,钼靶无法提供血管分布信息,MRI虽然能显示肿瘤形态,但无法揭示肿瘤周围穿透血管。PACT成像则清晰地呈现了多条扭曲的细血管自肿瘤实心区向外分布,这些血管在MRI图像中并不明显。另有一例乳腺超高密度患者,其钼靶受致密腺体遮挡无法发现病灶,但PACT在无视密度的情况下,仍准确捕获了异常血管丛和肿块轮廓。这些定性结果表明,PACT可作为传统影像的有力补充,尤其擅长解析病灶血管网络和低氧环境相关特征。
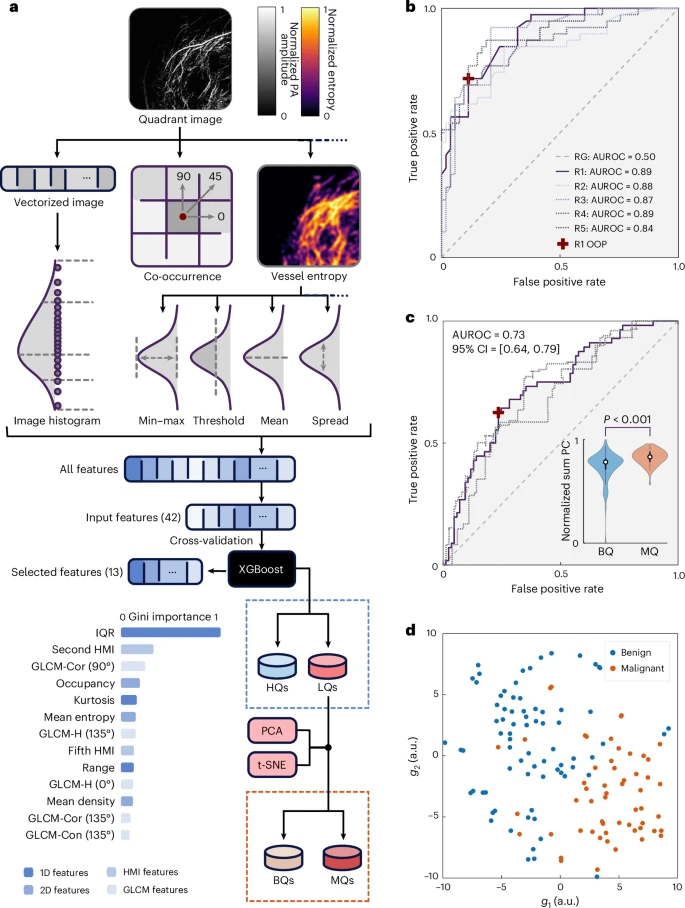
五、定量特征提取:从42项指标到13项精简
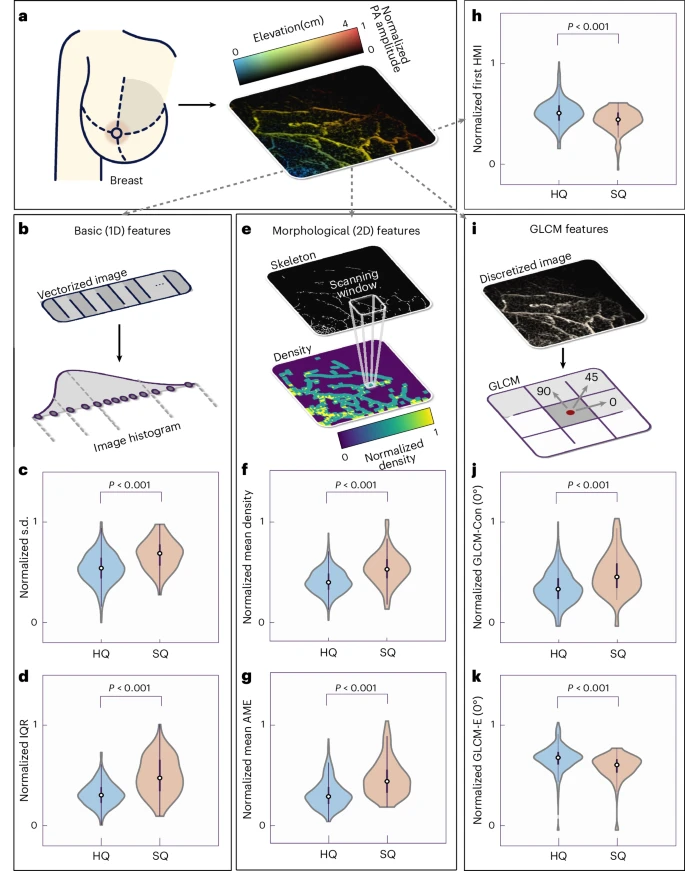
为了将图像直觉转化为可量化指标,研究者提出了包括灰度分布、血管骨架密度、纹理熵值、灰度共生矩阵以及时间动态响应在内的42项特征。灰度统计可反映肿瘤区域信号强度差异;骨架化处理得到的血管密度和分支信息可量化肿瘤血管生成;纹理和Hu矩不变性则捕获血管形态扭曲程度;双波长动态响应可对比血氧饱和度并揭示病灶低氧斑块。经主成分分析与Gini重要性排序后,研究团队最终精选了13项最具区分度的特征,既避免了过拟合,又保留了最核心的生理学信息。
六、机器学习分类:模型训练与效果拔尖
基于精选的13项特征,研究者构建了包括XGBoost在内的多种弱监督分类器,通过五折交叉验证不断优化参数。最终XGBoost模型在测试集上取得了最高0.89的ROC曲线下面积(AUC),平均AUC也高达0.87,灵敏度和特异性均超过85%。在病理证实的病变象限中,分类器能够通过PACT图像准确区分BI-RADS 4及以上的可疑病灶与正常组织。此外,通过对比仅使用前六个主成分的简化分类效果,也显示出AUC达0.82的良好表现,验证了PACT特征的稳定性与生物学相关性。
七、随访监测:动态评估病灶变化
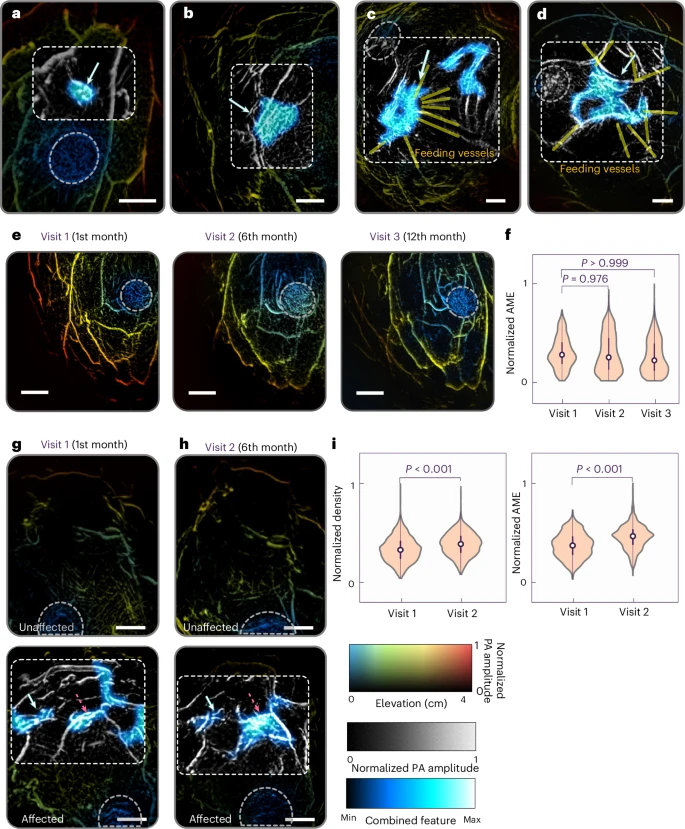
全景PACT的另一个优势在于非侵入性和快速性,使其可用于多时相随访。研究团队对26名BI-RADS 3或4(活检为良性)的患者进行了6个月至24个月不等的多次扫描。结果表明,对于稳定或良性病灶,其血管密度和纹理熵值在数月内无显著变化;而少数后转为高风险或恶性病灶的患者,其PACT图像在首次扫描中已显示出微弱但可量化的血管重塑趋势。这一早期信号有望帮助临床更合理地决定随访间隔和活检时机。
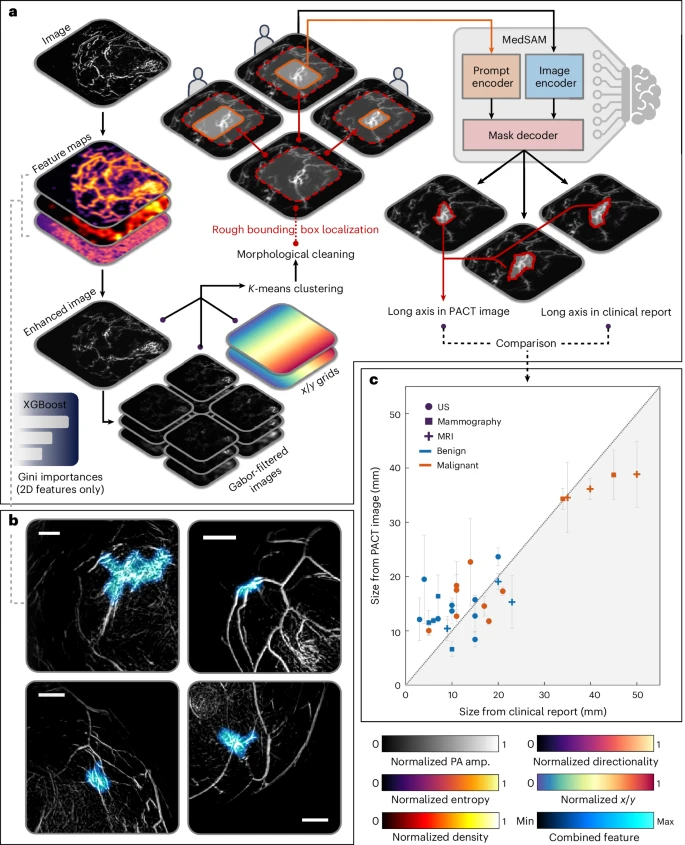
八、病变定位与分割:解放放射科医生的双手
在分类之外,研究团队还探索了PACT在病灶定位和分割方面的潜力。他们结合基于热力学的质心检测和简单的深度卷积网络,实现了对病灶中心位置的自动识别与区域轮廓的半自动分割。初步验证显示,该方法在78侧乳房中能将病灶中心误差控制在5毫米以内,分割轮廓与人工标记交并比达0.78。这为未来临床中自动化读片和影像引导活检提供了可行思路。
九、技术优势与应用前景
全景PACT不仅具备非离子辐射、无需造影剂、快速成像的特点,更依托血红蛋白光声信号,能够直观地揭示肿瘤血管生成与低氧状态,这是传统影像难以企及的维度。未来,该技术有望与常规影像形成互补,降低良性活检的过度率,同时为高危人群提供更细颗粒度的监测。随着人工智能辅助算法的逐步成熟,PACT读片将从依赖放射科阅读者转向机器+人协同模式,有望在基层医院和社区筛查中心实现推广。
十、结语:迈向精准乳腺筛查的新时代
本项研究首次以39名患者、78侧乳房成像的大样本规模,系统验证了全景PACT在乳腺病变分类、监测与定位方面的临床可行性和诊断优势。13秒的快速扫描、42项生理学特征、13项精简核心指标与0.89的最高AUC,一同勾勒出PACT在乳腺影像领域的广阔前景。当无创、无辐射、高灵敏度和多维度功能成像融合于一体,乳腺癌筛查将从单一形态学走向血管病理与生理信号的综合评估,为每一位女性带来更安全、更精准的防癌之路。
参考文献
Tong, X., Liu, C.Z., Luo, Y. et al. Panoramic photoacoustic computed tomography with learning-based classification enhances breast lesion characterization. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01435-3