【Nat. Biomed. Eng.】 🧬14天精准模拟3种临床结局!9类细胞重建的CAR-T体外试验“芯”平台来了
一、前言:CAR-T疗法为何仍存在巨大不确定性?
CAR-T细胞疗法是一项彻底改变血液肿瘤治疗格局的免疫疗法。通过将患者的T细胞改造成带有嵌合抗原受体(CAR)的杀伤细胞,CAR-T能够精准识别并清除白血病、淋巴瘤和骨髓瘤等B细胞相关肿瘤。然而——
尽管已有FDA批准产品,约一半患者仍会在治疗后经历复发或无效反应,而医生却缺乏手段预测这些疗效差异。临床前用于CAR-T评估的传统平台(如2D细胞共培养或小鼠模型)由于缺乏人源骨髓微环境、免疫细胞组成差异、实时时空观测能力不足,难以有效预测患者反应,甚至可能误导药物开发。
为此,一种能在体外真实模拟人类白血病微环境、拥有免疫应答能力、并允许实时动态成像的“前临床试验平台”成为CAR-T疗效优化的核心瓶颈。
二、平台核心:具免疫能力的人源白血病“芯片器官”
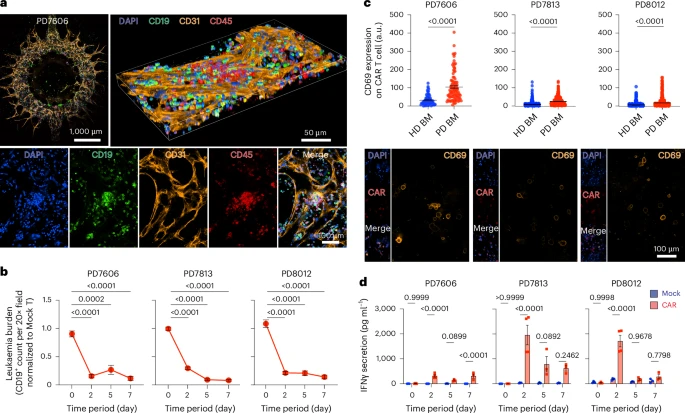
本研究由美国纽约大学医学院团队主导,开发出一种名为 “类白血病免疫芯片(leukaemia chip)” 的三维微环境系统,模拟人类骨髓结构、血管与免疫细胞组成,并支持CAR-T细胞的完整治疗路径观察。
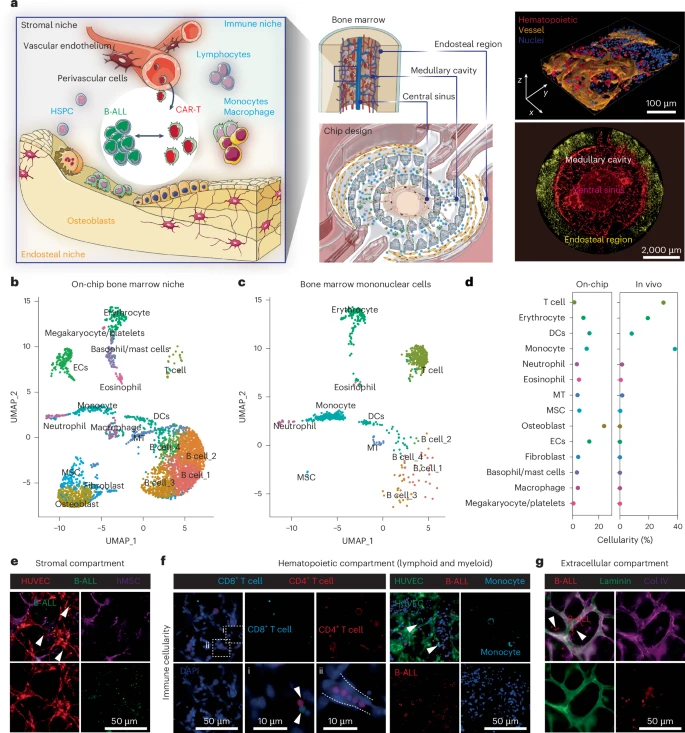
芯片采用多腔区结构,由中部中央静脉窦、髓腔、骨端膜三部分构成,对应真实骨髓解剖区域。每个腔室被分别植入下列细胞:
- 人骨髓单核细胞(BM-MNCs):提供白细胞前体、巨噬细胞等免疫细胞
- 内皮细胞、成骨细胞、间充质干细胞、成纤维细胞:构建三维骨髓支架
- 白血病细胞(Reh等B-ALL细胞系):模型肿瘤
在培养5–7天后,内皮细胞能自发构建贯穿芯片的可灌流血管网,免疫细胞则逐步分化出CD4⁺、CD8⁺、CD14⁺、巨噬细胞和嗜碱细胞等群体,同时形成丰富的胶原蛋白、层粘连蛋白与纤维连接蛋白沉积。
单细胞转录组对比显示,该芯片内细胞组成与新鲜人类骨髓样本高度一致,具备完整免疫功能,并可维持稳定环境超过9天。
三、CAR-T动态过程首次完整可视化:识别、突触、杀伤
将编码4-1BBζ结构域的第二代CD19 CAR-T细胞注入芯片血管后,研究团队连续追踪了14天中CAR-T的行为路径:
- 48小时内成功渗出血管,并沿髓腔向外层白血病区域扩散
- 首次实现对“单个CAR-T如何识别、突触并裂解一个白血病细胞”的全程成像
- 实时成像记录CAR-T在识别目标后进入停顿、形成免疫突触并释放胞毒颗粒的全过程
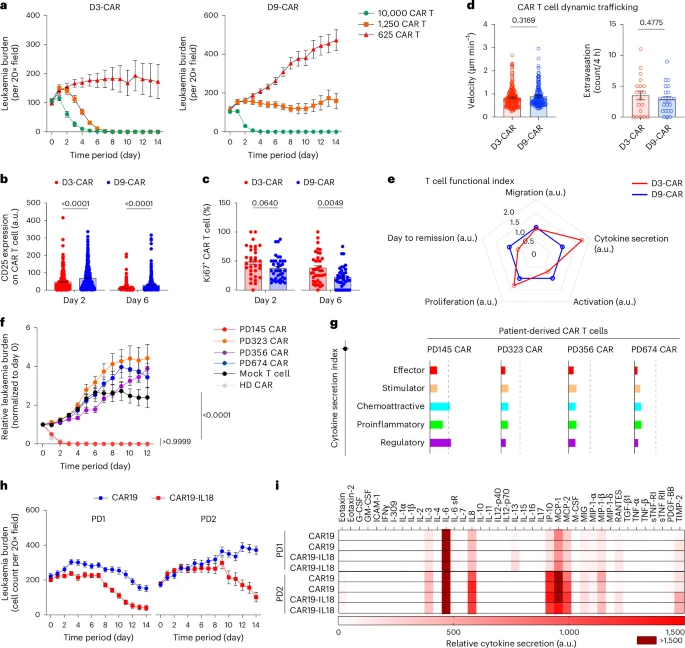
- CAR-T速度明显慢于Mock T细胞(1.213 μm/min vs 1.545 μm/min),印证其“识别即停顿”的工作机制
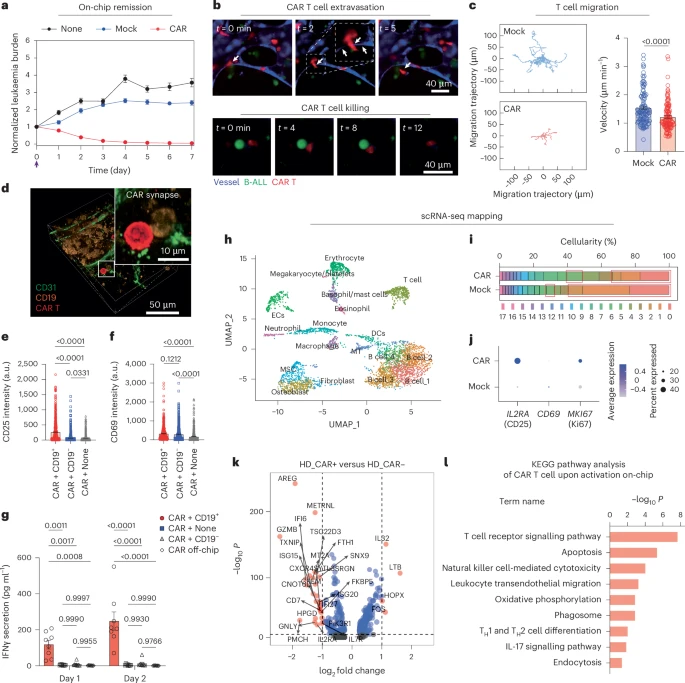
在7天内,CAR-T可实现对CD19⁺白血病细胞的完全清除(>99%),而未转导T细胞组则无显著杀伤效应。
四、CAR-T功能高度恢复:激活、扩增与细胞因子飙升
通过表面标志、ELISA与单细胞转录组联合分析发现:
- CAR-T显著上调CD25、CD69等激活标志;
- Ki-67表达增加,提示T细胞活跃扩增;
- 分泌IFN-γ、GzmB与穿孔素水平显著上升;
- 与CD19⁺白血病接触后诱发大量IL-1、MCP-2等炎症因子;
- 并刺激周围巨噬细胞、血管内皮细胞表达HLA-DR、ICAM-1等共刺激分子,形成免疫放大正反馈;
- 值得一提的是:CAR-T“旁观者效应”也在芯片中被复现,即未表达CAR的T细胞同样受周围环境激活。
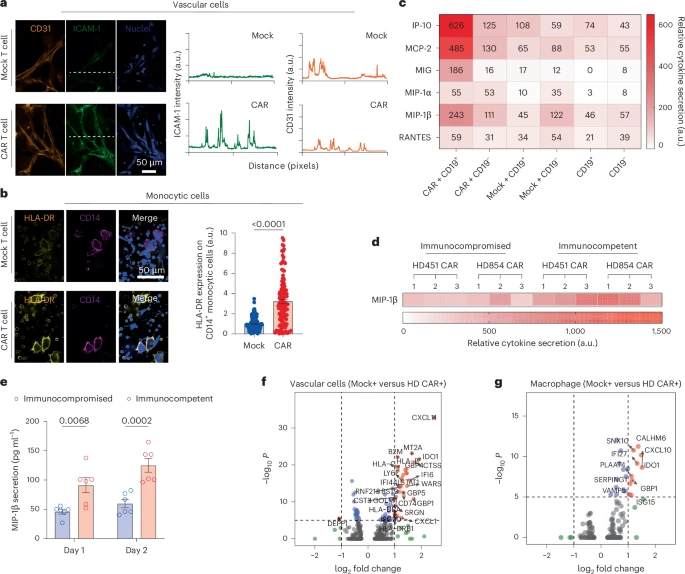
总之,该芯片系统允许首次对CAR-T在“三维免疫骨髓”中的功能性动态展开全面量化,为CAR结构优化提供了新参考。
五、临床三种结局全面模拟:缓解、耐药、复发一应俱全
为了验证芯片模拟患者反应的能力,研究团队将芯片划分为三种干预路径:
- 缓解模型(Remission):注入1:1效应比的CAR-T
- 白血病负荷在第7天基本清除,IFN-γ信号迅速飙升;
- 耐药模型(Resistance):CAR-T剂量降至1/4
- 肿瘤持续生长,T细胞分布范围受限,激活标志低;
- 复发模型(Relapse):白血病群体中掺入5% CD19⁻突变细胞
- 初期可见清除CD19⁺细胞,但CD19⁻迅速扩张,形成耐药性克隆;
- CAR-T无法感知这些抗原逃逸细胞,最终肿瘤全面反弹;
该三种模型运行周期仅14天,与临床209例CAR-T疗效患者统计结果高度一致,包括“早缓解–后复发”双峰曲线。
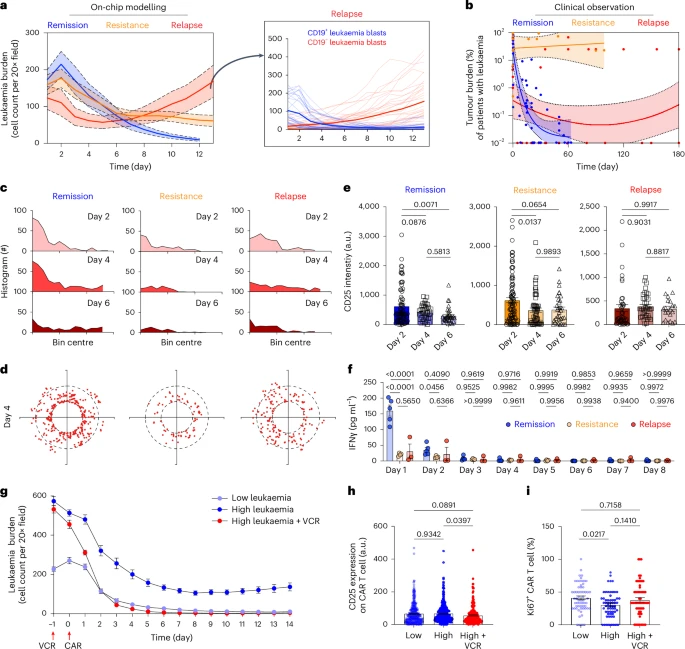
这一成果首次证明:芯片平台在CAR-T临床反应预测中具备真实价值,可取代耗时数月的小鼠模型验证!
六、异源CAR-T筛选:患者与健康供者CAR性能大不同
不仅如此,该芯片还可用于快速筛选不同CAR设计、不同来源细胞的治疗性能:
- 同时评估多个供者(健康人/病人)CAR-T在不同剂量、结构域配置下的活性;
- 引入指标矩阵,构建包含激活度、增殖率、迁移距离、细胞因子、细胞毒性等维度的“CAR评分矩阵”;
- 成功区分出在体外功能最优的CAR结构,为“个体化CAR-T”设计提供数据支撑。
此外,还可用于探索其他免疫疗法,如双特异性抗体、靶向小分子药等组合策略的动态行为。
七、总结与展望:向“个体化CAR疗效预测”迈出决定性一步
该项研究的重要性不止在于构建一个体外白血病模型,而在于提供了一个:
“可视化+有免疫力+预测性强+多维度解析”的类临床验证平台
它让研究者不再依赖动物模型,也不必等待真实患者反应周期。只需14天,即可获得如下信息:
- CAR-T能否进入肿瘤核心区?分布是否完整?
- 是否被激活?是否释放足够细胞因子?
- 是否清除了全部CD19⁺细胞?是否触发逃逸克隆?
- CAR结构变更是否提升杀伤率?
对于药企——这是一个前所未有的 CAR筛选、优化、验证加速器;
对于医生——它也将成为一个术前疗效预判“芯芯相印”工具,真正助力精准医疗落地。
参考文献
Ma, C., Wang, H., Liu, L. et al. Bioengineered immunocompetent preclinical trial-on-chip tool enables screening of CAR T cell therapy for leukaemia. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01428-2