【Nat. Biomed. Eng.】🚀800倍信号强化+精确追踪1200细胞:18F标记抗钙素捕捉CAR-T与AAV基因治疗全身动态
在细胞与基因疗法快速迈向临床的当下,对疗效与安全性的精准监控成为技术落地的核心瓶颈。CAR-T细胞转化为抗癌利刃的同时,也存在着分布不可控、脱靶毒性以及难以评估的扩增动态;腺相关病毒(AAV)介导的基因转移则面对转基因表达部位与持续性的未知风险。传统的细胞或病毒标记方法,如磁性颗粒或荧光蛋白,虽然在小动物短期追踪中受限,但往往无法准确反映活体内长期增殖与分布。针对这一需求,莫拉特(Morath)团队在2025年6月发表于《Nature Biomedical Engineering》上,报道了一款基于抗钙素(anticalin)蛋白+18F-镧系配合物的全新PET报告系统。该系统在体外实现**>800倍特异性放射配体结合**,在小鼠体内能探测仅1200个CAR-T细胞在骨髓中的聚集,并可同步量化AAV基因转移的位置和强度,为细胞与基因疗法的全身精确成像开辟了全新范式。
CAR-T与AAV疗法:为何需要新的成像工具?
过去数年,CAR-T细胞在B细胞白血病和淋巴瘤的临床试验中不断刷新完全缓解率,但也暴露出个体治疗反应差异极大、静脉内或固体肿瘤分布无法预测等问题。现有的体内追踪手段主要依赖于直接标记(如铁氧体、荧光团),在细胞分裂后难以准确反映细胞增殖,且标记物会在细胞死亡或被巨噬吞噬后依然释放信号,混淆疗效评估。而间接标记策略,如荧光蛋白或荧光素酶,虽可指示活细胞,但光学成像在组织深层强烈衰减,又无定量能力。相较之下,正电子发射断层成像(PET)具备全身三维定量、深组织无衰减与高灵敏度(皮摩尔级)的天然优势,正是细胞和基因疗法追踪的理想选择。然而,目前主流的PET报告基因系统——如HSV-tk、NIS、SSTR2或PSMA——或肿瘤相关抗原具有内源性表达干扰、免疫原性高或结合配体需要复杂标记,尚无法在临床上广泛应用。
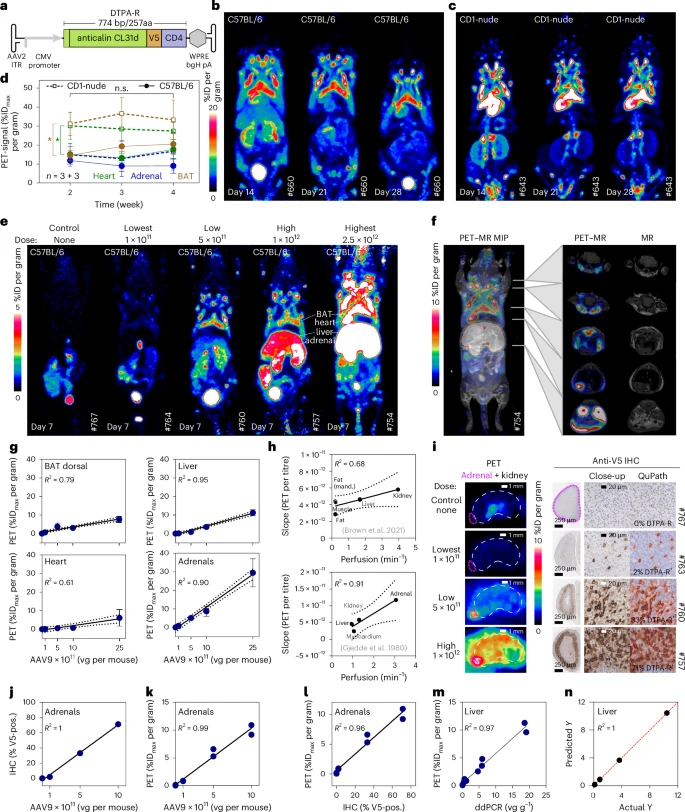
团队提出:能否开发一种体外完全不存在、非免疫原、体内快速清除且可与常用18F配合的小型报告系统?他们基于人源化的抗钙素(anticalin)蛋白,打造出膜锚定结构,仅257个氨基酸,结合富含V5-标签的肽段,能在细胞表面高效呈现。配合18F-标记的镧系金属—DTPA配合物或秋水仙碱配合物,可实现超高亲和、体内低非特异背景、快速肾清除的完美平衡。
抗钙素报告基因的设计与表达
研究者分别选取两款抗钙素:一款(CL31d)对CHX-A″-DTPA•金属复合物具500 pM亲和;另一款(D6.4(Q77E))对秋水仙碱的亲和更高。报告基因构成为:Lcn2信号肽+成熟抗钙素结构域+V5-标签+CD4跨膜段+(可选)荧光蛋白。共774 bp开放阅读框,总长度仅257 aa。该设计确保蛋白易于分泌、膜锚定位且外源性极强,不与人体蛋白交叉。 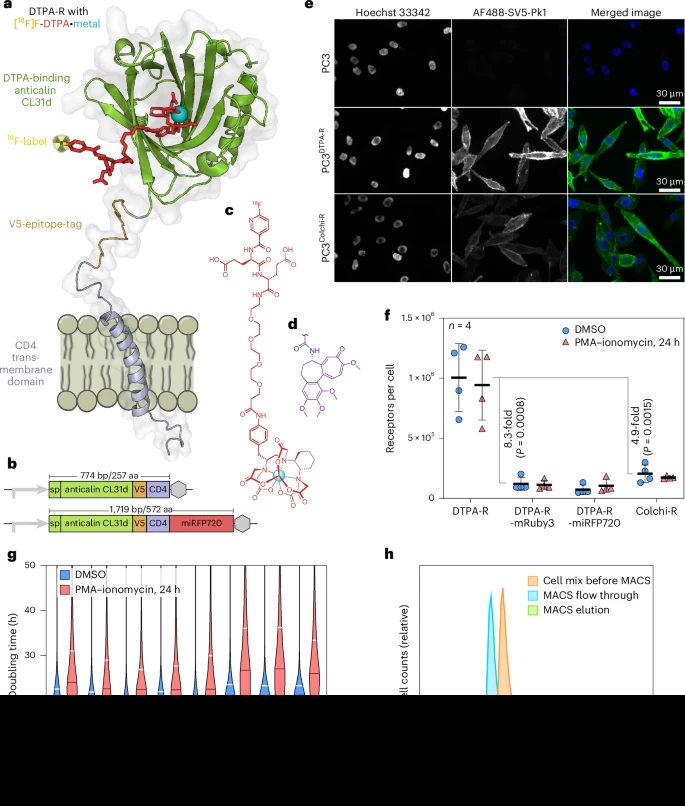
在HEK293T、Jurkat T细胞和PC3肿瘤细胞中稳转后,通过抗V5抗体和MESF微球定量,DTPA报告基因在Jurkat上每细胞表达约10⁵–10⁶个受体(弃用C端荧光蛋白可提升8.3倍表达量),相比同等构建的scFv报告基因高出5.8–8.9倍。这种高密度表达无显著影响T细胞增殖和活性,CFSE染色示细胞周期与野生型一致。V5-标签不仅用于免疫荧光检测,也可通过磁珠富集高纯度报告基因阳性细胞,兼具分选与组织切片染色功能。
18F-镧系配合物的合成与结合性能
传统的18F标记通常需要手工多步合成,且18F-金属配合物亲和常受限。团队创新地在CHX-A″-DTPA分子上接入一个三甲胺离去基团,兼容氟化反应并能与镧系离子(如³⁹Tb³⁺)形成高度稳定配合物。他们用超短单步射频氟化+反相HPLC纯化,最终获得20%产率、>98%纯度的[¹⁸F]F-DTPA。
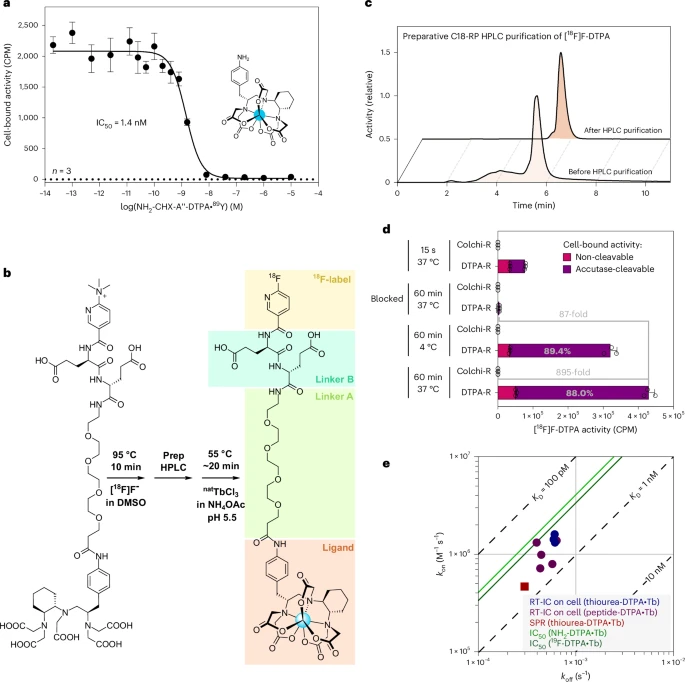
结合实验表明,DTPA-报告细胞对[¹⁸F]F-DTPA的结合量比野生型高出约1000倍,且可用过量非放射性配体彻底阻断(>100倍抑制),表明高度特异。进一步通过实时相互作用流式细胞仪、表面等离子共振与IC₅₀测定,获得了200–600 pM范围内的稳定亲和常数,完全符合PET微摩尔以下的定量要求。由于DTPA报告基因不含内吞信号,绝大多数配体停留于细胞表面,便于定量。
活体PET成像:肿瘤异种移植验证
将PC3细胞分别在小鼠两侧皮下移植,左肩为DTPA报告基因阳性,右肩为对照基因阳性。静脉注射11.4 MBq[¹⁸F]F-DTPA后,动态PET显示极快的肾脏清除,肾—输尿管—膀胱信号迅速上升,但其他组织背景几乎为零。报告基因肿瘤在30–90分钟内稳定达22.8 ± 0.6%注入剂量百分比峰值,报告/对照肿瘤比高达125倍,肿瘤/血液比达到261。6小时后仍保留48%初始信号,证实高体内稳定性。组织切片和尿液SEC分析显示,3小时尿样中>97%配体仍以完整形式存在。
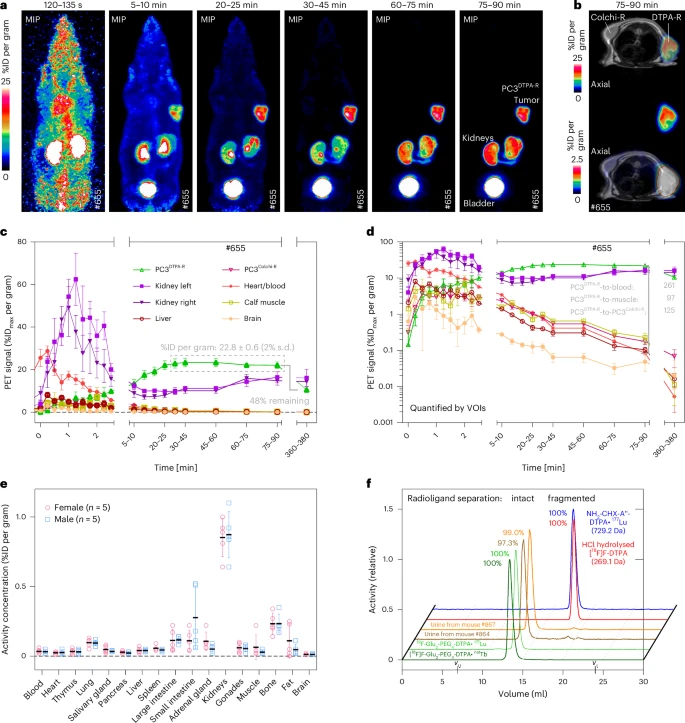
相比之下,秋水仙碱报告配体因亲水性不足出现高达70%肝胆排泄,胃肠道强烈背景不利成像。综合配体性质、报告基因表达和成像特性,团队最终聚焦于DTPA-anticalin系统的深入开发。
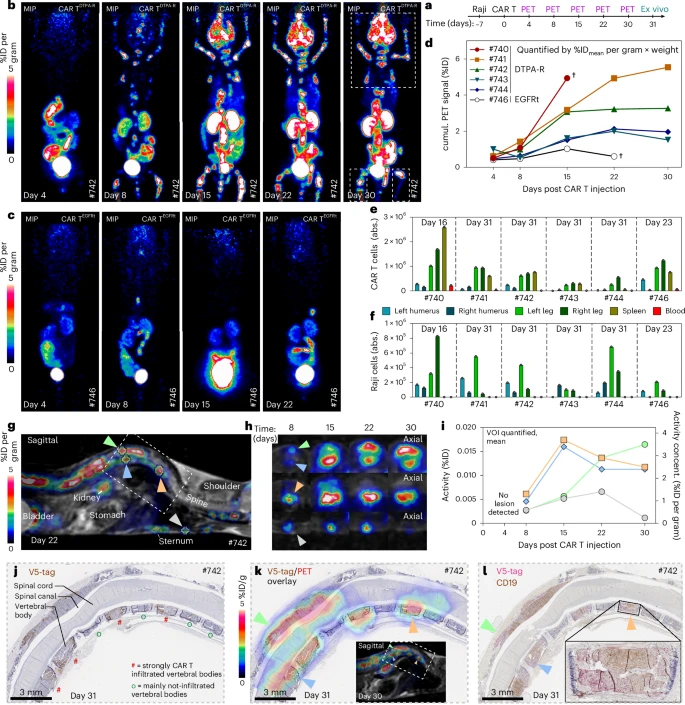
CAR-T疗法的PET追踪:从体内扩增到骨髓定位
在CD19 CAR T细胞治疗模型中,研究者将EGFRt分选标签替换为DTPA-报告基因,构建了功能等同的αCD19-CAR T DTPA-R细胞。其在PBMC中稳转效率与CD4/CD8比例、T细胞亚群分布均与EGFRt对照组一致,体外xCELLigence实时细胞杀伤和⁵¹Cr释放实验均表明两者功能无差异。小鼠NALM6和Raji淋巴瘤模型的体内疗效(生存率、体重维持与荧光成像)也高度重合。
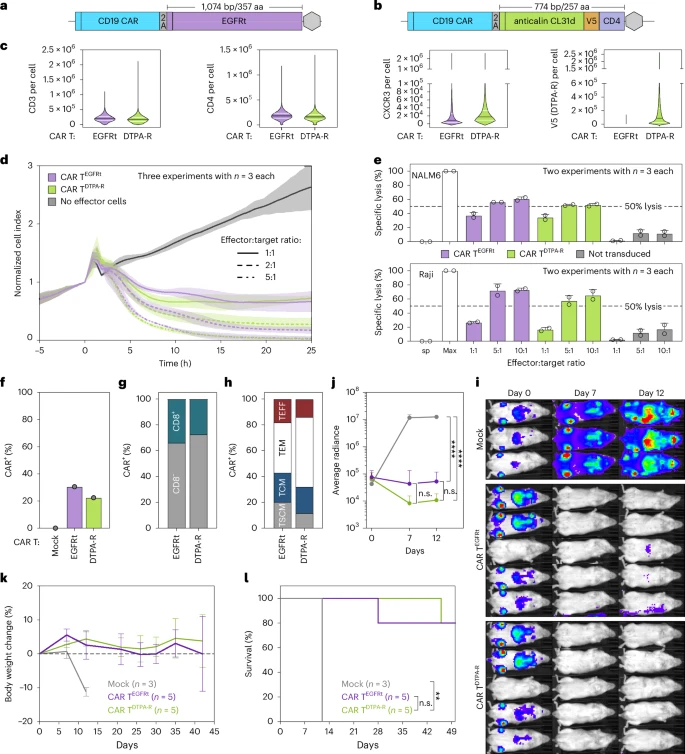
为获得持续扩增与定位信号,小鼠注射Raji细胞7天后给予2×10⁶ CAR T DTPA-R,并在第4、8、15、22、30天进行PET扫描。第4天探测到脾脏信号,第8天起信号逐渐在四肢骨髓、脊柱、颅骨及腋淋巴结显现,并随时间呈指数上升。EGFRt对照组全程无信号。PET信号积分定量与终点流式细胞法定量CAR T / Raji比例高度相关,验证了PET定量与生物学评价的一致性。
AAV基因转移的可量化成像
除了CAR T,研究团队还将报告基因整合至AAV载体,用于感染肝细胞和肌肉细胞体内基因转移实验。小鼠肌内注射AAV-DTPA-R后,5天即见注射部位PET信号显著高于对照侧,并随时间线性增长。剪切、组织切片与RT-PCR联合验证,无报告基因整合的肝脏及非注射肌肉区域均无信号,印证系统可用于定量、纵向监测AAV介导的基因表达。 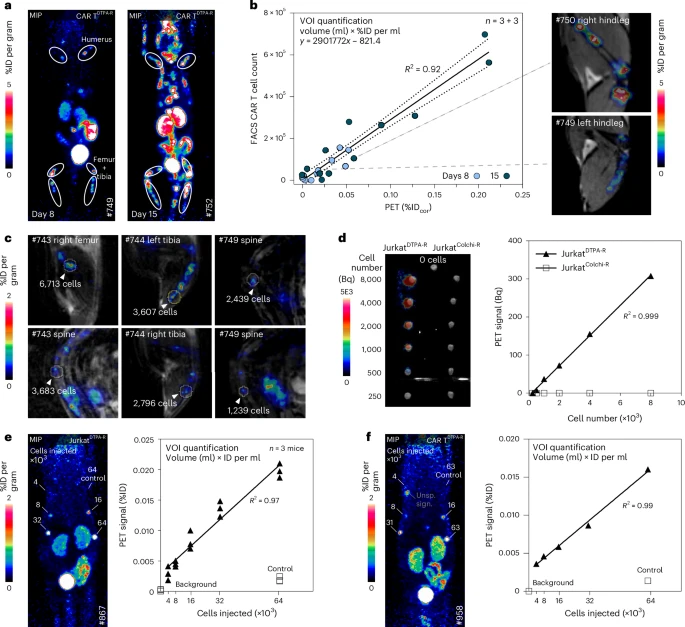
优势与前景:开辟ATMPs“活药片”成像时代
此抗钙素+¹⁸F镧系配合物组合具备多重优势:小分子报告蛋白免疫原性低、体内无内源表达干扰;配体化学合成简单,易于18F标记,体内快速清除;信号与细胞扩增成正比,具备高灵敏度与定量能力。相较传统直接标记,其可显示细胞分裂后的扩增动态;相较荧光或生物发光,其适用于深部成像;相较内源报告基因,其信号更特异、免疫耐受性更好。
未来,该技术可无缝对接临床PET/CT及PET/MR,实现CAR T疗程个性化调整、AAV载体输注剂量优化和多种细胞基因疗法的联合安全评估。此外,可扩展至造血干细胞、胚胎干细胞衍生移植等多种ATMPs研发场景。伴随“全身+时空+定量”成像需求的快速增长,抗钙素报告系统正引领免疫细胞与基因治疗的数字化、可视化与精准化新时代。
参考文献
Morath, V., Fritschle, K., Warmuth, L. et al. PET-based tracking of CAR T cells and viral gene transfer using a cell surface reporter that binds to lanthanide complexes. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01415-7