【Nat. Biomed.Eng.】AI揭秘大脑疾病的共同根源:一项颠覆性研究的深度解读
引言:打破“一病一因”的传统观念
在医学领域,我们习惯于将疾病分门别类,例如阿尔茨海默病(老年痴呆)、自闭症谱系障碍、晚发性抑郁症和精神分裂症,它们各有其诊断标准和治疗方案。然而,一个长期困扰科学家和医生的难题是:这些看似不同的大脑疾病,在症状、病理机制乃至遗传基础上,常常表现出令人困惑的重叠和共性 。这使得精准诊断和治疗变得异常困难,因为同一个诊断标签下的患者,其内在的生物学机制可能千差万别。
2025年6月6日发表于《自然·生物医学工程》的一篇重磅研究,利用尖端的人工智能(AI)技术,为我们提供了一个全新的视角来审视这一挑战。由Junhao Wen博士和Christos Davatzikos教授领衔的团队,通过分析海量的大脑影像和基因数据,发现并验证了9种跨越四种主要大脑疾病的“神经影像标记”,并揭示了它们与全身健康及遗传因素之间错综复杂的联系。这项研究不仅挑战了传统疾病分类的界限,更为未来实现大脑疾病的精准医疗铺设了重要基石。
核心概念解析:什么是“维度神经影像内表型”(DNE)?

为了理解这项研究的精髓,我们首先需要弄懂一个关键概念——维度神经影像内表型(Dimensional Neuroimaging Endophenotypes, DNEs)。让我们把它拆解开来,用通俗的方式理解:
神经影像(Neuroimaging):这很简单,指的就是我们常说的“脑部扫描”,比如核磁共振(MRI),它可以清晰地展示大脑的结构。
内表型(Endophenotype):这是一个非常重要的概念。如果说疾病的最终表现(如记忆衰退、社交障碍)是“外表型”,那么“内表型”就是介于基因和最终症状之间的、可被客观测量的生物学标记。它就像一座桥梁,连接着我们与生俱来的遗传密码和最终可能出现的疾病症状。因为内表型更接近病理根源,所以它比临床症状更能稳定地反映遗传和生物学本质。
维度(Dimensional):这代表了一种全新的疾病观念。传统诊断常常是“非黑即白”的,比如“有”或“没有”某种病。而“维度”则认为,疾病特征是以一种连续谱的形式存在的,就像一个滑块,可以从0%到100%变化。一个人可能不完全符合任何一个“典型”的疾病亚型,而是同时表现出多种疾病模式的特征,比如“70%的模式A + 30%的模式B” 。
因此,DNEs可以被理解为:由AI从大脑扫描图像中识别出的、可量化的、连续的、与遗传紧密相关的特定大脑结构变化模式。 每一个DNE都代表了一种独特的大脑解剖学“指纹”,而一个个体的大脑,可能是这多种“指纹”的复杂组合。
研究的宏伟蓝图:三步走战略
这项研究的设计思路清晰而宏大,可以概括为“三步走”战略(如图1所示):
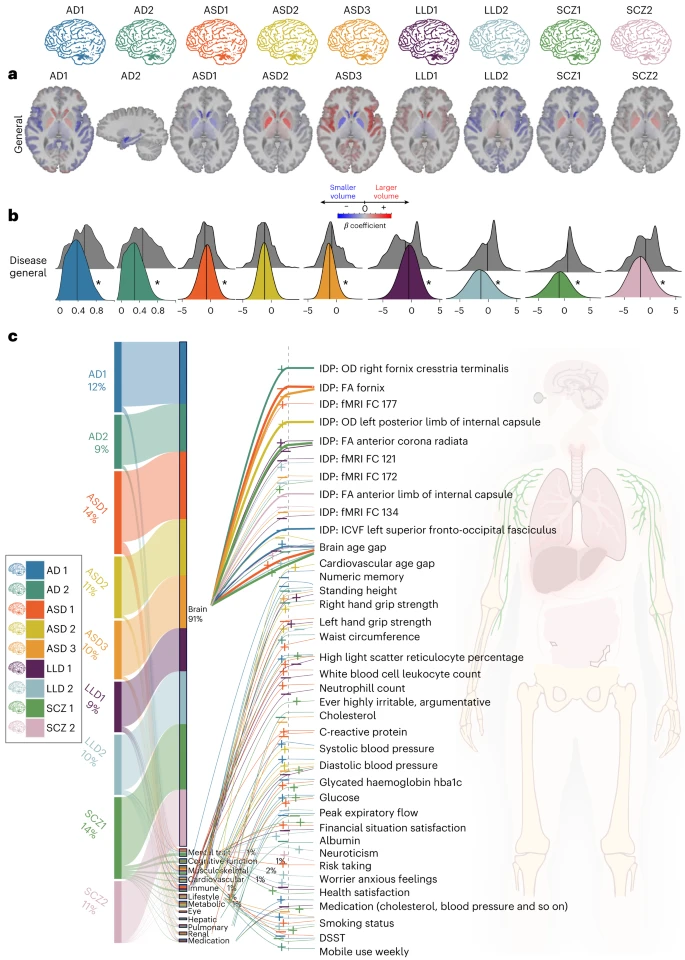
第一步:AI学习与DNE的定义
研究团队首先利用了四个独立的、针对特定疾病的大型数据库,分别涵盖阿尔茨海默病(AD)、自闭症谱系障碍(ASD)、晚发性抑郁症(LLD)和精神分裂症(SCZ)的患者及健康对照组。
他们使用了先进的半监督式AI学习算法(如HYDRA和Surreal-GAN) ,让AI“学习”患者大脑与健康人大脑之间的结构差异。
通过这种学习,AI自动识别并提炼出了9种不同的、具有代表性的大脑结构变化模式,即9个DNEs。例如,有的DNE表现为大脑特定区域的萎缩(体积减小),有的则表现为某些区域的异常增大(体积增加)。
第二步:在普通人群中进行验证
研究的核心创新之处在于,他们没有将这9个DNEs局限于原有的疾病人群,而是将训练好的AI模型应用到了一个规模极其庞大的普通人群数据库——英国生物银行(UK Biobank),分析了其中近4万名参与者的大脑影像数据。
他们的目标是验证:这些在特定疾病患者身上发现的大脑模式,是否也存在于没有明确诊断的普通人群中?如果存在,其表现程度如何?
第三步:深度关联分析
- 在确认了DNEs在普通人群中的普遍存在后,研究团队展开了大规模的深度分析,试图回答以下几个核心问题:
表型关联:这9个DNEs与人们的认知能力、生活方式以及大脑之外的其他身体系统(如心血管、代谢系统等)健康状况有何关联?
遗传关联:这些DNEs背后是否有坚实的遗传基础?它们的遗传密码是什么?
预测能力:这9个DNEs及其对应的遗传风险评分(PRS),能否帮助我们预测未来患上14种不同系统性疾病的风险,甚至预测死亡风险?
重磅发现:解码大脑、基因与健康的复杂网络
通过上述研究设计,该团队获得了一系列突破性的发现,共同描绘了一幅关于大脑、基因与全身健康之间相互关联的复杂画卷。
### 发现一:疾病的“幽灵”普遍存在于普通人群的大脑中
研究证实,最初在四种大脑疾病患者中识别出的9种DNEs,确实也广泛存在于UK Biobank的普通人群中。这说明,很多看似健康的人,其大脑中也可能潜藏着与某种疾病相关的结构特征,只是表现程度不同而已。
- 具体的DNE模式:
AD1, LLD2, SCZ1:这三种DNE都表现为广泛的大脑皮层萎缩,尤其是在脑岛、额中回等区域。这可能是衰老或神经退行性变的早期信号。
AD2:表现为内侧颞叶(记忆中枢海马体所在区域)的局灶性萎缩,这是阿尔茨海默病的经典标志。
ASD2, SCZ2:有趣的是,这两种DNE表现为基底节(如苍白球)等皮层下区域的体积_增大_ 。研究者推测,这可能与某些保护性因素(即“大脑储备”)有关,也可能与药物影响或神经环路的功能失调有关。
ASD1, ASD3, LLD1:这些DNE则展示了更复杂的、涉及不同脑区增减的模式。
这一发现的意义在于,它模糊了“健康”与“疾病”的绝对界限,提示大脑疾病可能是一个漫长的、从量变到质变的过程。DNEs为我们提供了一种在临床症状出现前,识别高风险个体的潜在工具。
### 发现二:大脑并非孤岛,DNEs与全身健康息息相关
通过“全表型关联分析”(PWAS),研究发现DNEs的影响远远超出了大脑本身。在排除了用于定义DNE的大脑结构数据后,研究者发现这些DNEs与另外611项健康指标中的1818项存在显著关联。
91%的关联仍与大脑相关:这不难理解,DNEs毕竟源于大脑影像。它们与大脑白质微结构、功能连接、甚至“大脑年龄差”(即AI预测的大脑生理年龄与实际年龄的差距)等指标高度相关。
但更重要的是跨系统的关联:研究发现DNEs与骨骼肌肉系统(如握力)、代谢系统(如胆固醇、血糖)、以及精神健康指标(如神经质评分)等都有显著联系。这为“身心一体”提供了强有力的生物学证据,表明大脑的细微结构变化与全身的生理状态是紧密相连的。
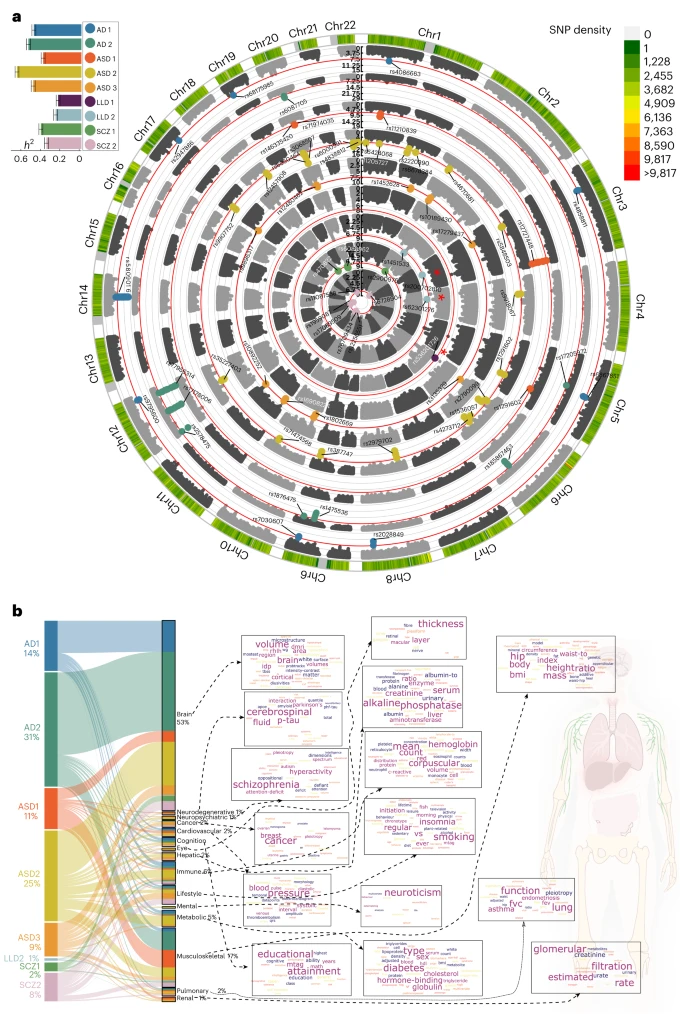
### 发现三:追根溯源,找到31个关键基因位点
如果说DNEs是连接基因和疾病的桥梁,那么找到这座桥梁的“地基”——遗传位点,至关重要。通过“全基因组关联分析”(GWAS),研究团队成功识别出与这9个DNEs显著相关的66个基因组区域,其中31个在经过最严格的统计学校正后依然显著。
遗传力:研究发现,所有9个DNEs都具有中到高度的遗传力(h2 介于0.24到0.66之间),意味着这些大脑模式在很大程度上是由基因决定的。
基因功能:通过对这些基因位点的功能注释,研究发现它们不仅与大脑发育、神经递质等功能有关,还大量涉及到免疫、肌肉、代谢等其他身体系统的相关性状。例如,与AD2(内侧颞叶萎缩)相关的基因位点,也同时与身高、吸烟行为、认知表现等多种性状有关联。
基因发现与表型发现的呼应:遗传层面的发现与表型层面的发现高度一致,再次证明了DNEs所代表的大脑模式,其生物学根源是跨越多个人体系统的。
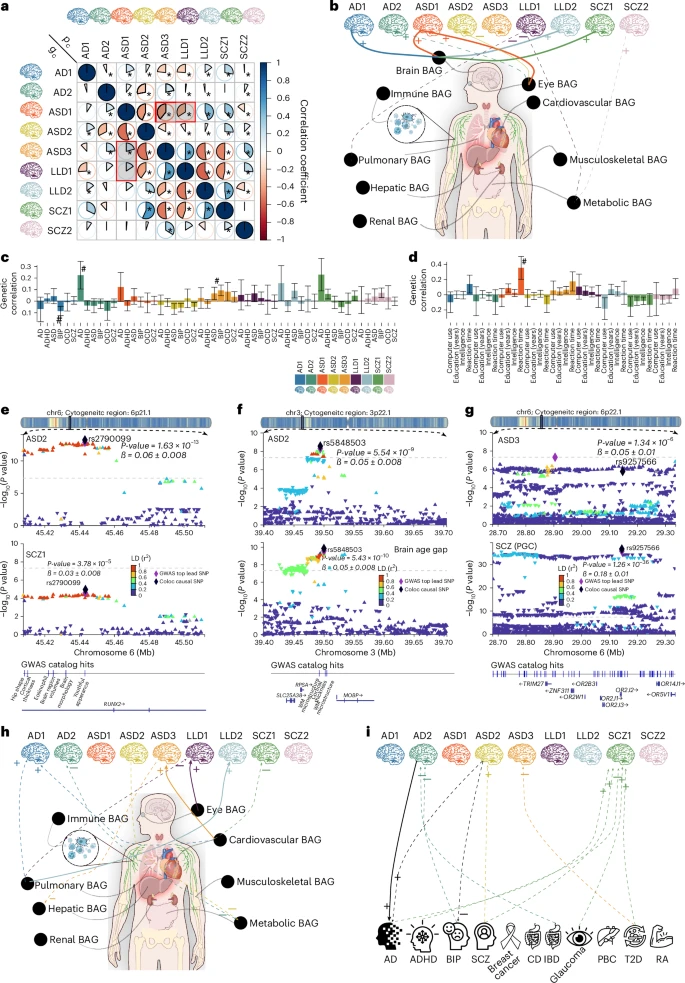
### 发现四:揭示不同大脑疾病间的“秘密关系”
这项研究最引人入胜的部分,是它揭示了不同大脑疾病之间深层次的遗传关联。
遗传相关性:研究发现,许多DNEs之间存在强烈的遗传相关。例如,ASD2(自闭症模式)和SCZ1(精神分裂症模式)在遗传上表现出高达0.57的正相关,意味着它们共享了大量的遗传风险因素。这一发现为长久以来关于自闭症和精神分裂症可能存在共同病理基础的争论提供了新的证据。
基因与环境的博弈:研究还发现了一个有趣的现象,即某些DNEs之间的“表型相关性”和“遗传相关性”方向相反。例如,ASD1和LLD1在表型上呈负相关,但在遗传上却呈正相关。这暗示,非遗传因素(如环境、生活方式)可能在这两种大脑模式的形成中扮演了与遗传效应相反的“博弈”角色。
共享的致病基因:通过更高级的“贝叶斯共定位”分析,研究进一步锁定了在不同DNEs之间、以及DNEs与疾病之间共享的“因果”基因变异。例如,他们发现ASD2和SCZ1在第6号染色体上的一个区域共享了一个因果变异,而ASD3和精神分裂症在另一区域也共享了因果变异,该区域富含与嗅觉功能相关的基因,而嗅觉功能障碍在多种大脑疾病中都有报道。
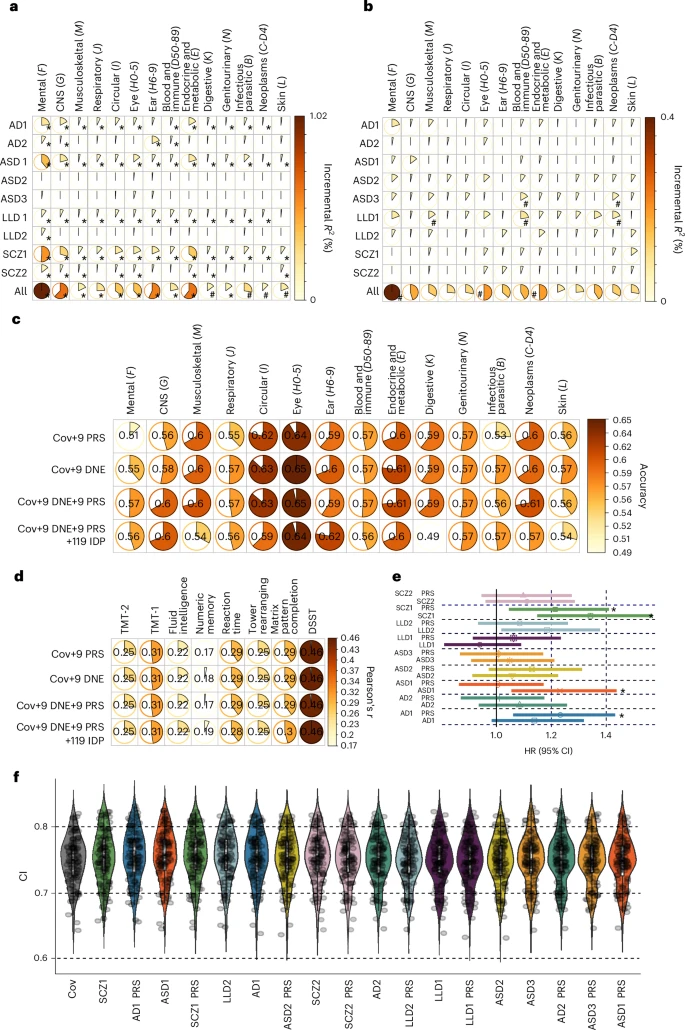
### 发现五:从预测到预防,DNE的临床应用潜力
最终,研究的落脚点是评估这些新发现的实际应用价值。
预测全身性疾病:研究表明,将9个DNEs的得分及其对应的多基因风险评分(PRS)结合起来,可以显著提升对14大类全身性疾病的预测能力,尤其是在精神与行为障碍和中枢神经系统疾病这两类上,预测增益最为明显。
预测死亡风险:在死亡风险预测模型中,多个DNEs(如SCZ1, ASD1)及其遗传风险评分也被证明是显著的预测因子。
支持“内表型假说”:通过因果推断分析,研究发现AD2(内侧颞叶萎缩模式)对阿尔茨海默病的发生存在单向的因果关系,即AD2的出现是导致AD发生的原因之一,但反之不成立。这为“内表型”是疾病因果链条上的中间环节这一核心假说提供了强有力的支持。
研究的深远意义与未来展望
这项研究的意义是多方面的,它为我们理解和应对复杂的大脑疾病提供了全新的思路:
迈向“跨诊断”新范式:研究结果强烈支持,我们应该超越传统的、基于症状的疾病分类,转向一种“跨诊断”(Transdiagnostic)的视角,关注潜藏在多种疾病背后的共同生物学机制 。未来的治疗可能不再是针对“抑郁症”或“精神分裂症”,而是针对特定的DNE,比如“改善大脑皮层萎缩”或“调节基底节功能”。
强调“整体健康”的重要性:研究反复证明了大脑健康与全身健康的密不可分。大脑的健康状况受到心血管、免疫、代谢等系统的深刻影响,反之亦然 。这提示我们,预防和治疗大脑疾病,必须采取一种全面的、整体性的健康管理策略,关注饮食、运动、生活方式等方方面面 。
开启精准诊断与早期干预之门:DNEs作为高度遗传、可量化、且在症状出现前就可能存在的生物标记,为大脑疾病的精准医疗带来了曙光 。未来,通过一次大脑扫描,AI或许就能评估出个体大脑中各种DNEs的“表达谱”,从而进行个性化的风险评估,并针对性地采取预防措施,将干预时机从“亡羊补牢”提前到“未雨绸缪” 。
结语
总而言之,Junhao Wen博士及其团队的这项研究,完美地融合了人工智能、大数据、神经科学和遗传学,通过构建和验证DNEs这一创新概念,不仅深刻揭示了四种主要大脑疾病之间共享的生物学和遗传基础,还为我们描绘了一幅连接大脑、全身器官、基因与生活方式的宏观健康网络。它代表着我们向真正理解和征服大脑疾病这一终极挑战迈出的、坚实而又充满希望的一步。
参考文献
Wen, J., Skampardoni, I., Tian, Y.E. et al. Neuroimaging endophenotypes reveal underlying mechanisms and genetic factors contributing to progression and development of four brain disorders. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01412-w