【Nat. Biomed. Eng.】💡“9项生理指标+3种化学信号:集成型手环实现糖尿病全景监测新纪元!”
引言:从“只测血糖”走向“全面体征管理”
过去20年,随着连续血糖监测(CGM)技术的发展,糖尿病管理迎来了巨大的飞跃。CGM设备通过皮下针状电化学传感器,能够追踪皮下组织液(ISF)中的葡萄糖水平变化,极大地提升了血糖控制的及时性与安全性。
但问题也逐渐暴露:**当今市面上的所有CGM设备几乎都仅限于“单一指标”——也就是血糖的变化。**这对于一个因多因素而引发复杂病理过程的慢性疾病来说,显然远远不够。餐后血糖波动、运动影响、精神应激乃至酒精摄入都可能造成血糖大幅震荡,然而这些影响因素并不能通过单一葡萄糖信号得以体现或解释。
于是,一个亟需解决的难题浮现:如何突破“单参量”桎梏,实现多维度、全生命周期的糖尿病监测与风险预警?
创新亮点:“化学+物理”双模集成手环系统正式登场
在这篇2025年《Nature Biomedical Engineering》刊发的重磅论文中,美国加州大学圣地亚哥分校与多机构的联合研究团队提出了一种名为 BLUE(Biomarker-Linked Ultrasound Electronics) 的集成可穿戴平台。
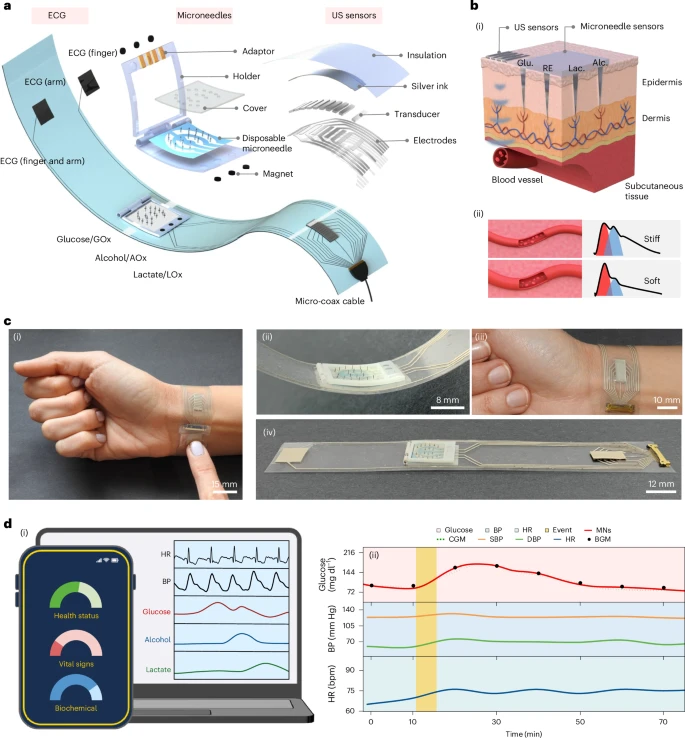
这是一款柔性手环,不仅包含 微针电化学传感阵列(采集ISF中的葡萄糖、乳酸、酒精),还融合了 超声波模组(实时获取动脉血压、心率、动脉僵硬度)以及ECG生物电信号检测,构成了9项多模生理–化学信号联动系统,涵盖从分子层代谢活动到心血管功能状态的完整数据图谱。
其核心构想在于:
将微型“诊断实验室”嵌入穿戴设备,随时洞察糖尿病患者的“内化世界”与“外在状态”,助力个体化干预与并发症早预警。
系统结构详解:9大指标一环掌握,动态精准
这个手环系统从结构上分为三大核心模组:
**微针传感阵列:**使用SU-8材料制造,长度约800μm,插入皮肤角质层至真皮层,无需抽血便可连续监测ISF中葡萄糖、乳酸与酒精浓度。每项指标通过对应的氧化酶(GOx、LOx、AOx)产生电流信号。
**超声模组:**10个柔性压电超声探头(总面积3×1 cm)布设于手腕桡动脉区域,测得血管搏动回波进而导出收缩压、舒张压、动脉顺应性。
**ECG电极:**银墨印刷电极分别设置于手环内外,佩戴者手指轻触即可采集完整的单导心电数据,用于推导HR和R-R间距变化。
不仅如此,整个系统的柔性设计确保了即便在剧烈运动(如篮球、俯卧撑、跳绳)过程中仍能保持传感器与皮肤良好接触,数据不易丢失,展现出强大的动态信号获取能力。
信号采集速率对比与精准度验证:全面碾压传统CGM
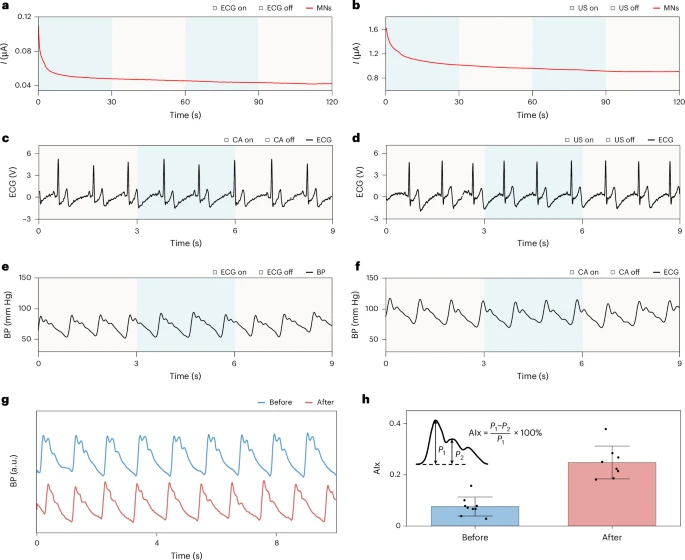
在实验中,研究者将该系统与传统CGM设备和血糖仪进行了并行比对:
- 在摄入含糖饮料后,BLUE系统与CGM的信号响应高度一致,并能以每秒级(1 Hz)频率记录葡萄糖变化,而传统CGM为每分钟1次;
- 与指尖血糖仪相比,BLUE系统的平均绝对相对误差(MARD)仅为4.68%,而CGM为5.40%,显示出甚至优于主流商业设备的实时检测性能;
- 在该过程中,血压、HR、动脉僵硬度等指标同步记录,揭示了葡萄糖上升与心血管参数协同变化的内在联系。
多人多场景动态测试:从饭后到运动,场景驱动信号互动图谱绘制
该手环系统在多位志愿者、多个场景下均完成了动态测试,深入探索了不同行为刺激(饮食、运动、饮酒)对代谢–生理信号的联动效应。
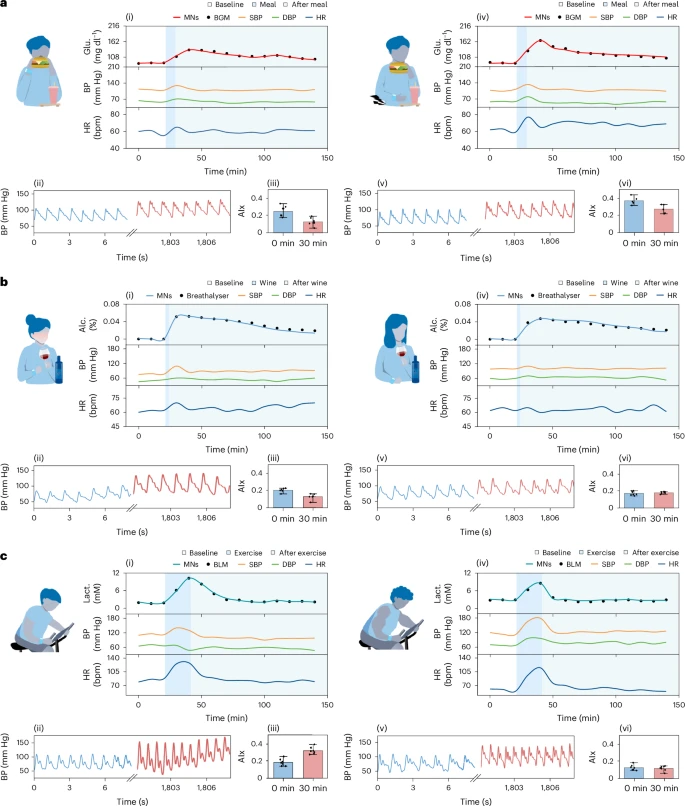
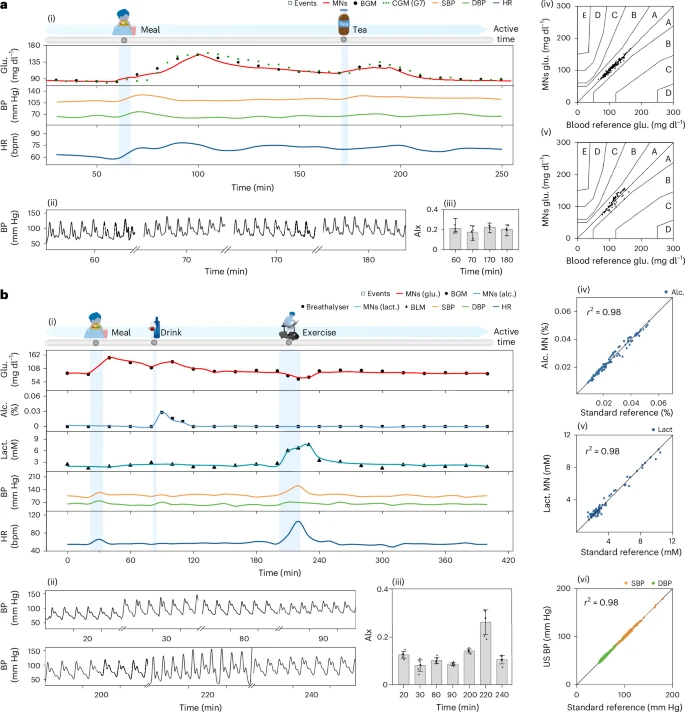
1. 餐前vs餐后(空腹8小时与非空腹对比)
- 空腹进食后血糖峰值高达166 mg/dL,心率上升10%以上,动脉僵硬度AIx提高0.11;
- 非空腹组峰值为133 mg/dL,心率与动脉弹性变化更温和;
- 同时BP也从107/59上升至132/80(空腹组);
- 提示空腹状态下代谢应激反应增强,对血管系统影响显著。
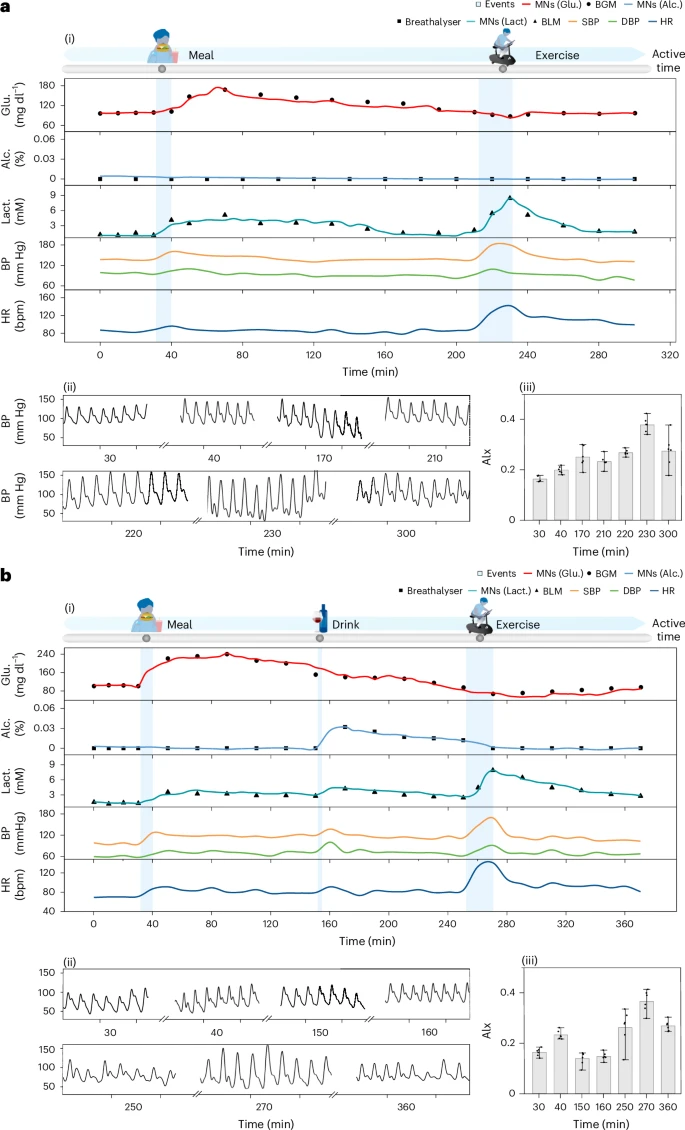
2. 饮酒组对比(习酒与不饮酒者)
- 两人均饮用150 ml红酒(13.5%酒精);
- 非习酒者血压短时间上升达16 mmHg,HR升高,动脉僵硬度增加显著;
- 习酒者变化幅度更小,提示酒精耐受性可缓冲心血管应激;
- ISF中酒精浓度变化与呼气检测结果高度匹配,表明微针可作为合法酒测替代方案。
3. 运动组对比(专业运动员 vs 普通人)
- 20分钟高强度训练后,两组人乳酸水平均显著上升;
- 专业运动员乳酸升幅较小(1.3 → 3.2 mmol/L),普通人则从0.9 → 5.8 mmol/L;
- 后者心率波动幅度亦更剧烈,BP上升近30 mmHg;
- 这显示了BLUE系统对耐力水平与疲劳态检测的潜在应用。
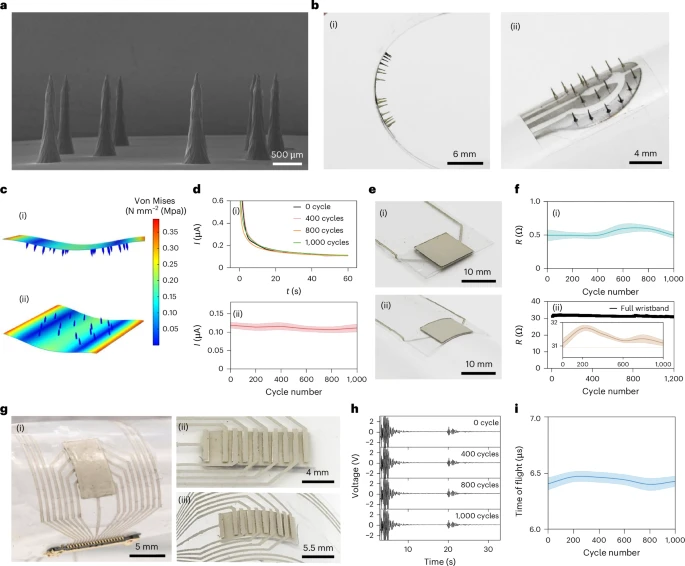
灵敏性+稳定性+柔性:从结构到材料的工程解法
系统的可行性不仅依赖于传感器本体性能,还受到材料工程技术的严苛挑战。研究者采用如下策略实现三重保障:
- **机械柔性测试:**整套设备在反复1000次的0.35 rad弯曲测试后仍保持信号稳定,无形变、无断裂;
- **微针尖端优化:**3D打印 + 干法蚀刻实现针尖小于10 μm而长度超过1 mm;
- **系统抗干扰设计:**所有模组保持3–5 cm距离,验证电化学、超声、ECG三者之间无串扰干扰。
这种**“独立信号源 + 空间隔离结构”**设计为后期系统可扩展升级(如引入更多化学通道)打下了坚实基础。
医疗价值与未来展望:向闭环调控系统迈进
作者指出,糖尿病的最佳干预策略应是**“闭环系统”**,即将生理状态实时监测、算法运算与药物释放(如胰岛素泵)进行整合,实现动态反馈与个体化精准调控。
目前市面上的闭环系统仍主要基于单一葡萄糖通道。而BLUE平台的问世,为“多模感知–智能识别–精准给药”三级闭环奠定了硬件基础。
未来,该系统可与机器学习算法深度融合,实现:
- 患者特征聚类与风险等级预估;
- 新发糖尿病前期个体早筛;
- 心血管并发症风险预警;
- 药物反应个体差异分析。
此外,由于使用无血方式采集数据,其在儿童、孕妇、高龄患者中的接受度与安全性也更具优势。
参考文献
Chang, AY., Lin, M., Yin, L. et al. Integration of chemical and physical inputs for monitoring metabolites and cardiac signals in diabetes. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01439-z