【Nat. Biomed. Eng.】🚀3大病毒+3类巨噬+3重靶向:MaugO模型10天精准重现急性病毒病理并筛选9款多靶疗法
在许多急性病毒疾病中,患者的病理进程并不仅仅由病毒复制决定,更是免疫细胞参与的炎症反应与继发性细胞死亡共同塑造的复杂动态。这种多维度的病理特征在传统的体外模型中难以得到全面再现:单层细胞无法模拟三维组织结构,缺少免疫细胞的参与;小鼠模型的免疫系统与人类差异巨大;现有的类器官体系仅能重建上皮或实质细胞,却无法整合功能性免疫细胞。为此,Liu等人在2025年6月发表于《Nature Biomedical Engineering》上,提出并系统验证了一种**宏噬细胞增强类器官(Macrophage-augmented organoids, MaugOs)**平台,首次实现了在人源类肝器官中原位整合多来源、多极化状态的巨噬细胞,并在短短10天内精准重现包括HEV、SARS-CoV-2和MPXV在内的三大急性病毒感染全程。
一、背景:急性病毒疾病的多维病理与模型短板
急性病毒性肝炎、COVID-19相关肝损伤以及罕见的猴痘肝炎,均伴随着原发病毒复制、病理性炎症与免疫介导的细胞死亡三大环节。尤其在肝脏这一具有免疫耐受特性的组织中,常驻与募集的巨噬细胞不仅是病原识别的第一道防线,更通过NLRP3炎症小体和细胞因子级联生成强烈的炎症反应,既参与抗病毒清除,又主导病理性损伤。传统的2D单层细胞系模型无法模拟巨噬细胞与肝实质细胞的空间交互;小鼠模型因免疫差异高、周期长且成本大,也无法满足高通量药物筛选需求;而仅包含胆管系或肝细胞的类器官体系虽然能支持某些病毒复制,却无法再现炎症和细胞死亡的关键环节。这一“无免疫”或“免疫缺失”的缺口,一直难以填补。
二、MaugO的构建:从多源巨噬到功能整合
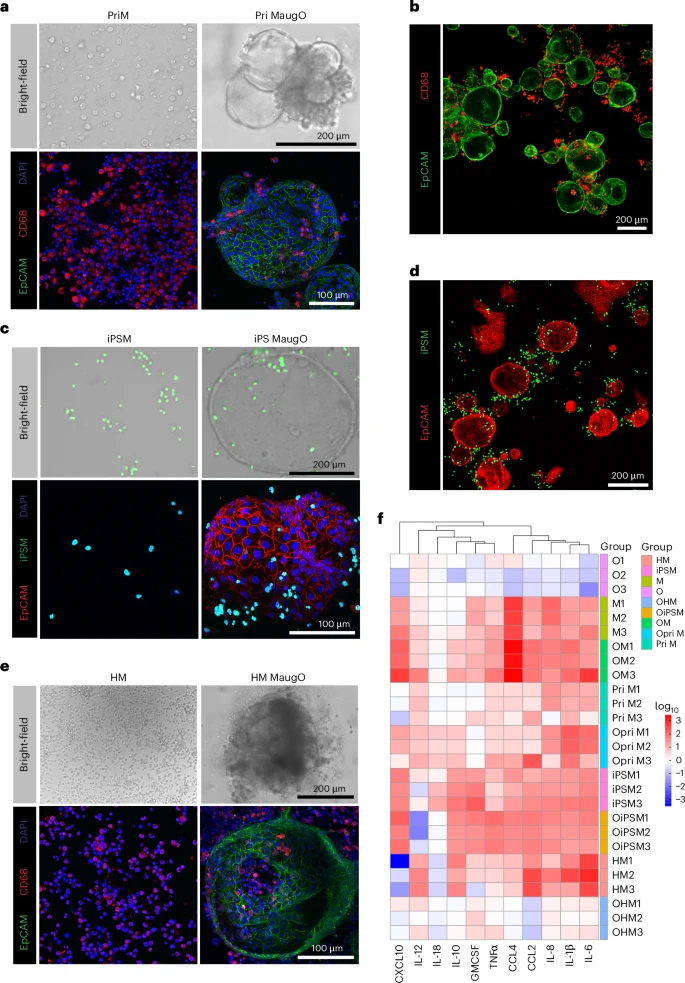
为了在同一体外体系中同时捕捉病毒复制、炎症放大与免疫介导的细胞死亡,研究团队以**人肝胆管系类器官(Intrahepatic Cholangiocyte Organoids, ICOs)**为基底,集成三种主要来源的巨噬细胞(THP-1单核衍生、外周血单核衍生、iPSC衍生及肝组织中分离的巨噬细胞),并根据经典小鼠和人外周血模型,构建了M0(未激活)、M1(促炎)与M2(抑炎)三种极化亚型。
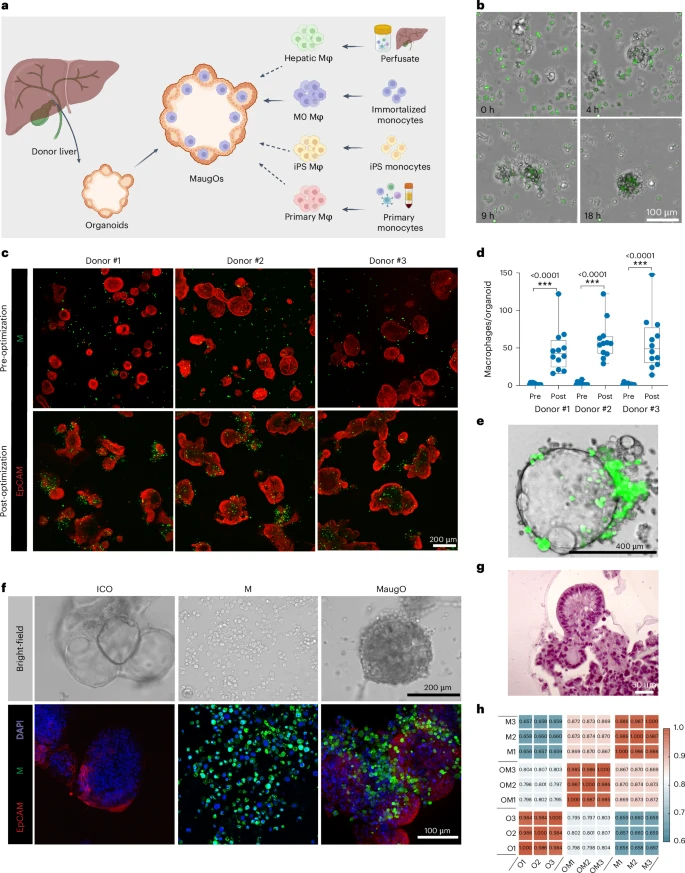
团队首先对Matri gel浓度和类器官碎片大小进行精准优化,使得巨噬细胞能够在24小时内从外部逐渐迁移并包裹进ICO小球内部,形成直径约200–500微米的MaugO微型三维结构。通过共聚焦显微成像与H&E染色,展示了集成后近一半体积的MaugO内部已被CD68阳性巨噬细胞均匀包裹;RNA-seq分析则证明MaugO在转录组水平上呈现介于ICO与单独巨噬细胞之间的混合特征,且保留了上皮系和免疫系的关键基因表达。无论是THP-1源的MaugO,还是iPSC-巨噬整合的MaugO,或是外周血源与肝组织来源的MaugO,都在M0┄M1/M2三种微环境下展现了高度可重复的结构与功能特征。
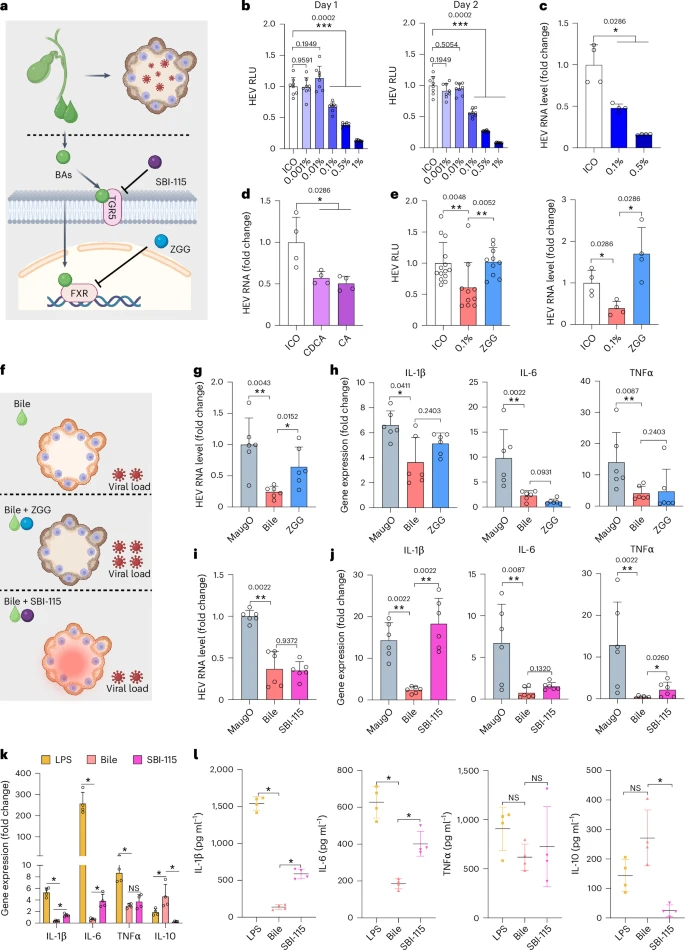
三、HEV感染模型:病毒复制与炎症双轨并行
HEV作为最常见的急性肝炎病原,经胆汁-粪便途径传播,对肝细胞与胆管上皮、巨噬细胞均有侵染能力。实验中,团队在ICO中先行接种HEV,随后引入M0巨噬细胞形成MaugO结构,并在24–48小时内实时监测病毒传播。
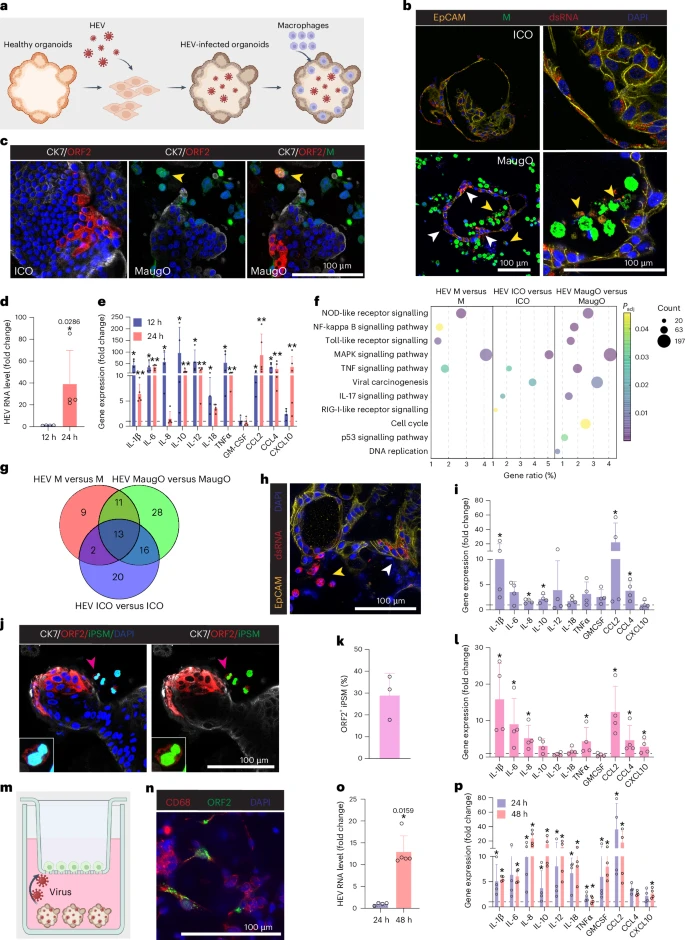
通过dsRNA与ORF2蛋白染色,首次完全可视化了病毒由ICO向包裹在外围的巨噬细胞中的传染过程;qRT-PCR定量显示,MaugO中的HEV RNA在12至24小时内增加近40倍。与此同时,以IL-1β、TNFα、CCL2等为代表的促炎因子在HEV-MaugO体系中较未感染对照组飙升10至100倍,明确再现了典型的细胞因子风暴趋势。相比之下,单独ICO或巨噬细胞在相同条件下均难以引发如此剧烈的炎症反应,凸显了MaugO在模拟复杂病理中的独特价值。
3.1 宏基因组学揭示多层通路激活
全转录组通路富集分析显示,MaugO感染组中“NOD样”“Toll-样受体”及“NF-κB信号通路”等免疫识别与炎症放大通路被高度激活,且被调控基因数量远超ICO或单独巨噬组(68 vs. 35 vs. 51),表明上皮细胞与巨噬细胞协同响应是MaugO重现复杂病理的关键驱动。
四、巨噬极化与细胞死亡:M1驱动最强病理损伤
在M0/M1/M2三种MaugO模型中,促炎M1亚型展现出最强的HEV诱导响应:不仅IL-1β、TNFα等炎性因子分泌量最高(约800 pg/ml vs. 500 pg/ml),HEV RNA在胞内最低而胞外最高,表明病毒在胞内被高效复制后迅速释放。M1-MaugO还表现出最显著的LDH释放增高与Caspase-3裂解增强,PI染色提示最多的细胞死亡,清晰复现了炎症介导的细胞坏死/凋亡一体化病理。因此,M1亚型巨噬在MaugO体系中既是促炎主力,也成为病毒扩散与细胞损伤的“加速器”。
五、人胆汁多重功能:FXR通路抑制HEV复制与炎症
HEV在肝胆系统中经胆汁排放,暴露于高浓度胆汁酸环境。团队基于MaugO与HEV复制报告体系,首次证明人胆汁及其主要组分CA/CDCA在体外可依赖FXR通路显著抑制HEV复制(抑制率>80%),而添加FXR拮抗剂z-guggulsterone后抗病毒效果完全消失。该发现为HEV的生物学特征与潜在宿主靶点治疗提供了直接证据,也印证了MaugO用于解析生理性小分子对病毒复制影响的灵活性。
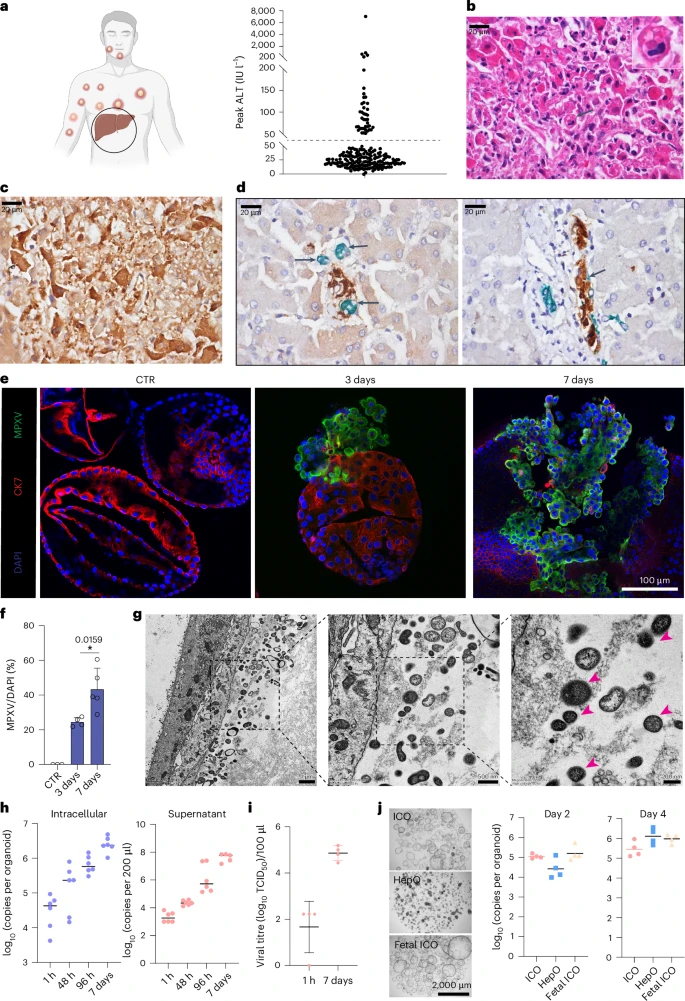
六、SARS-CoV-2与MPXV验证:跨病原体的一体化模型
除了HEV,MaugO同样能重建SARS-CoV-2与MPXV两种不同类型病毒的感染病理。SARS-CoV-2感染ICO后,快速传播至巨噬细胞并触发中度炎症反应,以IL-1β的显著升高最为典型。MPXV则在MaugO中呈现更缓慢的复制动态与独特的细胞死亡模式,结合组织学与转录组分析,清晰描绘了DNA病毒在肝环境中的病理演变。以上跨病原验证再次佐证,MaugO具备一种模型可兼容多种急性病毒的卓越灵活性和适用性。
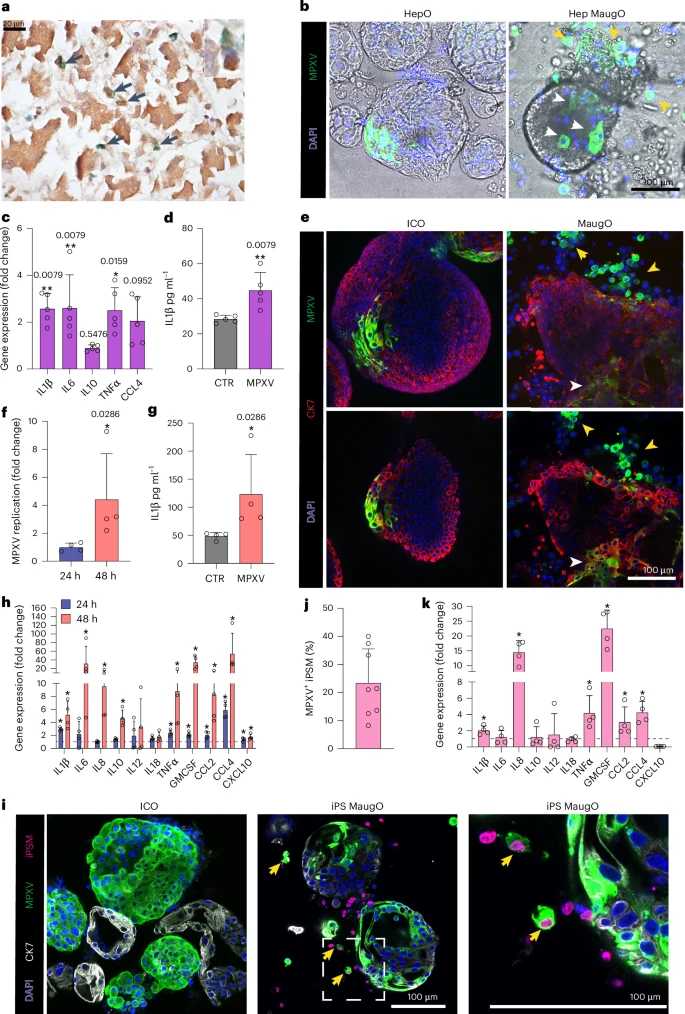
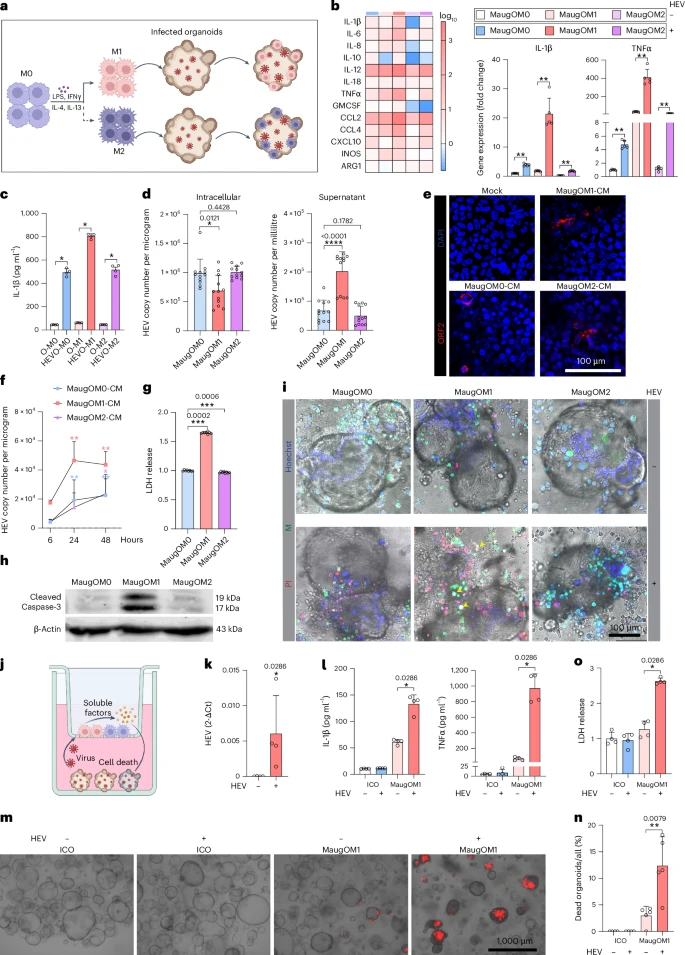
七、多靶点疗法开发:抗病毒+抗炎+抗死亡的组合策略
正如真实临床所需,单一抗病毒或单一抗炎往往无法同时抑制病原体复制与免疫介导的组织损伤。基于MaugO模型,团队系统筛选并验证了若干靶向药物与化合物,包括Remdesivir(RdRp抑制剂)、MCC950(NLRP3抑制剂)与Disulfiram(Gasdermin D抑制剂)等,并将其组合以期覆盖抗病毒、抑炎症、阻止细胞坏死三大环节。
研究表明,在HEV-MaugO体系中,三者单独使用均能在一定程度上抑制病毒复制或减轻炎症;而三种药物联合用药后,HEV RNA下降>95%,IL-1β与TNFα水平均显著降低至基线水平以下,LDH释放与Caspase-3活化亦被完全阻断,细胞死亡率恢复至未感染组水平。这一3重靶向、多机制组合,首次以体外人源三维模型形式展现了多靶点干预急性病毒病理的可行性。
八、前景与应用:从病毒模型到个性化疗效评估
MaugO体系的核心价值在于,它既可重现病毒生命周期+免疫反应+细胞死亡的全病理过程,又能在同一平台上开展高通量药物筛选+机理探索。未来,它有望应用于:
- 快速评估新兴病毒(如流感、HCV、登革热等)与特定宿主反应
- 验证个体化免疫治疗或抗炎疗法的病前预测
- 构建患者来源的病理模型,实现精准医学与预后评估
- 扩展至其他组织类器官(肺、肠、脑)与免疫细胞整合的复合模型
此外,与自动化液体处理和AI图像分析平台结合,MaugO有望在未来成为药企与研究机构的标配工具,助力新冠以来对抗急性病毒的多靶点、个性化治疗方案的加速落地。
九、结语
MaugOs以其“三维上皮-免疫复合体”的独特构建理念、兼顾了病毒、炎症与免疫介导的细胞死亡三重病理,以及多来源、多极化巨噬细胞的集成能力,为急性病毒疾病的发病机制解析和多靶点疗法开发提供了前所未有的“人源化微体外”平台。它打破了传统模型的局限,满足了对高通量、可重复、多维度解析与药效评估的迫切需求。正如研究所示,当病毒复制、炎症放大与细胞死亡被同步重现,并在同一平台上进行多重靶向策略验证时,我们距离真正的“精准抗病毒——精准抗炎——精准细胞保护”疗法,也仅有一步之遥。未来,MaugO将为公共卫生应对新发传染病和优化慢性病毒感染的综合防治,提供一条兼具效率与可靠的创新之路。
参考文献
Liu, K., Wang, Y., Li, J. et al. Macrophage-augmented organoids recapitulate the complex pathophysiology of viral diseases and enable development of multitarget therapeutics. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01417-5