【Nat. Biomed. Eng.】🚀“93.2%纯度诱导、3毫米类肝芽、6天实现灌流”:肝窦微血管自组织技术登场
在组织工程和类器官研究领域,如何复制体内器官的复杂血管网始终是最大难题之一。尤其对于肝脏而言,其特有的肝窦微血管系统不仅为肝实质细胞提供营养和氧气,更通过内皮细胞分泌的各种“血管体液”(angiocrine factors)指导肝细胞的分化与功能成熟。传统的类肝器官多以三维支架或基质胶包埋方式培养,虽然能够重建肝实质细胞群,但始终缺乏功能性、组织特异的肝窦内皮(LSEC)网络,更无法提供真实的血流灌注与分子交换。由此,肝类器官在代谢、药物筛查以至于再生医学应用上都存在明显瓶颈。2025年6月,Saiki等团队在《Nature Biomedical Engineering》上发表了一项革命性成果:他们直接从人iPSC分化出高达93.2%纯度的肝窦前体内皮细胞(iLSEP),并借助一种“反向多层气–液界面(IMALI)”三维培养技术,实现四类前体细胞的自顶向下共组装,最终生成直径约3.0毫米、在6天内建立完备血流灌注网络的类肝芽球(HLBO)。更令人惊叹的是,移植后该类器官还能够在体内分泌功能性凝血因子,成功矫正FVIII缺陷造成的严重出血表型,开创了类器官治疗血液学疾病的新天地。
从胚胎发育启发,分步构建LSEC前体
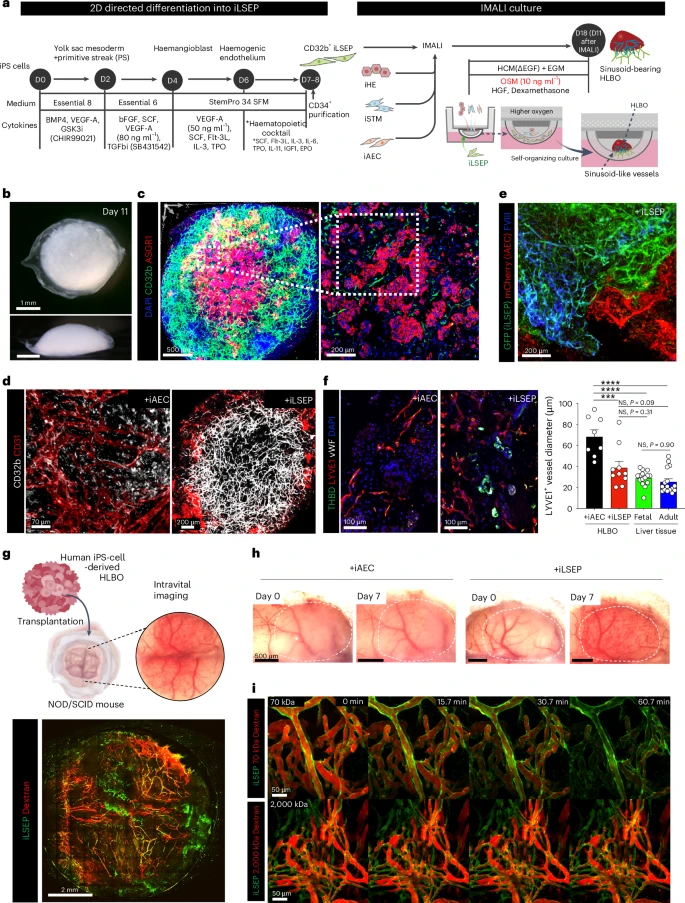
模仿胚胎肝脏形成过程中,原始静脉丛和心脏静脉窦一同参与肝窦血管的构建,研究团队首先在二维微图案分化平台上对iPSC进行原肠胚和早期血管样谱系诱导。通过有限剂量VEGF-A和血液细胞因子组合的巧妙调控,在第6天获得了高表达CD31的血管前体,并在第8天时分离出CD34⁺CD31⁺CD32b⁺细胞,纯度高达88.0%。为了进一步获得功能性LSEC前体,他们借助了单细胞转录组学的发育轨迹重建,发现Oncostatin M(OSM)信号在胎肝中期对LSEC命运至关重要。于是,在第8天的CD34⁺细胞基础上,于第10–14天加入OSM,成功将CD32b⁺LYVE1⁺CXCR4⁻细胞群的比例提升至93.2%。这些iLSEP不仅在分子层面上高表达STAB2、LYVE1、FCGR2B等LSEC特异标志,还在超高分辨率电镜下展示了典型的“微孔(fenestrae)”结构,与原生LSEC高度相似。
IMALI气–液界面:还原胚胎空间组织
在获得高纯度iLSEP后,下一步便是如何让肝实质前体与LSEC自发共组织成真正的类肝芽结构。研究团队创新性地设计了一种反向多层气–液界面培养(IMALI),借助透气膜和多层水凝胶,将四类前体细胞依次分层铺设。其中,最底层为iPSC衍生的肝内胚层(iHE)与隔膜中胚质(iSTM);中间层为动脉样内皮细胞(iAEC);最上层则为iLSEP前体。该布局模拟了胚胎中原始静脉丛、隔膜以及肝管之间的解剖关系:上方空气提供充足氧气,下方液相供应营养物质。仅5天,这些细胞便在三维微环境中自主收缩、贴合,最终形成形如小圆顶的大型类肝芽结构。
三维自组装:3.0×3.0×1.5毫米类肝芽诞生
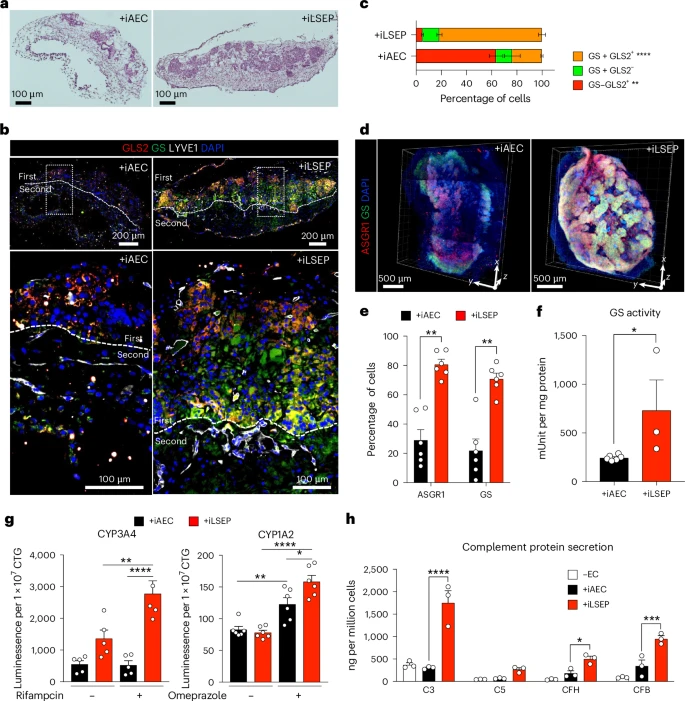
经过11天的IMALI培养,HLBO的直径稳定在3.0乘3.0乘1.5毫米,并呈现出致密的芽状外观。全组织免疫荧光染色显示,iLSEP衍生的CD32b⁺CD31⁺细胞与CD32b⁻CD31⁺细胞在HLBO内部共同分布,并与ASGR1⁺肝细胞紧密相邻。更高倍放大成像证实,这些上皮细胞群与血管网交织形成固有的“肝小叶”类似结构——中心肝细胞区富含谷氨酰胺合成酶(GS)、谷氨酸酶2(GLS2),而周边则更多表达分泌蛋白和胆汁相关因子。流式检测表明,约90.5%的CD34⁺细胞在HLBO中保留CD32b表型,说明LSEC群体在3D环境下得以稳定扩增。
灌流功能:6天内实现体内血流接通
最具革命性的是,在免疫缺陷小鼠颅骨窗口移植实验中,研究者在术后6天即可通过活体显微成像,观察到HLBO中由GFP标记的iLSEP衍生血管与小鼠血管网络连通,真正实现了血流灌注。更通过不同分子量的荧光标记葡聚糖试验,证明2000 kDa的巨分子被血管壁完全拦截,而70 kDa的小分子可自由透过,精准重现了肝窦内皮的典型小孔过滤功能。此外,注入的AcLDL探针亦被人源LSEC特异摄取,表明它们具备强大的清除和内吞能力。
单细胞图谱:多重内皮谱系的分化轨迹
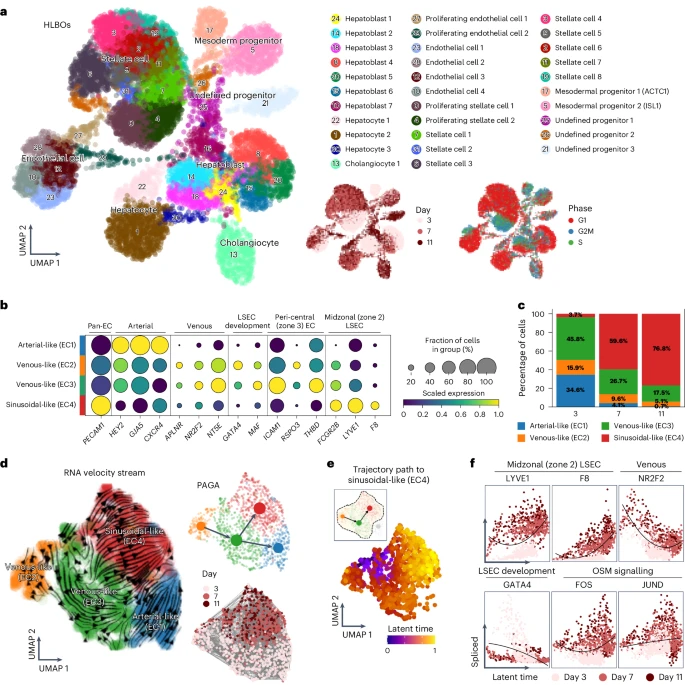
为了深入解析HLBO中内皮多样性,团队对3、7、11天的类器官进行单细胞RNA测序。通过UMAP降维与层次聚类,他们鉴定出包括动脉样、静脉样和窦状样三大内皮亚群。随培养时间推移,CD32b⁺F8⁺LYVE1⁺的窦状样细胞(EC4)的比例显著上升,而THBD⁺vWF⁺的静脉样亚群(EC2、EC3)与CD31⁺CD32b⁻的动脉样亚群(EC1)逐渐减少。RNA velocity和PAGA图揭示了静脉样到窦状样的分化转轨,而关键转录因子GATA4、OSM下游信号则在早期驱动该命运决定,为后续功能化提供了分子依据。
LSEC–肝细胞互馈:WNT2构建“窦状–肝实质”联动
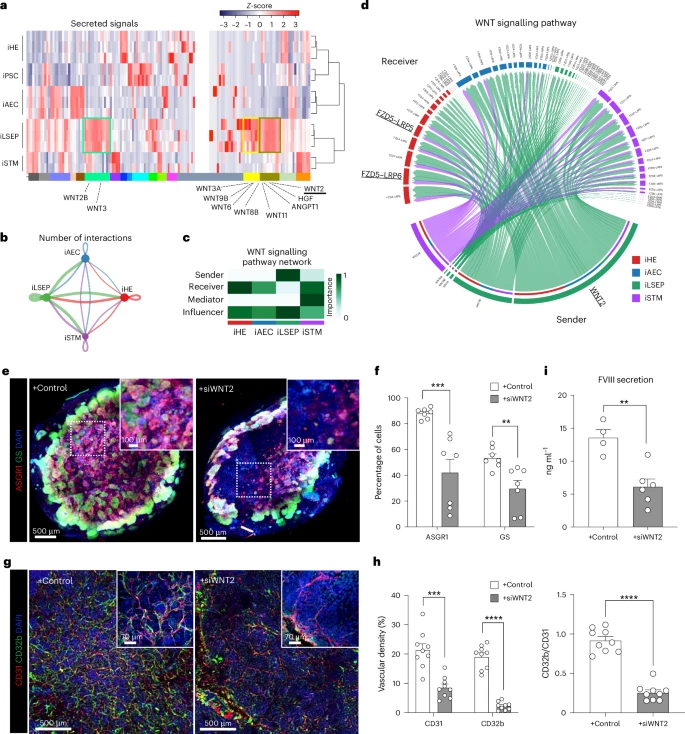
除了自组织成网,iLSEP还通过分泌多种“血管体液”影响肝细胞功能。配体–受体分析显示,iLSEP是HLBO中最活跃的信号分泌中心,尤其富含WNT2。WNT2通过FZD5/LRP5/6与iHE建立精密联结,促进肝实质前体向成熟肝细胞方向分化。利用LNP包载siRNA在IMALI体系中敲低WNT2后,ASGR1⁺肝细胞数目显著减少,GS表达和谷氨酸合成活性下滑,血管网分支密度也随之下降,FVIII分泌减少,印证了WNT2在器官共建和功能互促中的核心地位。
功能输出:多重肝功能与凝血因子齐聚
在HLBO中,除了结构重建,研究还验证了肝细胞的代谢和分泌能力。经典的CYP3A4和CYP1A2药物代谢酶可响应Rifampicin和Omeprazole诱导而显著上调,说明HLBO具备体外药物代谢研究潜力。更为突破的是,HLBO培养上清富含补体C3、C4、C5和凝血因子FV、FVIII、FIX、FXI等,能在含有单因子缺陷的血浆中恢复正常凝血时间。尤其在FVIII缺失模型中,HLBO上清将Aptt从超过120秒缩短至约49秒,展现出可观的补偿效果。
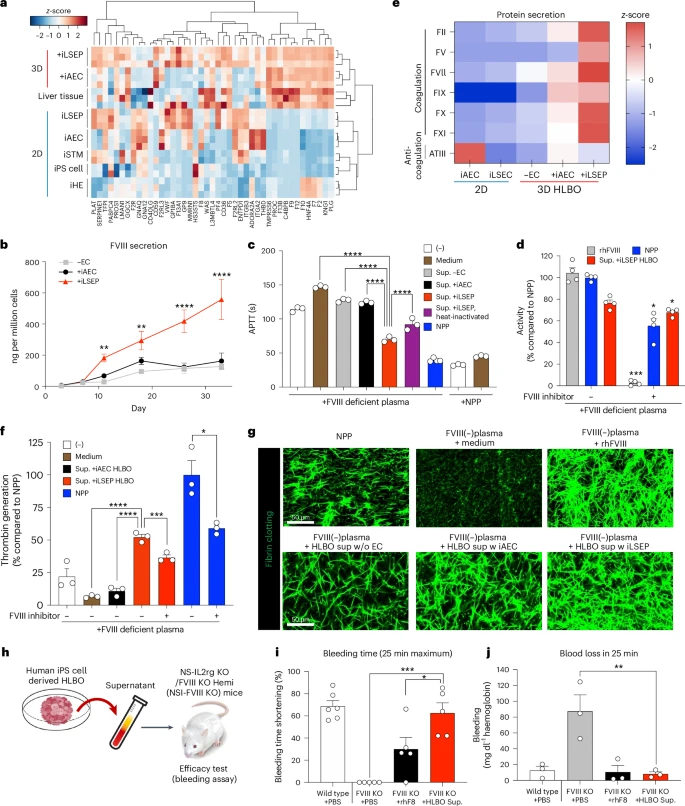
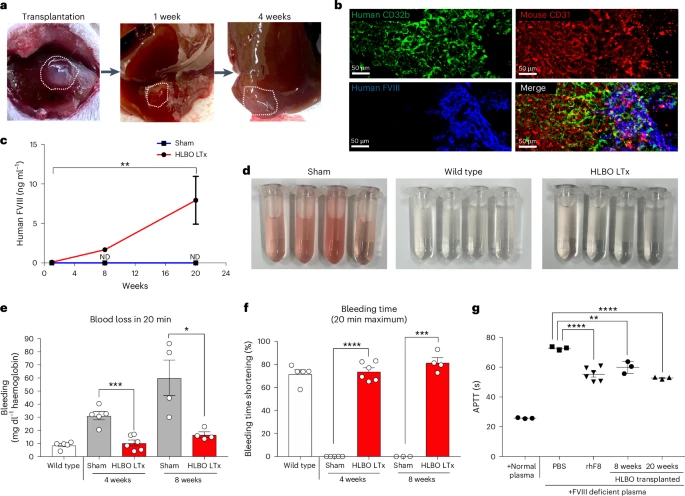
治疗前景:类器官移植矫正血友病
将HLBO移植至严重血友病A小鼠的肾包膜下后,研究者在第14天的止血试验中发现,HLBO组小鼠的尾部止血时间较对照组缩短约60%,失血量降低超过70%。这一体内功能验证首次证明了类器官不仅能维持生理灌注,还能在宿主环境中分泌功能性凝血因子,显著改善遗传性出血表型,揭开了类器官在血液病治疗领域的应用新篇章。
领跑同侪:与主流肝模型的多维对比
团队在整合11个公开人肝类器官数据后,通过谱系相关性对比发现,+iLSEP HLBO在肝窦特异标志、药物代谢、补体与凝血功能四大维度均领先于现有任何类器官模型,尤其在LSEC相关基因表达和功能检测上,Spearman相关系数高达0.96以上,显示出无可比拟的优势。
展望:迈向多器官级联与临床翻译
这一工作不仅为类器官技术提供了“血管化关键钥匙”,也为再生医学开辟了新的应用场景。未来,IMALI平台可扩展至肾、肺、脑等多种器官类器官的血管化培养,甚至可在生物打印、体外动态培养系统中实现更大尺度的器官构建。对于血友病等凝血因子缺陷性疾病,HLBO有望成为补充FVIII的长期来源,甚至发展为“类器官移植疗法”。同时,多模态成像与微流控技术的结合,也将推动类器官进入更精准的疾病模型和药物筛选阶段。
正如作者所言,“当我们能在体外重现器官的血管-实质互作与功能输出,才是真正打开再生医学与器官工程大门的时候”。这一93.2%纯度的LSEC直分化、3毫米肝芽规模化自组织与6天内实现血流灌注的创举,无疑将成为类器官领域下一个里程碑。
参考文献
Saiki, N., Nio, Y., Yoneyama, Y. et al. Self-organization of sinusoidal vessels in pluripotent stem cell-derived human liver bud organoids. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01416-6