【 Nat. Biomed. Eng. 】LUCAS:超灵敏长效的即时病毒检测新方法
在快速诊断领域,科学家们一直在寻找更灵敏、更持久、更便捷的病毒检测方法,尤其是在资源有限的环境下。最近,一项发表在《自然生物医学工程》上的研究介绍了一种名为LUCAS(基于发光级联的传感器)的新型检测技术,它利用酶级联反应,实现了对病毒抗原的超高灵敏度和持久的生物发光信号检测 。该技术不仅显著优于传统的生物发光检测方法,还被整合到便携式全自动设备中,为即时诊断(Point-of-Care Testing, POCT)带来了新的可能 。
一、传统生物发光检测的瓶颈与LUCAS的突破
生物发光技术因其高信噪比和无需外部光源的特性,在诊断学中展现出巨大潜力 。然而,传统方法面临两大挑战:
信号快速衰减:发光信号往往持续时间短,需要快速读取,容易导致结果不准确或不可靠 。
酶活性降低:当发光酶(如荧光素酶)与用于靶向病毒的分子(如抗体)结合时,其催化活性会显著下降,从而降低检测的灵敏度 。
LUCAS系统通过一种创新的酶级联反应机制,成功克服了这些局限 。
二、LUCAS系统的核心机制:巧妙的酶级联反应
LUCAS系统的核心在于其两步酶促反应设计(如图1c所示):
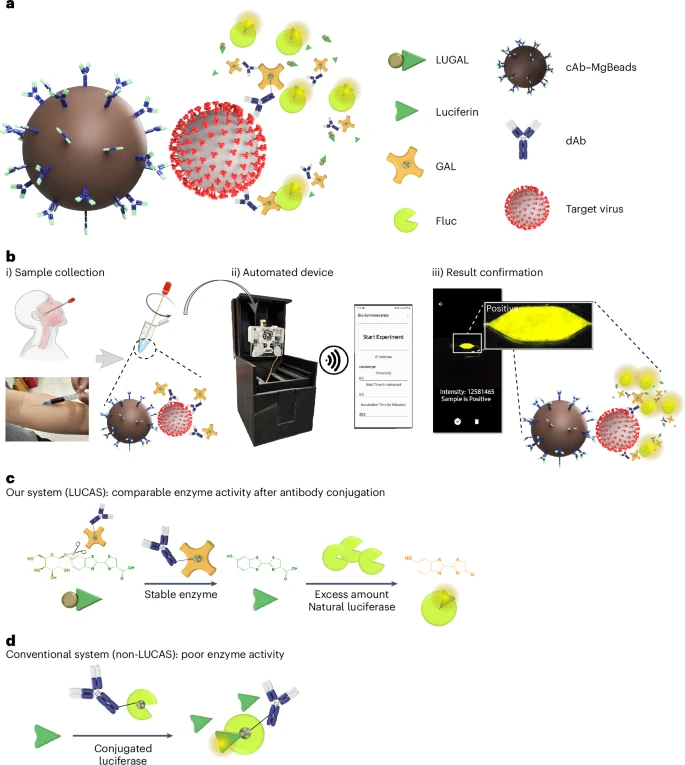
1. 第一步:稳定且高效的“信号前体”生成
研究人员选用了一种名为β-半乳糖苷酶(GAL)的酶。这种酶在与抗体结合后,仍能保持极高的酶活性,稳定性远超直接偶联的荧光素酶(Fluc)。
在检测时,捕获抗体(cAb)先固定在磁珠(MgBeads)上,用于捕捉样本中的目标病毒。然后,连接了GAL酶的检测抗体(dAb-GAL)会结合到病毒上 。
接着,加入一种名为LUGAL的底物(D-luciferin-6-O-β-D-galactopyranoside,一种“笼锁”的荧光素)。GAL酶会高效地将LUGAL水解,释放出大量的荧光素中间体(即“信号前体”)。
2. 第二步:强效且持久的“信号放大”与发光
随后,体系中加入过量且未标记(天然形态)的萤火虫荧光素酶(Fluc)。
这些游离的Fluc酶会迅速催化第一步产生的大量荧光素中间体发生氧化反应,产生强烈的生物发光信号 。
由于GAL酶的稳定性和持续产生荧光素中间体的能力,以及过量天然Fluc的参与,整个发光过程不仅信号强度大幅提升,持续时间也显著延长 。
与传统的非LUCAS系统(如图1d所示,Fluc直接偶联到抗体上)相比,LUCAS系统表现出巨大优势 。
三、LUCAS系统的显著优势:更高灵敏度与更长信号持久性
研究团队通过一系列实验对比了LUCAS系统与传统非LUCAS系统的性能(如图2所示):
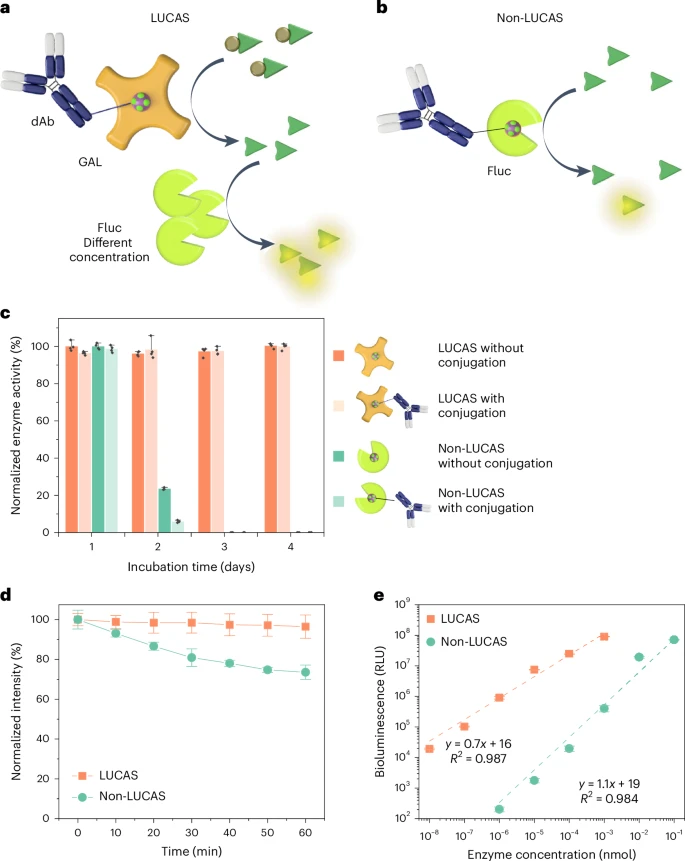
1. 酶活性保持:
LUCAS系统中,与抗体结合的GAL酶在4天后仍保持了超过98%的活性 。
而在非LUCAS系统中,与抗体结合的Fluc酶在第2天就损失了77%的活性,第3天则完全失活 。这直接证明了LUCAS系统设计的优越性 。
2. 信号持久性:
LUCAS系统产生的生物发光信号在1小时后仍能保持初始强度的96%以上 。
相比之下,非LUCAS系统的信号在同一时间段内衰减至74% 。
通过比较信号衰减曲线的斜率,LUCAS系统的信号衰减速率比非LUCAS系统慢约8倍,这意味着信号更持久稳定 。
3. 检测灵敏度:
为了产生可检测的生物发光信号,LUCAS系统仅需6.2 amol(阿摩尔,10⁻¹⁸摩尔)的GAL酶。
而非LUCAS系统则需要3.2 fmol(飞摩尔,10⁻¹⁵摩尔)的Fluc酶 。
这意味着LUCAS系统所需的酶量比非LUCAS系统低了约515倍,即其信号产生能力强了515倍以上,灵敏度得到了巨大提升 。这主要归功于GAL酶的稳定性和体系中过量天然Fluc酶的有效催化 。
四、从手动操作到全自动即时检测平台的构建
为了实现LUCAS技术的即时检测应用,研究团队进一步将其整合到一个便携式全自动设备中。
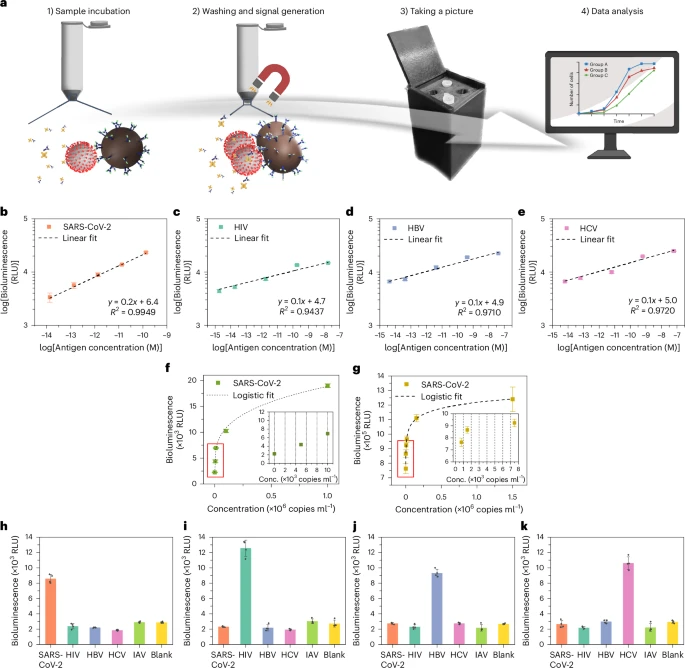
1. 手动LUCAS系统评估:
首先,团队使用手动LUCAS流程对多种病毒抗原(SARS-CoV-2、HIV、HBV、HCV)进行了检测性能评估(如图3所示)。
利用CMOS传感器(一种常见的图像传感器)作为检测器,手动LUCAS系统对灭活SARS-CoV-2病毒的检测限(LOD)可达518拷贝数/毫升;若使用更精密的辉度计,LOD更可低至119拷贝数/毫升 。这优于许多已获紧急使用授权的抗原检测试剂盒 。
特异性测试也显示,该系统能准确识别目标病毒,而不与非目标病毒发生交叉反应 。
2. 全自动LUCAS系统开发(如图4所示):
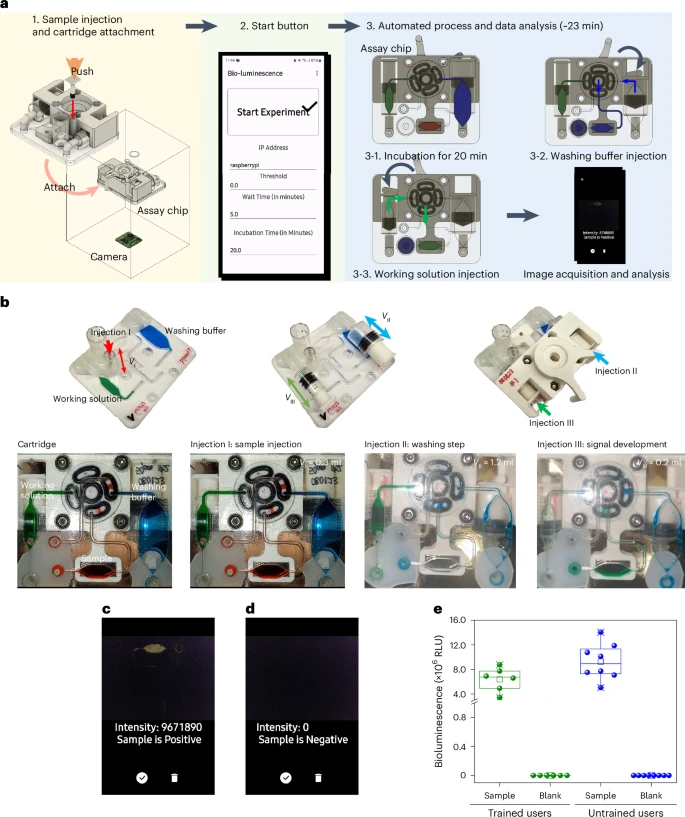
该系统包含一个预装试剂的微流控芯片和一个便携、低成本的读取模块 。
用户只需通过智能手机App按下一个按钮,从样本洗涤、信号产生、数据捕获到结果报告等所有步骤均可自动完成 。
整个样本到结果的分析时间(sample-to-answer)非常迅速,包括病毒捕获的孵育时间在内,大约只需23分钟 。
微流控芯片为一次性使用,其材料成本约为2.3美元;检测模块可重复使用,成本约为86.8美元,具有良好的经济性 。
易用性测试表明,即使是未经培训的用户,使用该自动化系统也能获得与专业人员一致的可靠结果,突显了其用户友好性 。
五、临床样本验证与性能对比
研究团队使用大量临床样本对全自动LUCAS系统进行了验证(如图5所示):
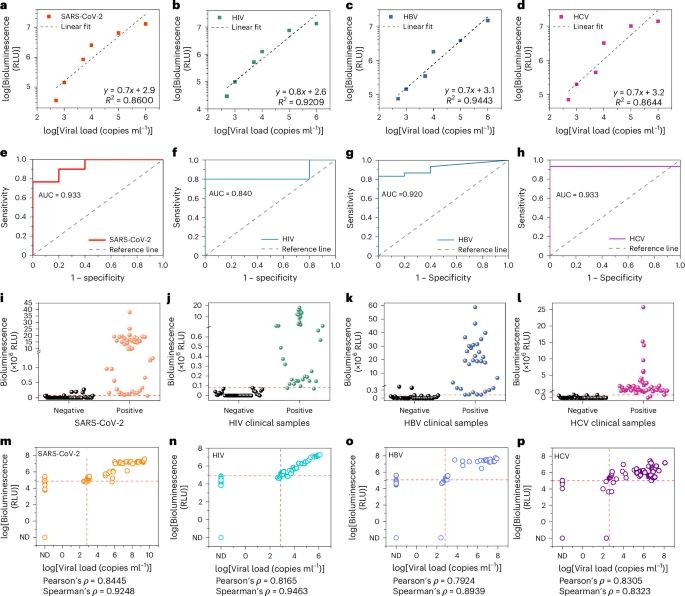
1. 临床LOD确定:
通过对连续稀释的SARS-CoV-2、HIV、HBV和HCV样本进行检测,确定了各自的临床检测限。例如,SARS-CoV-2的LOD为655拷贝数/毫升,HIV为753拷贝数/毫升,HBV为641拷贝数/毫升,HCV为396拷贝数/毫升 。
2. 临床样本检测性能:
研究共测试了307份生物样本(包括177份病毒感染患者样本和130份病毒加标血清样本)。
对于SARS-CoV-2(以655拷贝数/毫升为阈值),定性分类的准确性和灵敏度分别为91%和97% 。
对于HIV(以WHO推荐的1000拷贝数/毫升为阈值),准确性和灵敏度分别为96%和92% 。
对于HBV和HCV,也表现出优秀的准确度和灵敏度 。
结果显示,LUCAS系统能够根据临床相关的病毒载量阈值准确区分感染样本与无病毒样本 。
3. 与其他诊断方法的比较(以HIV p24抗原检测为例,如图6所示):
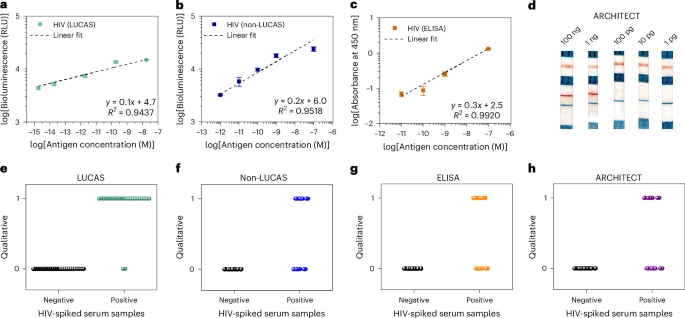
研究团队将LUCAS系统与非LUCAS系统、传统的ELISA方法以及市售的HIV p24 ARCHITECT检测系统进行了头对头比较 。
在检测重组p24抗原的LOD方面,LUCAS(3.9 fM)优于非LUCAS(4.7 pM)和ARCHITECT(18.2 pM),但略逊于ELISA(1.8 pM)。
然而,在临床样本分类方面(使用1000拷贝数/毫升的临床相关阈值),LUCAS的临床灵敏度(92%)和准确性(96%)均显著优于非LUCAS(灵敏度52%,准确性76%)、ELISA(灵敏度64%,准确性82%)和ARCHITECT(灵敏度48%,准确性74%)。这表明LUCAS在检测低病毒载量样本方面具有更强的临床实用性。
六、结论与展望
LUCAS技术通过其创新的酶级联反应,成功解决了传统生物发光检测中信号弱、衰减快和酶活性易损失的核心问题,实现了超过500倍的信号增强和8倍的信号持久性提升 。该技术不仅能高效检测SARS-CoV-2、HIV、HBV、HCV等多种病原体,其全自动、便携、快速(<23分钟)、低成本和用户友好的特点,使其特别适用于资源匮乏地区的即时病毒检测 。临床验证结果也证实了其高灵敏度和高准确性 。
尽管目前研究主要集中在血清和鼻咽拭子样本,未来还需进一步探索其在尿液、唾液等其他复杂生物基质中的检测能力 。但鉴于其卓越的性能,LUCAS技术为开发各类需要极高信号灵敏度和可靠性的生物传感应用提供了广阔的前景 。
参考文献
Kim, S., Cho, G., Lee, J. et al. Ultrasensitive and long-lasting bioluminescence immunoassay for point-of-care viral antigen detection. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01405-9