【Nat. Nanotechnol.】突破癌症治疗的瓶颈:自噬体癌症疫苗的创新与未来
引言
癌症,作为一种全球性的健康威胁,一直是医学研究的焦点。传统治疗方法如手术、放疗和化疗虽然在一定程度上能够控制癌症的发展,但往往伴随着严重的副作用和复发风险。近年来,随着免疫治疗的兴起,癌症疫苗作为一种新兴的治疗策略,逐渐走进了大众的视野。近日,一篇以“Autophagosomes coated in situ with nanodots act as personalized cancer vaccines”为题的研究型文章发表在《Nature Nanotechnology》上,研究人员开发了一种功能性Ti2NX纳米点,可以在体内直接形成个性化的自噬体癌症疫苗。这些纳米点能够捕获自噬体并阻止其与溶酶体融合,从而在肿瘤中形成稳定的纳米点包被自噬体(NCAPs)。这些NCAPs可以逃离癌细胞并在淋巴结中激活肿瘤特异性T细胞,从而减少肿瘤负担并提供长期的免疫监视保护。本文借此从癌症的起源、传统治疗方法的局限性,以及自噬体癌症疫苗的创新成果和意义等方面,深入探讨癌症治疗的最新进展。

一、癌症的起源:从细胞失控到肿瘤形成
(一)癌症的定义
癌症,也称为恶性肿瘤,是一种由体内细胞异常增殖和分化形成的疾病。正常细胞在基因调控下有序生长、分裂和死亡,而癌细胞由于基因突变或异常激活,脱离了这种调控机制,开始无限制地增殖,并可能通过血液或淋巴系统扩散到身体其他部位,形成转移瘤。
(二)癌症的起源机制
癌症的起源是一个复杂的过程,涉及多种因素的相互作用,包括遗传因素、环境因素和生活方式等。以下是一些主要的癌症起源机制:
- 基因突变
癌症的发生往往与基因突变有关。这些突变可能来自遗传因素,也可能由外界因素如化学物质(如烟草中的致癌物)、辐射或病毒感染引起。例如,家族性乳腺癌与BRCA1和BRCA2基因突变密切相关。 - 慢性炎症
长期的慢性炎症可能导致细胞的反复损伤和修复,增加基因突变的风险。例如,慢性肝炎与肝癌的发生密切相关。 - 生活方式和环境因素
不健康的生活方式如吸烟、饮酒、缺乏运动和高脂肪饮食等,以及长期暴露于致癌环境中(如石棉、苯等),也是癌症的重要诱因。 - 病毒感染
某些病毒能够直接或间接导致癌症的发生。例如,人乳头瘤病毒(HPV)与宫颈癌的发生密切相关。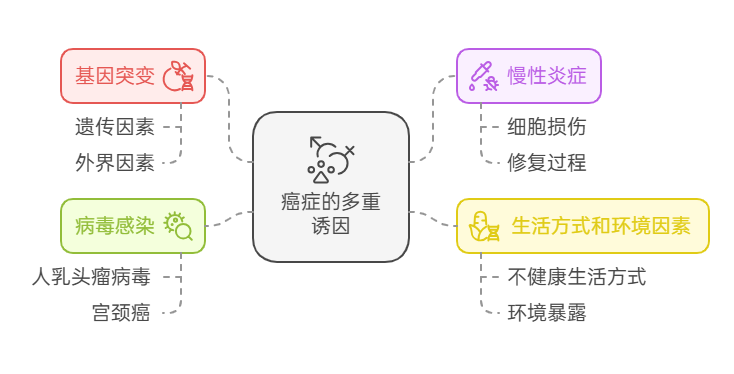
(三)癌症的早期发展
癌症的早期阶段通常被称为癌前病变,这是正常细胞向癌细胞转变的过渡阶段。癌前病变的细胞虽然尚未完全失去正常细胞的特征,但已经表现出异常增殖的倾向。如果在这个阶段能够及时发现并干预,可以有效阻止癌症的进一步发展。
二、癌症的传统治疗方法及其局限性
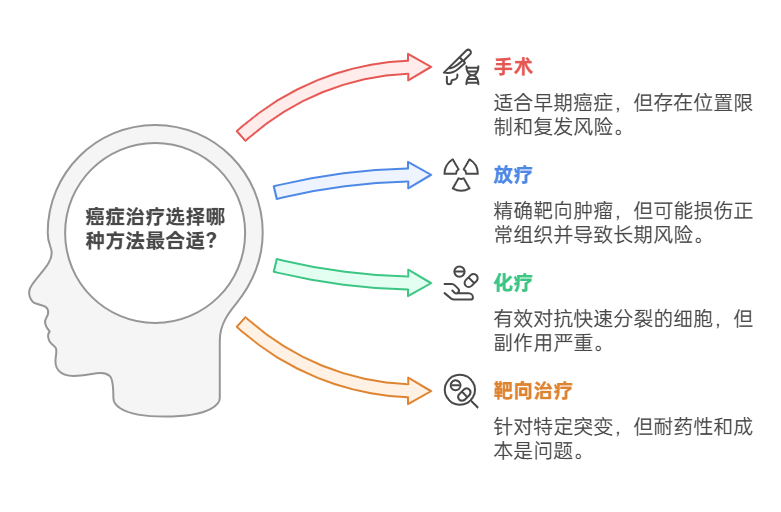
(一)手术治疗
手术是癌症治疗中最常用的方法之一,尤其是对于早期癌症患者。手术的目的是尽可能地切除肿瘤组织,减少癌细胞的数量。然而,手术治疗也存在一些局限性:
- 肿瘤位置和大小限制
对于一些位于关键器官或与重要血管、神经密切相关的肿瘤,手术切除可能会带来严重的并发症。 - 微小转移灶的遗漏
即使手术成功切除了主要肿瘤,但癌细胞可能已经通过血液或淋巴系统扩散到身体其他部位,形成微小转移灶,这些转移灶难以通过手术清除。 - 术后复发风险
手术后,癌细胞可能在原发部位或身体其他部位重新生长,导致癌症复发。
(二)放疗
放疗是利用放射性物质或射线杀死癌细胞的一种治疗方法。它可以通过外部照射或内部植入放射源来实现。放疗的优点是可以精准地作用于肿瘤部位,但同时也存在一些问题:
- 对正常组织的损伤
放疗在杀死癌细胞的同时,也会对周围的正常组织造成损伤,导致一系列副作用,如皮肤溃疡、黏膜炎、疲劳等。 - 耐受性问题
部分患者可能对放疗不耐受,导致治疗中断。 - 长期风险
长期接受放疗可能会增加第二原发癌的风险。
(三)化疗
化疗是通过使用化学药物来杀死快速分裂的癌细胞。然而,化疗药物在杀死癌细胞的同时,也会对正常细胞造成损害,尤其是那些快速分裂的细胞,如骨髓细胞、胃肠道黏膜细胞和毛囊细胞。因此,化疗的副作用通常较为严重,包括:
- 骨髓抑制
化疗药物会抑制骨髓的造血功能,导致白细胞、红细胞和血小板减少,增加感染、贫血和出血的风险。 - 胃肠道反应
患者可能会出现恶心、呕吐、腹泻或便秘等胃肠道不适。 - 脱发和皮肤毒性
化疗药物会损害毛囊和皮肤细胞,导致脱发和皮肤干燥、瘙痒等问题。
(四)靶向治疗
靶向治疗是近年来发展起来的一种新型治疗方法,通过针对癌细胞的特定基因突变或蛋白质靶点,精准地抑制癌细胞的生长和增殖。然而,靶向治疗也面临一些挑战:
- 耐药性问题
癌细胞在长期的药物压力下,可能会通过基因突变或激活其他信号通路来逃避药物的作用,导致耐药性。 - 靶点选择的局限性
并非所有癌症患者都存在适合靶向治疗的基因突变,因此靶向治疗的适用范围相对有限。 - 高成本
靶向药物的研发成本高,价格昂贵,给患者和医疗系统带来了沉重的经济负担。
(五)免疫治疗
免疫治疗是通过激活或增强人体自身的免疫系统来攻击癌细胞的一种治疗方法。近年来,免疫检查点抑制剂(如PD-1/PD-L1抑制剂)取得了显著的临床效果。然而,免疫治疗也存在一些问题:
- 免疫相关不良事件
免疫治疗可能会导致免疫系统过度激活,攻击正常组织,引发免疫相关不良事件,如肺炎、肝炎、甲状腺功能异常等。 - 响应率有限
并非所有患者都能从免疫治疗中获益,部分患者可能对免疫治疗无反应。 - 长期疗效的不确定性
免疫治疗的长期疗效和安全性仍需进一步研究。
三、自噬体癌症疫苗:免疫治疗的新突破
(一)癌症疫苗的原理
癌症疫苗是一种基于免疫治疗的策略,旨在通过激活人体自身的免疫系统来识别和攻击癌细胞。与传统疫苗不同,癌症疫苗的主要目标是已经存在的癌细胞,而不是预防疾病的发生。癌症疫苗的原理是通过引入肿瘤抗原,刺激免疫系统产生特异性免疫反应,从而清除癌细胞。
(二)自噬体癌症疫苗的创新
自噬体是一种细胞内的小囊泡,负责清除细胞内的废弃物和损伤的细胞器。在肿瘤细胞中,自噬体可以捕获肿瘤抗原,并通过交叉呈递的方式将抗原展示给免疫系统。然而,自噬体在形成后会迅速与溶酶体融合,导致抗原降解,难以形成有效的免疫反应。 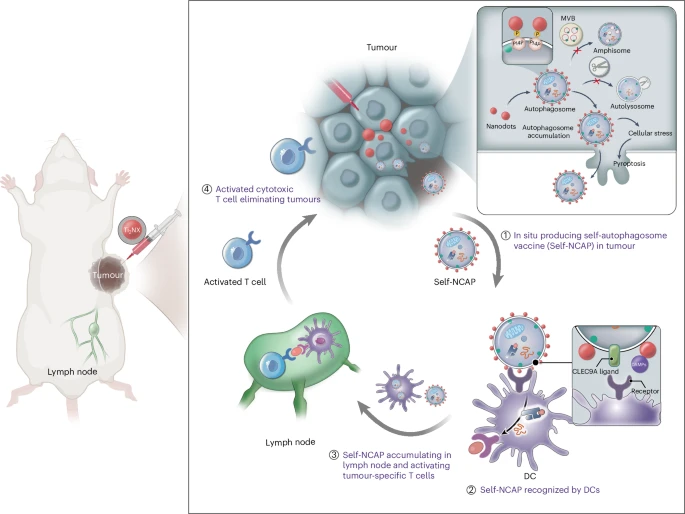 为了解决这一问题,研究人员设计了一种功能性Ti₂NX纳米点,能够选择性地捕获自噬体,并通过结合自噬体膜上的磷脂酰肌醇-4-磷酸(PI4P),阻止自噬体与溶酶体的融合,从而在肿瘤组织中形成稳定的纳米点涂层自噬体(NCAP)。这一创新为癌症疫苗的研发带来了新的希望。
为了解决这一问题,研究人员设计了一种功能性Ti₂NX纳米点,能够选择性地捕获自噬体,并通过结合自噬体膜上的磷脂酰肌醇-4-磷酸(PI4P),阻止自噬体与溶酶体的融合,从而在肿瘤组织中形成稳定的纳米点涂层自噬体(NCAP)。这一创新为癌症疫苗的研发带来了新的希望。
(三)纳米点涂层自噬体的机制
- 阻止自噬体与溶酶体融合
纳米点涂层自噬体通过结合PI4P,阻止自噬体与溶酶体的融合,从而保护肿瘤抗原不被降解。 - 逃逸机制
纳米点涂层自噬体能够从癌细胞中逃逸出来,进入淋巴结,激活肿瘤特异性T细胞,触发强大的免疫反应。 - 个性化疫苗的形成
该方法能够在体内直接形成个性化自噬体癌症疫苗,根据患者的肿瘤特征定制疫苗,具有很高的应用前景。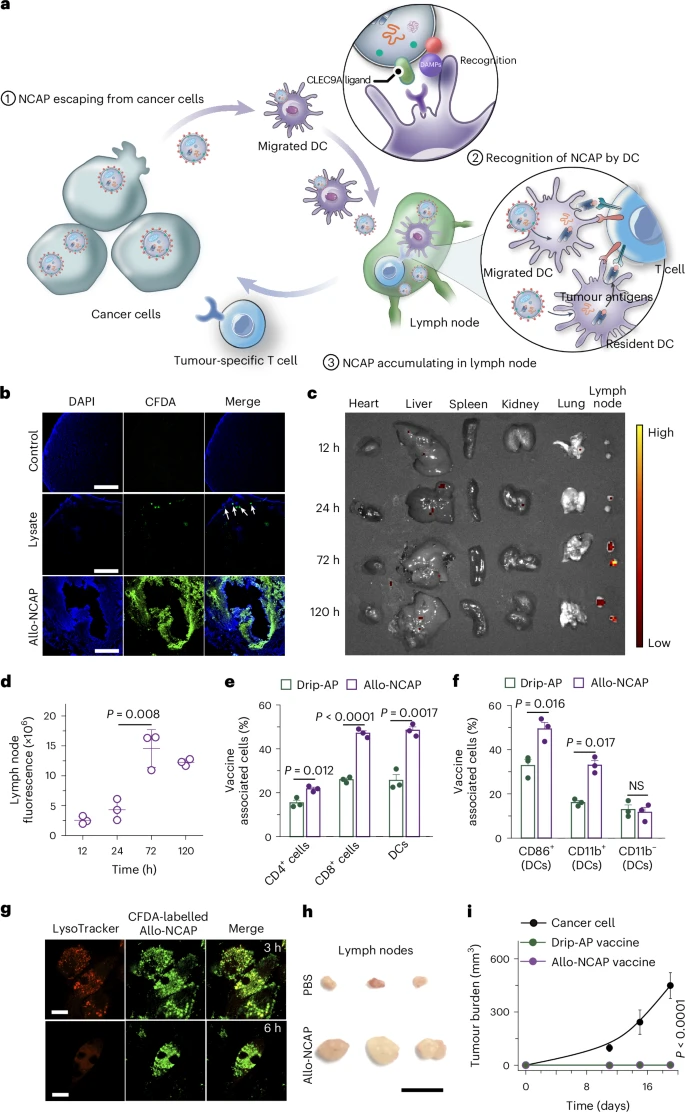
(四)主要成果与优势
- 提高免疫原性
纳米点涂层自噬体能够有效阻止自噬体与溶酶体的融合,形成稳定的自噬体,显著提高了免疫原性。 - 激活免疫反应
纳米点涂层自噬体能够逃逸出癌细胞,进入淋巴结,激活肿瘤特异性T细胞,显著减少肿瘤负担,并为治愈的小鼠提供长期的免疫监视保护。 - 个性化治疗
该方法能够在体内直接形成个性化自噬体癌症疫苗,为癌症治疗提供了一种全新的策略。
四、自噬体癌症疫苗的临床应用前景
(一)个性化治疗的潜力
自噬体癌症疫苗的个性化特点使其能够根据患者的肿瘤特征定制疫苗,从而提高治疗效果。这种个性化治疗策略有望克服传统治疗方法的局限性,为癌症患者带来新的希望。
(二)联合治疗的潜力
自噬体癌症疫苗不仅可以单独使用,还可以与其他治疗方法(如手术、放疗、化疗或免疫治疗)联合使用,形成综合治疗方案。例如,在手术切除肿瘤后,使用自噬体癌症疫苗可以清除残留的癌细胞,减少复发风险。
(三)长期免疫监视
自噬体癌症疫苗能够激活肿瘤特异性T细胞,并为治愈的小鼠提供长期的免疫监视保护。这意味着患者在治愈后,免疫系统可以持续监测体内可能出现的癌细胞,防止癌症复发。
(四)未来研究方向
尽管自噬体癌症疫苗已经取得了显著的成果,但仍有许多问题需要进一步研究。例如,如何优化纳米点涂层自噬体的制备工艺,提高其稳定性和安全性;如何扩大临床试验规模,验证其在不同类型癌症中的疗效;以及如何降低研发和生产成本,使其能够广泛应用于临床。
五、结论
癌症作为一种复杂的疾病,其治疗需要综合多种方法。传统治疗方法如手术、放疗和化疗虽然在一定程度上能够控制癌症的发展,但往往伴随着严重的副作用和复发风险。近年来,随着免疫治疗的兴起,癌症疫苗作为一种新兴的治疗策略,逐渐走进了大众的视野。自噬体癌症疫苗的出现,为癌症治疗带来了新的希望。通过阻止自噬体与溶酶体的融合,纳米点涂层自噬体能够显著提高免疫原性,激活肿瘤特异性T细胞,并为患者提供长期的免疫监视保护。未来,随着研究的深入和技术的成熟,自噬体癌症疫苗有望成为癌症治疗的重要手段之一,为患者带来更多的选择和希望。
参考文献
- Qu, L., Cui, G., Sun, Y., et al. A biomimetic autophagosomes-based nanovaccine boosts anticancer immunity. Advanced Materials, 2024. DOI: 10.1002/adma.202409590.
- Zhang, J., Cao, J., Wang, L., et al. Neoantigen-encapsulated autophagosomes as therapeutic cancer vaccines. Journal of Controlled Release, 2024. DOI: 10.1016/j.jconrel.2024.10.019.
- Berenblum, I., & Shubik, P. A new, quantitative, approach to the study of the stages of chemical carcinogenesis in the mouse's skin. British Journal of Cancer, 1947, 1(4), 383-391. DOI: 10.1038/bjc.1947.36.
- Kakiuchi, N., & Ogawa, S. Clonal expansion in non-cancer tissues. Nature Reviews Cancer, 2021, 21(4), 239-256. DOI: 10.1038/s41568-021-00335-3.
- Li, R. Y., Di, L., Li, J., et al. A body map of somatic mutagenesis in morphologically normal human tissues. Nature, 2021, 597(7876), 398-403. DOI: 10.1038/s41586-021-03836-1.
- Colom, B., Herms, A., Hall, M. W. J., et al. Mutant clones in normal epithelium outcompete and eliminate emerging tumours. Nature, 2021, 598(7881), 510-514. DOI: 10.1038/s41586-021-03965-7.
- Chang, J., Zhao, X., Wang, Y. C., et al. Genomic alterations driving precancerous to cancerous lesions in esophageal cancer development. Cancer Cell, 2023, 41(12), 2038-2050. e5. DOI: 10.1016/j.ccell.2023.11.003.
- Takeshima, H., & Ushijima, T. Accumulation of genetic and epigenetic alterations in normal cells and cancer risk. NPJ Precision Oncology, 2019, 3, 7. DOI: 10.1038/s41698-019-0079-0.
- Choi, C. R., Bakir, I. A., Hart, A. L., et al. Clonal evolution of colorectal cancer in IBD. Nature Reviews Gastroenterology & Hepatology, 2017, 14(4), 218-229.
- Luo, Y. X., Wong, C. J., Kaz, A. M., et al. Differences in DNA methylation signatures reveal multiple pathways of progression from adenoma to colorectal cancer. Gastroenterology, 2014, 147(2), 418-429. e8. DOI: 10.1053/j.gastro.2014.04.039.
- Rodríguez-Paredes, M., Bormann, F., Raddatz, G., et al. Methylation profiling identifies two subclasses of squamous cell carcinoma related to distinct cells of origin. Nature Communications, 2018, 9(1), 577. DOI: 10.1038/s41467-018-03025-1.
- Hu, X., Estecio, M. R., Chen, R. Z., et al. Evolution of DNA methylome from precancerous lesions to invasive lung adenocarcinomas. Nature Communications, 2021, 12(1), 687. DOI: 10.1038/s41467-021-20907-z.
- Feinberg, A. P., & Tycko, B. The history of cancer epigenetics. Nature Reviews Cancer, 2004, 4(2), 143-153. DOI: 10.1038/nrc1279.
- Booth, L. N., & Brunet, A. The aging epigenome. Molecular Cell, 2016, 62(5), 728-744. DOI: 10.1016/j.molcel.2016.05.013.
- Yang, L. B., Rodriguez, B., Mayle, A., et al. DNMT3A loss drives enhancer hypomethylation in FLT3-ITD-associated leukemias. Cancer Cell, 2016, 30(2), 363-365.
- Liu, J. D., Gao, M. W., He, J. P., et al. The RNA m6A reader YTHDC1 silences retrotransposons and guards ES cell identity. Nature, 2021, 591(7849), 322-326. DOI: 10.1038/s41586-021-03313-9.
- Tanimura, N., & Fujita, Y. Epithelial defense against cancer (EDAC). Seminars in Cancer Biology, 2020, 63, 44-48. DOI: 10.1016/j.semcancer.2019.05.011.
- Flanagan, D. J., Pentinmiko, N., Luopajärvi, K., et al. NOTUM from Apc-mutant cells biases clonal competition to initiate cancer. Nature, 2021, 594(7863), 430-435. DOI: 10.1038/s41586-021-03525-z.
- Van Neerven, S. M., De Groot, N. E., Nijman, L. E., et al. Apc-mutant cells act as supercompetitors in intestinal tumor initiation. Nature, 2021, 594(7863), 436-441. DOI: 10.1038/s41586-021-03558-4.
- Yum, M. K., Han, S., Fink, J., et al. Tracing oncogene-driven remodeling of the intestinal stem cell niche. Nature, 2021, 594(7863), 442-447. DOI: 10.1038/s41586-021-03605-0.
- Avagyan, S., Henninger, J. E., Mannherz, W. P., et al. Resistance to inflammation underlies enhanced fitness in clonal hematopoiesis. Science, 2021, 374(6568), 768-772. DOI: 10.1126/science.aba9304.
- Shi, X. L., Wang, X. Y., Yao, W. T., et al. Mechanism insights and therapeutic intervention of tumor metastasis: latest developments and perspectives. Signal Transduction and Targeted Therapy, 2024, 9(1), 192.