【Nat.Nanotechnol.】口服基因编辑纳米颗粒:重塑结直肠癌治疗格局的新策略
1. 研究背景与亟待解决的临床挑战
结直肠癌(Colorectal Cancer, CRC)是全球范围内对人类健康构成严重威胁的恶性肿瘤。尽管手术切除、传统的化疗以及近年来飞速发展的免疫疗法已经显著改善了许多患者的预后,但临床上仍面临两大主要障碍,极大地限制了这些治疗手段的疗效:
1.1 普遍存在的化疗耐药性
许多结直肠癌患者在接受化疗药物治疗一段时间后,癌细胞会逐渐产生抵抗,导致药物失去作用,肿瘤继续生长。这种化疗耐药性是治疗失败和疾病复发的主要原因之一。深入了解并克服癌细胞产生耐药的机制,对于提高化疗效果至关重要。
1.2 肿瘤微环境的免疫抑制特性
肿瘤并非孤立存在,它周围围绕着一个复杂的微环境(Tumour Microenvironment, TME),包含各种细胞(如免疫细胞、成纤维细胞)、分子(如细胞因子、生长因子)以及血管网络。在许多实体瘤中,特别是结直肠癌,肿瘤微环境常常呈现出免疫抑制的特性,这意味着尽管体内存在能够识别并攻击癌细胞的免疫细胞,但它们的功能受到了抑制,无法有效地清除肿瘤。这种“冷”的肿瘤微环境是免疫疗法效果不佳的重要原因。
文章指出,线粒体,作为细胞内重要的能量产生器,其功能状态与肿瘤的耐药和免疫抑制密切相关。线粒体内的蛋白质,特别是一些被称为线粒体伴侣蛋白(Mitochondrial Chaperone Proteins)的分子,在维持线粒体正常功能中发挥关键作用,它们异常表达或功能失调可能导致肿瘤对治疗产生抵抗。
2. 核心科学发现:TRAP1 在肿瘤耐药与免疫抑制中的作用
这项研究的一个重要突破在于揭示了线粒体伴侣蛋白TRAP1在结直肠癌化疗耐药和免疫抑制中的关键角色。
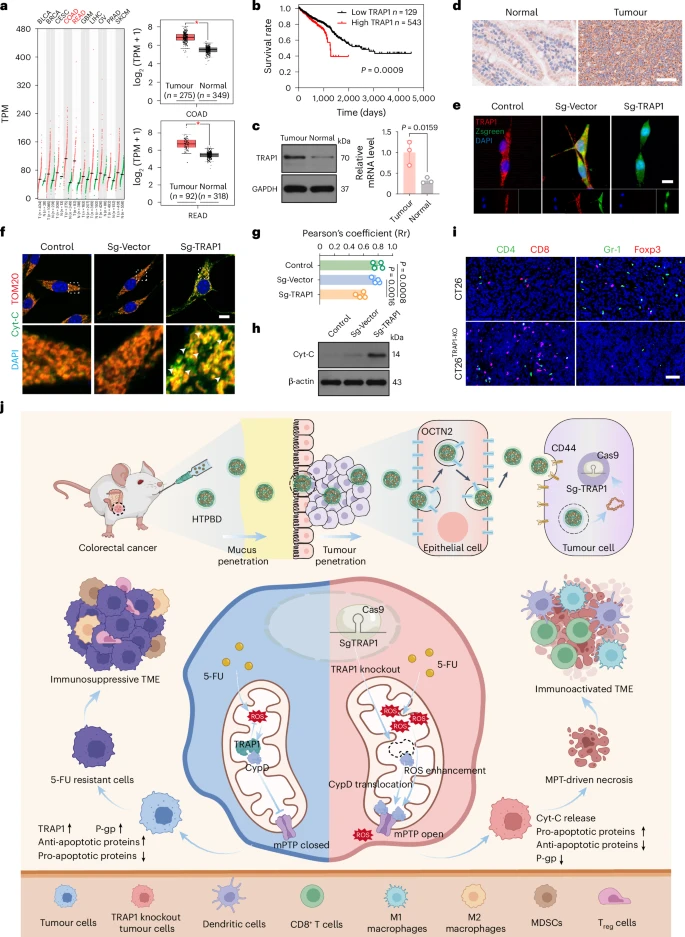
2.1 TRAP1 在结直肠癌中的高表达与不良预后
研究人员通过分析大量的临床数据发现,TRAP1在结直肠癌组织中的表达水平显著高于正常组织。更重要的是,TRAP1的高表达与结直肠癌患者较差的生存预后密切相关,这表明TRAP1可能是一个潜在的治疗靶点。
2.2 TRAP1 对线粒体通透性转换孔(mPTP)开放的抑制
进一步的机制研究发现,TRAP1在线粒体内与另一个重要的蛋白质CypD(亲环素 D)相互作用。CypD是调控线粒体通透性转换孔(mPTP)开放的关键分子。mPTP是线粒体内膜上的一个通道,其开放状态受多种因素调节。mPTP的持续开放会导致线粒体膜电位的丧失、线粒体肿胀以及线粒体内一些分子的释放,这些事件是诱导细胞死亡的重要步骤。
在化疗过程中,化疗药物往往会诱导细胞产生大量的活性氧(ROS),这些氧化应激信号可以刺激CypD,促使mPTP开放,从而杀死癌细胞。然而,研究发现高表达的TRAP1就像一个“刹车”,通过与CypD结合,阻止了CypD诱导的mPTP开放。这种抑制作用使得癌细胞能够在面对化疗引起的氧化应激时“幸存”下来,从而导致化疗耐药。
2.3 TRAP1 敲低解除 mPTP 抑制,增强细胞死亡与免疫原性
这项研究的核心发现之一是,通过基因编辑手段降低或消除(敲低/敲除)结直肠癌细胞中的TRAP1表达,可以解除TRAP1对CypD的束缚。没有了TRAP1的抑制,CypD能够自由地发挥作用,促使mPTP持续开放。持续开放的mPTP显著增强了化疗药物(如5-FU)诱导的肿瘤细胞死亡。
更重要的是,这种TRAP1敲低引起的细胞死亡,特别是如果诱导了细胞坏死(Necrosis),而非凋亡(Apoptosis,一种程序性细胞死亡),则具有更强的免疫原性。免疫原性细胞死亡(ICD)是指一类能够激活抗肿瘤免疫应答的细胞死亡方式。死亡的癌细胞会释放出多种“危险信号”分子,如损伤相关分子模式(DAMPs)和肿瘤相关抗原。这些分子能够被树突状细胞等抗原提呈细胞捕获和识别,进而激活T细胞等效应免疫细胞,引导它们迁移到肿瘤部位并攻击癌细胞。因此,敲低TRAP1不仅直接增加了癌细胞对化疗的敏感性,还通过促进具有免疫原性的细胞死亡,将免疫抑制性的肿瘤微环境转化为有利于免疫系统清除肿瘤的微环境。
3. 创新口服递送系统:HTPBD 的设计与优势
尽管TRAP1作为靶点具有巨大潜力,但如何安全有效地将基因编辑工具(如CRISPR-Cas9系统)递送到结直肠癌细胞中是一个巨大的挑战。特别是对于结直肠癌,口服给药是最理想的方式,但胃肠道复杂的环境对药物和基因递送系统提出了极高的要求。
3.1 口服递送的障碍
口服药物在到达肿瘤部位之前需要克服多重屏障:
- 胃酸和消化酶: 胃肠道中的强酸环境和各种消化酶会迅速降解蛋白质和核酸。
- 肠道黏液层: 肠道表面覆盖着一层厚厚的黏液,由带负电荷的粘蛋白组成,会黏附并阻碍许多药物和纳米颗粒的穿透。
- 肠道上皮细胞屏障: 紧密连接的肠道上皮细胞构成了物理屏障,限制了大多数大分子物质的吸收。
3.2 HTPBD 纳米颗粒的设计理念
为了克服这些口服递送的挑战,研究团队精心设计了一种新型的纳米颗粒,命名为HTPBD。该系统巧妙地融合了多种生物材料的优点:
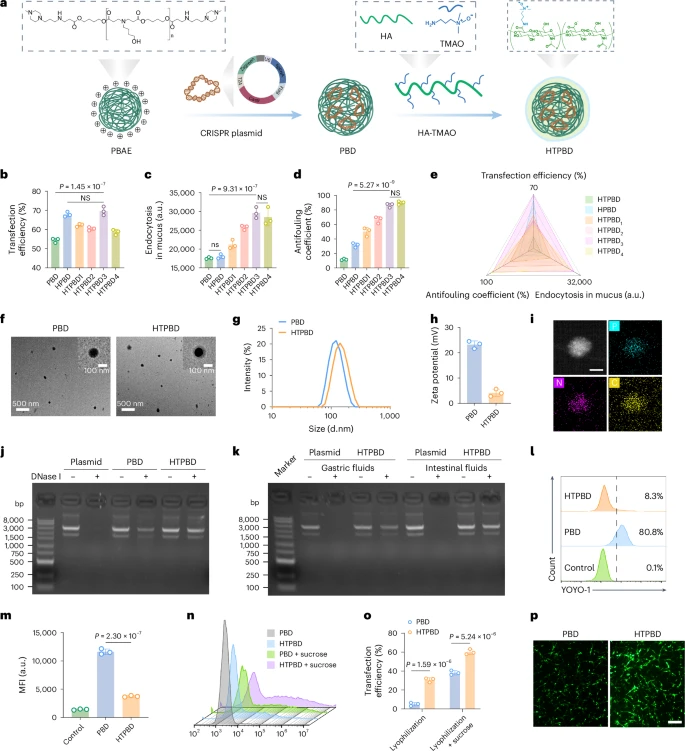
- 核心载体: 以聚(beta-氨基酯)(PBAE)为核心材料。PBAE是一种可生物降解的阳离子聚合物,能够通过静电作用有效包载和保护带负电荷的CRISPR-Cas9质粒,使其免受胃肠道环境的破坏。
- 表面包覆层: 在PBAE-质粒复合物的外部包覆一层由透明质酸(HA)和三甲胺氧化物(TMAO)偶联形成的特殊聚合物。
- 透明质酸(HA): 是一种天然多糖,具有良好的生物相容性,并且可以特异性结合在多种肿瘤细胞(包括结直肠癌细胞)表面高表达的CD44受体。这为纳米颗粒提供了靶向肿瘤的能力。
- 三甲胺氧化物(TMAO): 是一种小分子两性离子化合物,具有独特的水合能力和抗黏附特性。将其偶联到HA上,使得HTPBD纳米颗粒表面具有两性离子特征。
3.3 HTPBD 如何克服口服递送障碍并靶向肿瘤
HTPBD纳米颗粒的独特设计使其具备了克服口服递送障碍并高效靶向肿瘤的能力:
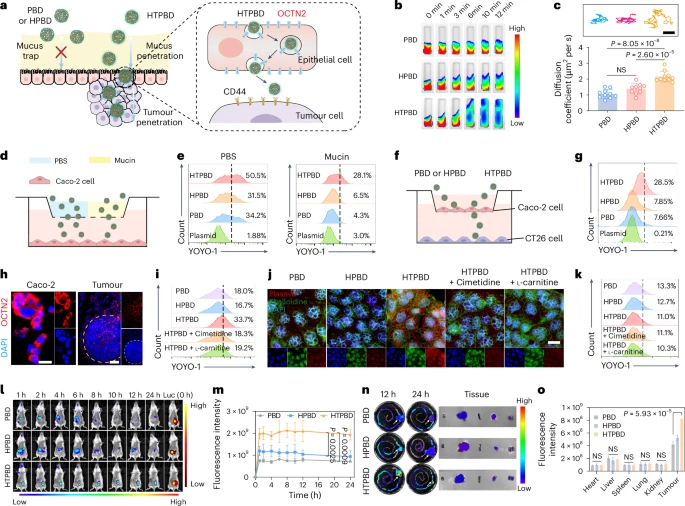
- 胃肠道稳定性: PBAE核心和HA-TMAO外壳共同作用,有效保护内部的CRISPR-Cas9质粒免受胃酸和消化酶的降解,确保基因编辑载体的完整性。
- 黏液穿透能力: HA-TMAO外壳表面的两性离子特性和优异水合能力,降低了纳米颗粒与带负电荷黏液的相互作用,使其能够快速有效地穿透肠道黏液层,避免被黏液捕获。
- 跨上皮转运(Transcytosis): 研究发现,肠道上皮细胞高表达OCTN2转运蛋白,该转运蛋白能够有效转运TMAO。HTPBD纳米颗粒可以利用OCTN2转运通路,通过细胞的跨膜运输,高效地从肠腔进入肠道上皮细胞,并进一步被吸收进入体内循环。
- 肿瘤靶向与富集: 进入体内循环后,HTPBD纳米颗粒可以借助透明质酸与结直肠癌细胞表面高表达的CD44受体特异性结合,实现对肿瘤组织的主动靶向。同时,纳米颗粒还能利用肿瘤组织异常的血管通透性增加和淋巴回流障碍,通过被动靶向在肿瘤部位积累。这些机制确保了HTPBD纳米颗粒能够高效地聚集在结直肠癌肿瘤区域,提高基因编辑系统在肿瘤细胞内的浓度。
4. 实验验证:疗效与安全性评估
研究人员通过一系列严谨的体外和体内实验,全面评估了HTPBD纳米颗粒的性能、基因编辑效率、治疗效果以及生物安全性。
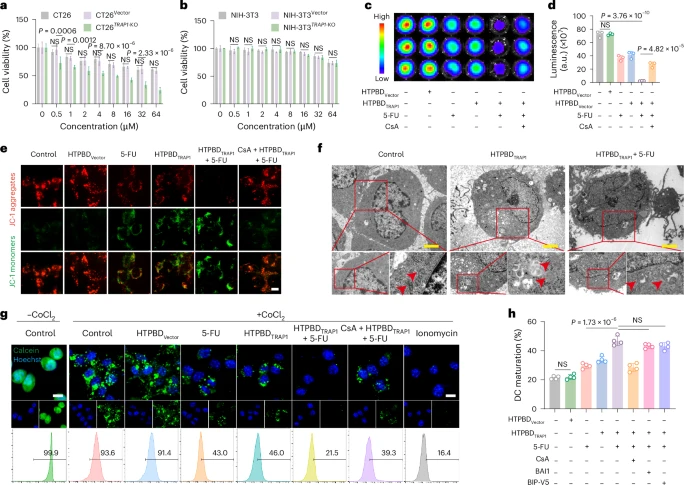
4.1 体外实验结果
在细胞水平的体外实验中,研究人员验证了HTPBD纳米颗粒的体外稳定性、细胞摄取效率以及TRAP1基因的编辑效果。实验结果表明,HTPBD纳米颗粒能够稳定存在于模拟胃肠道液体中,并被结直肠癌细胞高效内吞。成功进入细胞后,HTPBD能够有效释放CRISPR-Cas9质粒,并在结直肠癌细胞中实现显著的TRAP1基因敲低。功能学实验证实,HTPBD介导的TRAP1敲低能够显著增强化疗药物诱导的癌细胞死亡,并促进与免疫激活相关的分子释放,提示其潜在的免疫原性。
4.2 体内抗肿瘤疗效评估
研究人员在多种具有代表性的结直肠癌动物模型中评估了口服HTPBD纳米颗粒的治疗效果:
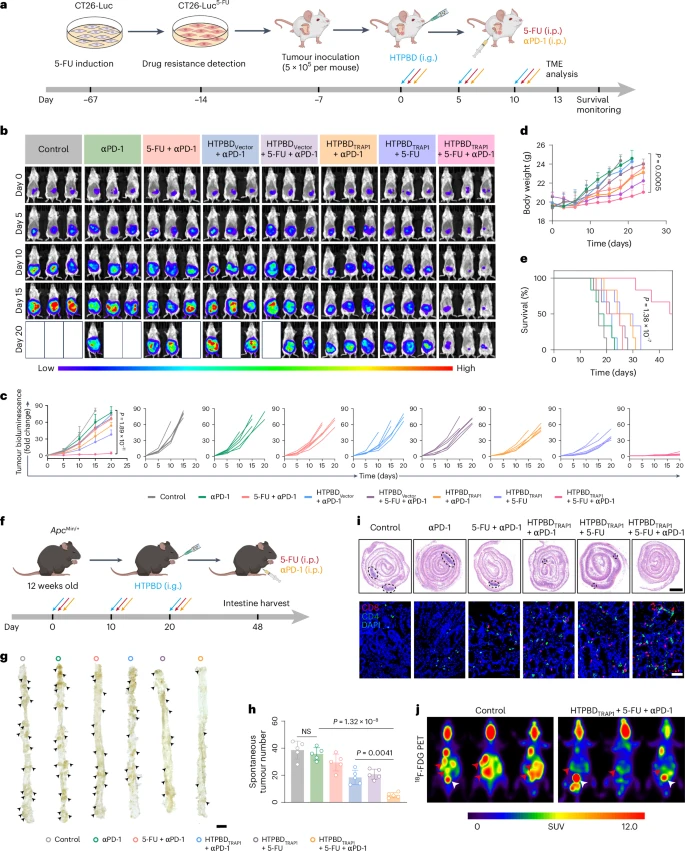
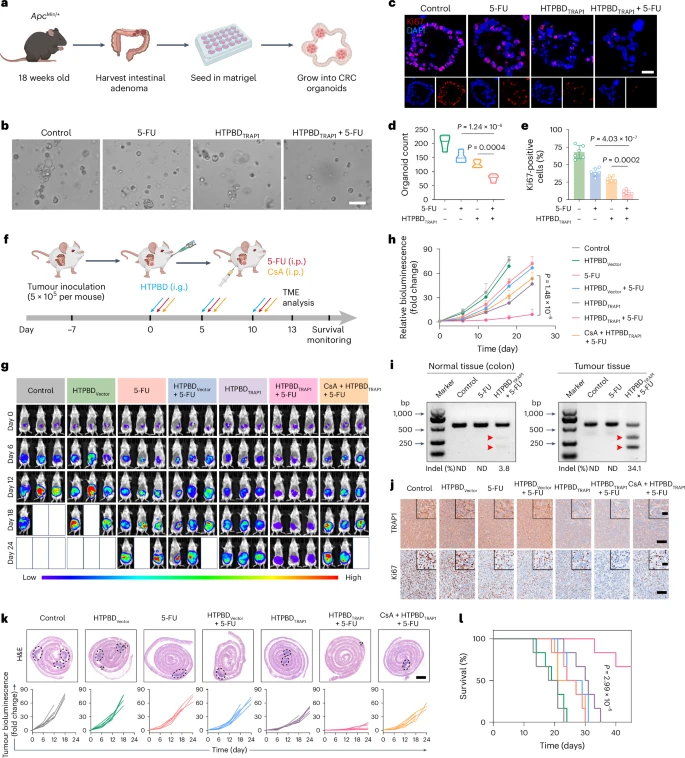
- 原位肿瘤模型: 在将结直肠癌细胞种植在小鼠结肠壁上形成的原位肿瘤模型中,口服HTPBD纳米颗粒结合化疗药物(5-FU)的治疗组,肿瘤生长受到显著抑制,与对照组相比肿瘤体积明显减小,动物的生存期显著延长。
- 化疗耐药肿瘤模型: 为了模拟临床上棘手的化疗耐药情况,研究人员构建了对常规化疗药物产生抵抗的结直肠癌小鼠模型。在这种模型中,单用化疗效果甚微,但口服HTPBD纳米颗粒联合化疗以及免疫检查点阻断治疗(anti-PD-1),展现出了强大的抗肿瘤效果,成功克服了肿瘤的耐药性。
- 自发性肿瘤模型: 研究人员还使用了遗传工程改造的、会自发形成结直肠肿瘤的小鼠模型,这种模型更接近人类结直肠癌的发生过程。在这些小鼠中,口服HTPBD纳米颗粒联合化疗和免疫检查点阻断治疗,显著减少了肿瘤的数量和体积,有效地控制了肿瘤的进展。
这些体内实验结果一致证明,口服HTPBD纳米颗粒能够有效地将基因编辑系统递送到肿瘤部位,实现TRAP1基因的调控,从而显著增强化疗和免疫疗法的抗肿瘤效果,尤其对于克服化疗耐药和免疫抑制具有重要意义。
4.3 机制深入研究:重塑肿瘤免疫微环境
为了进一步阐明HTPBD纳米颗粒增强化疗免疫疗法的机制,研究人员对治疗后肿瘤组织的免疫微环境进行了详细分析。结果显示,联合治疗显著改变了肿瘤微环境中的免疫细胞组成:
- 效应T细胞增加: 肿瘤组织中浸润的细胞毒性T细胞(CD8+ T细胞)和辅助性T细胞(CD4+ T细胞)数量显著增加,这些是负责杀伤肿瘤细胞和协调免疫反应的关键免疫细胞。
- 免疫抑制细胞减少: 髓源性抑制性细胞(MDSCs)和调节性T细胞(Treg细胞)等具有抑制免疫反应功能的细胞数量显著减少。
- 巨噬细胞极化: 肿瘤相关巨噬细胞的表型发生了改变,从促进肿瘤生长的M2型向具有抗肿瘤作用的M1型极化。
- 促炎症细胞因子上调: 肿瘤微环境中促炎症的细胞因子(如IFNγ、TNF-α、IL-6、IL-12p70)水平升高,进一步促进了抗肿瘤免疫反应的发生。
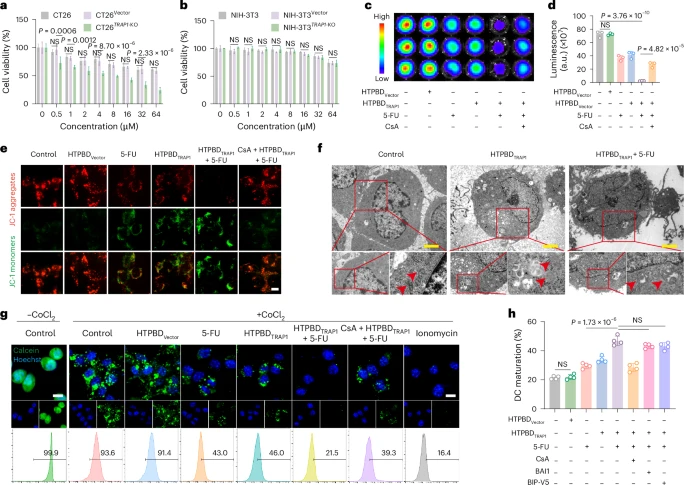
这些结果表明,HTPBD纳米颗粒通过敲低TRAP1并结合化疗,成功地将免疫抑制性的“冷”肿瘤微环境转变为免疫激活的“热”肿瘤微环境,这为免疫检查点阻断疗法发挥作用创造了有利条件,从而实现了强大的协同抗肿瘤效应。
4.4 生物安全性评估
对于任何新的药物递送系统,安全性都是至关重要的。研究人员对口服HTPBD纳米颗粒的生物安全性进行了全面评估。他们监测了接受治疗小鼠的体重变化和整体健康状况,并对主要器官进行了病理学检查。结果显示,即使在重复给药后,HTPBD纳米颗粒也没有引起明显的全身毒性,对心脏、肝脏、脾脏、肺、肾脏等主要器官没有造成显著损伤。此外,纳米颗粒也没有破坏肠道上皮细胞屏障的完整性。这些结果提示,HTPBD纳米颗粒作为一种口服药物递送系统具有较好的生物安全性。
5. 结论与未来展望
这项研究成功开发了一种新型的口服基因编辑纳米颗粒HTPBD,并证明了它能够有效克服口服给药的挑战,将CRISPR-Cas9基因编辑系统特异性地递送到结直肠癌肿瘤部位。通过敲低TRAP1基因,HTPBD纳米颗粒能够增强化疗诱导的免疫原性细胞死亡,重塑肿瘤免疫微环境,从而显著增强化疗和免疫检查点阻断疗法的抗肿瘤效果。
这项研究不仅为结直肠癌的治疗提供了一种有前景的新策略,特别是对于化疗耐药和免疫抑制性肿瘤,也为口服递送基因编辑系统治疗其他胃肠道疾病开辟了新的研究方向。未来,这种基于口服纳米颗粒的基因编辑疗法有望在临床上应用于结直肠癌患者,为他们带来更有效、更安全的治疗选择,改善生存预后。这项工作是纳米技术、基因编辑和肿瘤免疫治疗交叉领域的重要进展。
参考文献:
Zhao, K., Yan, Y., Jin, XK. et al. An orally administered gene editing nanoparticle boosts chemo-immunotherapy in colorectal cancer. Nat. Nanotechnol. (2025). https://doi.org/10.1038/s41565-025-01904-5