【Nat.Photon.】揭秘显微成像新突破:s²ISM技术如何同时实现“看得清”与“看得深”
在探索微观生命奥秘的旅程中,显微镜是科学家们不可或缺的“眼睛”。我们不仅希望看得更清晰(高分辨率),从而分辨出细胞内更精细的结构;还希望看得更准确(光学切片),能够聚焦于样本特定深度的一薄层,排除其他层面的模糊干扰。然而,长期以来,这两大目标往往像鱼与熊掌,难以兼得。这篇开创性的研究论文,便提出了一种名为 s²ISM 的计算成像方法,巧妙地破解了这一难题,实现了“超高分辨率”与“强光学切片”能力的完美融合。
第一部分:当前显微成像技术面临的“两难困境”
要理解 s²ISM 技术的革命性,我们首先需要了解它所要解决的痛点。想象一下,我们想要观察一个三维的生物样本,比如一个细胞,它就像一本半透明的厚书。我们的目标是清晰地阅读其中某一页(焦平面)的内容,而不被其他书页(焦外平面)上模糊的字迹所干扰。
经典之选:共聚焦显微镜(CLSM)的权衡
传统的共聚焦激光扫描显微镜(CLSM)是实现这一目标最流行的工具之一。它的核心武器是一个被称为“针孔(pinhole)”的物理小孔。这个针孔像一个严格的门卫,只允许来自焦平面的聚焦光线通过并被探测器接收,而大部分来自焦外平面的散射光线则被无情地阻挡在外。
这种设计的优点显而易见:
光学切片能力:通过阻挡焦外光,实现了对样本的“光学切片”,让我们能看到清晰的二维层面图像。
分辨率提升:针孔越小,光学切片能力越强,横向分辨率也越高。
但其“两难困境”也随之而来:
- 信号与分辨率的矛盾:为了追求极致的分辨率和切片效果,科学家需要将针孔缩得非常小。然而,这会导致绝大部分宝贵的荧光信号也被一同挡掉,最终得到的图像会非常暗淡,信噪比(SNR)极差。这就像为了看清书页上的一个小字,却把周围的光都遮住了,结果什么也看不见。
现代升级:图像扫描显微镜(ISM)的新问题
为了解决共聚焦显微镜“光信号浪费”的问题,科学家们开发了图像扫描显微镜(ISM)技术。ISM用一个高灵敏度的“探测器阵列”(比如由多个微型探测器组成的棋盘)取代了单一的探测器和物理针孔。这个阵列中的每一个小单元都相当于一个微型针孔,可以独立地收集光信号。
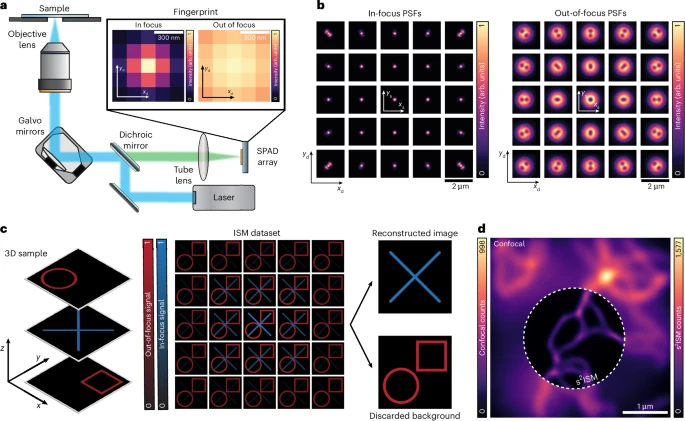
ISM的优势在于:
高光子收集效率:整个探测器阵列可以收集到几乎所有从样本发出的荧光信号,即使是那些在共聚焦模式下会被针孔挡掉的光子,从而获得极高的信噪比,图像明亮而清晰。
超高分辨率:通过特定的图像重建算法(如自适应像素重定位APR),ISM能够将所有探测器单元收集到的信息融合起来,实现超越衍射极限的超高分辨率。
然而,ISM也引入了一个新的、致命的缺陷:
- 光学切片能力缺失:由于它旨在收集所有光子,因此焦外平面产生的模糊背景光也被毫无保留地接收了。这使得ISM在处理较厚的生物样本时表现不佳,清晰的细节会被淹没在模糊的背景“海洋”中,无法实现真正的光学切片。
至此,显微成像领域似乎陷入了一个循环:要么牺牲信号换取切片能力(CLSM),要么为了信号而放弃切片能力(ISM)。
第二部分:s²ISM的诞生——从“物理阻挡”到“智能计算分离”
这篇论文的作者们提出了一个颠覆性的观点:实现光学切片,不一定需要物理上“扔掉”焦外光,我们可以通过智能的计算方法,将它们从数据中“分离”出来。 这就是s²ISM技术的核心思想。
核心洞察:焦外光在探测器上留下的独特“指纹”
研究者们发现了一个关键现象:虽然ISM探测器阵列收集了所有光子,但来自不同深度的光子在阵列上形成的图案(或称“指纹”)是截然不同的。
焦平面信号:来自焦平面的光子,经过显微镜系统后,会非常精确地汇聚在探测器阵列的中心区域。其能量分布像一个明亮、集中的光斑。
焦外平面信号:而来自焦外平面的光子,到达探测器阵列时已经散焦,会形成一个更弥散、更暗淡的环状或模糊光斑,其能量更多地分布在探测器阵列的边缘区域。
这个“指纹”的差异,意味着ISM采集到的原始数据中,本身就隐藏着关于光子来源深度的三维信息。之前的ISM算法忽略了这一宝贵信息,而s²ISM正是要利用它来做文章。
s²ISM算法:一位聪明的“数字侦探”
s²ISM算法的工作原理,可以比作一位处理混合信号的数字侦探。它不对原始数据进行简单的相加,而是建立了一个精确的物理模型,该模型描述了焦平面和焦外平面的物体分别会在探测器阵列上产生什么样的图像。
算法流程大致如下:
建立假设模型:算法假设最终的图像是由两部分叠加而成:一个是我们想要的“焦内图像”,另一个是需要剔除的“焦外背景图像”。
迭代求解:基于这一模型,算法采用了一种名为“最大似然估计”的数学方法(类似于经典的Richardson-Lucy算法)进行迭代计算。在每一次迭代中,算法都会将采集到的原始数据与当前模型预测的数据进行比较,然后根据差异来修正“焦内图像”和“焦外背景图像”。
智能分离:这个过程就像是在解一个方程组,算法利用焦内光和焦外光在探测器上不同的“指纹”作为关键线索,不断地将混合在一起的光子信号“分拣”到正确的图像中。
最终输出:经过一定次数的迭代后,算法最终会输出两张独立的图像:一张是经过超分辨率增强、并且去除了背景的纯净焦内图像;另一张则是被成功分离出来的、包含所有焦外模糊信息的背景图像,后者将被直接丢弃。
通过这种方式,s²ISM在没有牺牲任何光子的前提下,同时实现了三大目标:
超高分辨率:继承并优化了ISM的分辨率增强能力。
强光学切片:通过计算分离,有效去除了焦外背景。
高信噪比:因为它利用了所有探测到的光子来重建焦内图像。
第三部分:眼见为实——s²ISM的出色性能验证
为了证明s²ISM并非纸上谈兵,研究团队进行了一系列严谨的实验,并将其与共聚焦(CLSM)、自适应像素重定位(APR)、多图像反卷积以及Focus-ISM等多种现有技术进行了全方位对比。
更清晰的细胞结构成像
在对HeLa细胞中的微管网络进行成像时,s²ISM的优势一目了然。
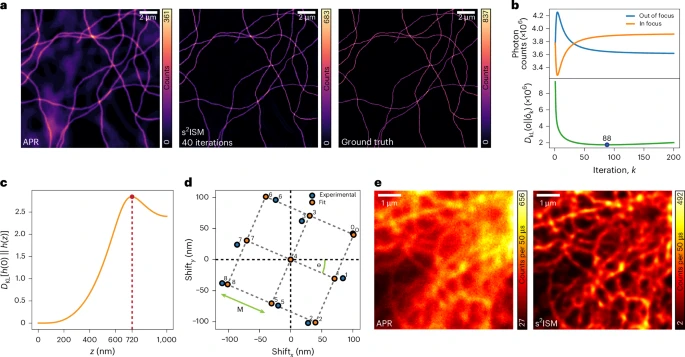
传统方法:在APR等方法的图像中,虽然分辨率有所提升,但整个细胞弥漫着一层由焦外微管造成的“雾霾”,许多精细的纤维结构被模糊的背景所掩盖。
s²ISM方法:经过s²ISM处理后,背景“雾霾”被一扫而空,图像背景变得干净深邃,微管网络的丝状结构根根分明,细节对比度显著增强。
定量化的性能评估
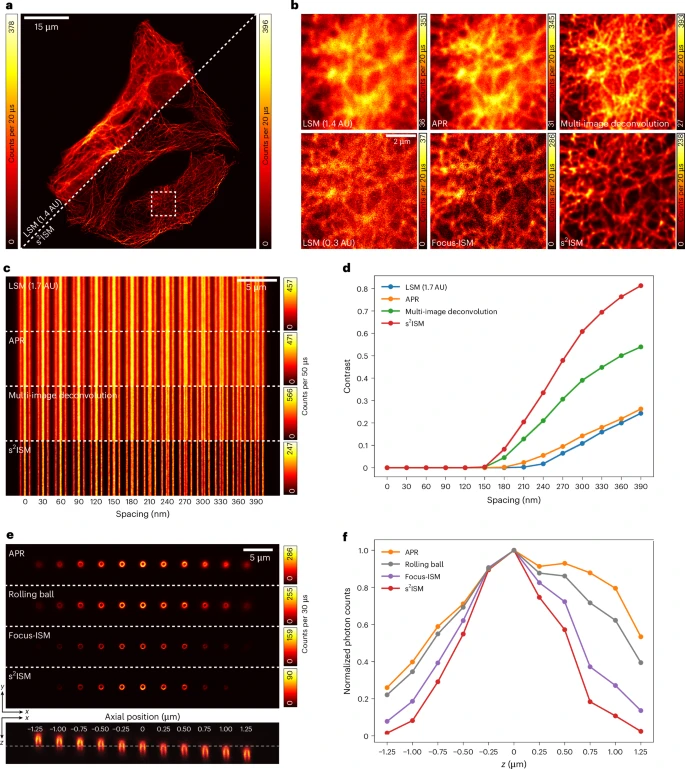
分辨率测试:研究者使用了一个由间距渐小的线条构成的标准分辨率测试板。结果显示,s²ISM能够分辨的最小间距远小于传统共聚焦显微镜,甚至优于其他先进的ISM算法,证明了其卓越的超分辨率能力。
光学切片能力测试:他们设计了一个“3D阶梯”样本,由沿Z轴方向等距排列的荧光环构成。当只采集阶梯中间一层的数据时,APR等方法重建的图像中,上下几层的荧光环依然清晰可见,表现出很差的切片能力。而s²ISM的图像中,只有焦平面的那个环是明亮的,其他环的信号被极大地抑制了,展示了其强大的光学切片性能,其切片能力是传统ISM的两倍。
第四部分:远不止于此——s²ISM强大的多功能性与拓展性
s²ISM的魅力不仅在于其核心性能的突破,更在于它作为一个平台技术的巨大潜力。研究表明,它可以轻松地与多种先进的成像模式相结合。
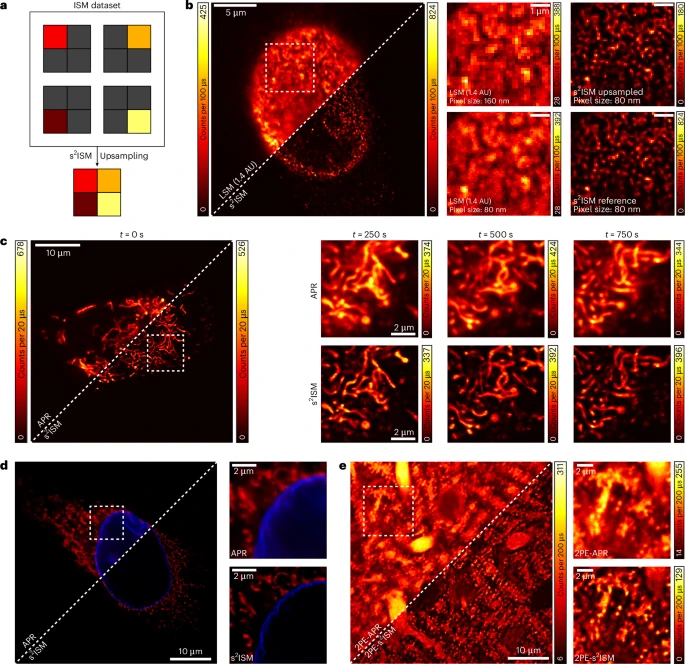
更快速、更温和的成像
s²ISM支持一种“数字超采样”技术。这意味着可以在采集数据时使用更大的像素(即扫描速度更快,每个点的光照时间更短),从而减少对活细胞的光毒性,实现更快速、更“温和”的成像。之后,算法可以利用探测器阵列的冗余信息,在计算中恢复出高分辨率的图像。研究中,他们对细胞核孔复合体的成像就成功验证了这一点。
动态生命过程的观察
由于其高信噪比和高分辨率的特性,s²ISM非常适合用于活细胞的长时间动态成像。论文中展示了对活细胞内线粒体动态分裂和融合过程的清晰记录,每一帧图像都兼具高分辨率和干净的背景。
多色成像与深度组织成像
多色成像:s²ISM可以无缝应用于多色荧光成像,只需对不同颜色通道的数据分别进行重建即可。论文展示了对线粒体(红色)和核膜(蓝色)同时进行的高质量双色成像。
深度组织成像:结合双光子激发(2PE)技术——一种更适合穿透深层组织的激发方式,s²ISM同样能显著提升成像质量。论文中对小鼠小脑切片深处(约10微米)的浦肯野细胞的成像结果,证明了其在组织成像领域的应用潜力。
终极拓展:结合荧光寿命成像(s²FLISM)
这是本文最令人激动的拓展之一。除了位置、强度和颜色,荧光分子还有一个重要的内在属性——荧光寿命(分子被激发后发光持续的时间)。不同的分子或同一分子在不同化学环境中,其荧光寿命会有差异。
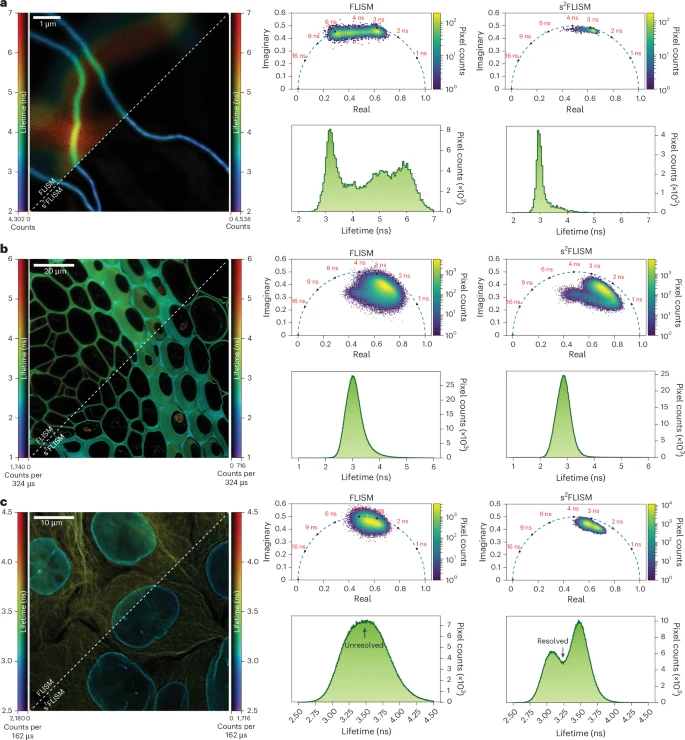
传统FLIM的挑战:传统的荧光寿命成像(FLISM)同样会受到焦外背景光的干扰。如果焦内和焦外的分子寿命不同,焦外光会“污染”焦内光的寿命测量,导致结果不准确。
s²FLISM的解决方案:作者将s²ISM算法推广到了时间维度,开发出s²FLISM。该算法不仅能根据空间“指纹”分离焦内和焦外光,还能同时处理它们的时间(寿命)信息。它能够精确地分离出焦内信号的纯净荧光衰减曲线,从而实现高精度的寿命测量。
实验中,他们对两种寿命相近且空间位置重叠的蛋白质(微管蛋白和核纤层蛋白)进行成像。在传统FLISM图像中,两种蛋白的寿命信号混杂在一起,难以区分。而经过s²FLISM处理后,它们的寿命分布被清晰地分成了两个峰,实现了完美的区分,极大地提升了分子识别能力。
结论:开启显微成像新纪元
这篇论文提出的 s²ISM 技术,不仅仅是对现有ISM方法的一次简单改进,更是一种思想上的革新。它告诉我们,通过深度挖掘探测器阵列采集到的全部信息,并辅以强大的计算模型,我们能够克服长期以来困扰显微成像领域的“分辨率-信噪比-光学切片”之间的内在矛盾。
s²ISM 是一个全面、无妥协的解决方案。它将激光扫描显微镜的性能推向了一个新的高度,为细胞生物学、神经科学、发育生物学等众多领域的研究者们提供了一件前所未有的强大工具。更重要的是,作者们将相关的分析代码开源 52525252,这无疑将极大地推动该技术的普及和进一步发展,让我们能够以更清晰、更深入、更全面的视角,去探索微观世界的无限奥秘。
参考文献
Zunino, A., Garrè, G., Perego, E. et al. Structured detection for simultaneous super-resolution and optical sectioning in laser scanning microscopy. Nat. Photon. (2025). https://doi.org/10.1038/s41566-025-01695-0