【Nat. Mater.】超声波激活的压电纳米贴片:神经干细胞治疗创伤性脑损伤的新策略
创伤性脑损伤 (Traumatic Brain Injury, TBI) 是全球范围内导致青壮年残疾和死亡的主要原因之一 。由于成年神经元的再生能力非常有限,目前尚缺乏有效的治疗手段来逆转或延缓TBI的进展 。神经干细胞 (Neural Stem Cells, NSCs) 能够分化为功能健全的神经元,因此被认为是治疗TBI的希望 。然而,神经干细胞自身的分化和增殖过程缓慢且效率低下,限制了其临床应用效果 。近年来研究表明,压电刺激能够促进神经干细胞的分化和增殖 。
基于此,一项发表于《自然·材料》(Nature Materials) 的研究,介绍了一种新型的钛酸钡-还原氧化石墨烯 (BTO/rGO) 杂化压电纳米贴片,为TBI治疗带来了新的可能 。
压电纳米贴片的创新设计与作用机制
传统压电材料的局限性
研究人员首先尝试使用传统的钛酸钡 (BTO) 纳米颗粒进行实验。BTO纳米颗粒具有良好的压电效应和生物相容性,在超声波的激发下可以产生电信号,从而刺激细胞 。然而,研究发现,超声波激活的BTO纳米颗粒虽然能够促进PC12细胞(一种常用的神经细胞模型)向神经元样细胞分化,但对于神经干细胞,效果并不理想,甚至会导致神经干细胞死亡 。
进一步的研究揭示了其中的原因:BTO纳米颗粒容易被神经干细胞吞噬进入细胞内部,并在溶酶体的酸性环境下,在超声波的刺激下产生活性氧 (Reactive Oxygen Species, ROS) 。活性氧会对细胞产生毒性,从而抑制了神经干细胞的分化并导致其死亡 。研究人员尝试了不同强度的超声波,但都无法在有效诱导神经干细胞分化的同时避免活性氧带来的损伤 。
新型BTO/rGO纳米贴片的优势
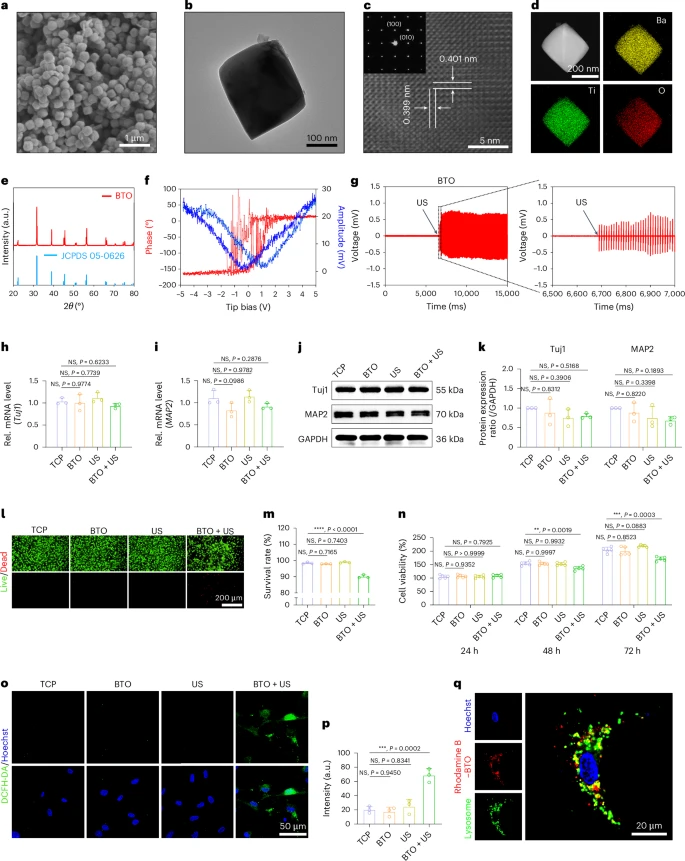
为了解决上述问题,研究团队创新性地设计了BTO/rGO杂化压电纳米贴片 。他们将BTO纳米颗粒固定在二维的还原氧化石墨烯 (rGO) 纳米片表面 。这种设计的巧妙之处在于:
- 细胞外刺激:rGO纳米片的二维结构可以有效阻止BTO纳米颗粒被细胞吞噬,使其附着在神经干细胞的细胞膜表面 。这样,在超声波的刺激下,BTO纳米颗粒产生的压电信号可以直接作用于细胞膜上的相关受体,而不会进入细胞内部产生有害的活性氧 。
- 增强的压电效应:实验证明,BTO/rGO纳米贴片在超声波激发下能够产生稳定的压电电位,有效激活细胞膜电位变化 。
- 良好的生物相容性:一系列实验表明,BTO/rGO纳米贴片本身及其在超声波下的应用,对神经干细胞的存活率和增殖能力没有负面影响,并且在动物体内也表现出良好的生物相容性 。
BTO/rGO纳米贴片促进神经干细胞分化和成熟
促进神经元标志物的表达
研究人员通过检测神经元相关的基因和蛋白表达水平,评估了BTO/rGO纳米贴片对神经干细胞分化的影响。结果显示,在超声波的辅助下,与BTO/rGO纳米贴片共同培养的神经干细胞,其早期神经元标志物 (Tuj1) 和成熟神经元标志物 (MAP2) 的表达水平均显著升高,而神经胶质细胞标志物 (GFAP) 的表达没有明显变化 。这表明BTO/rGO纳米贴片能够特异性地促进神经干细胞向神经元方向分化 。
作为对照,单独使用rGO纳米片或使用不具备压电效应的立方相BTO/rGO纳米贴片进行实验,均未观察到明显的促分化效果 。这进一步证实了压电信号在促进神经干细胞分化中的关键作用 。
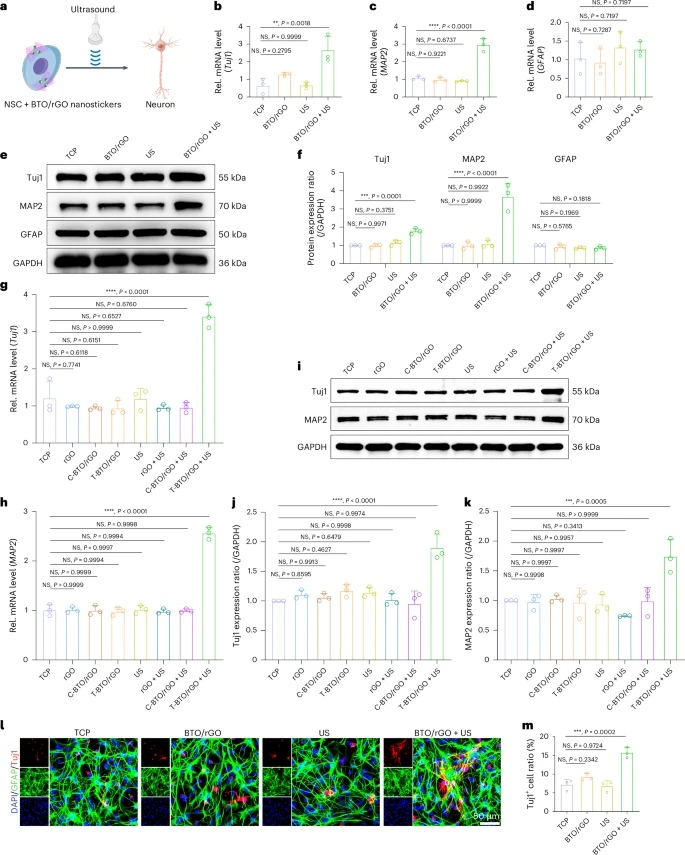
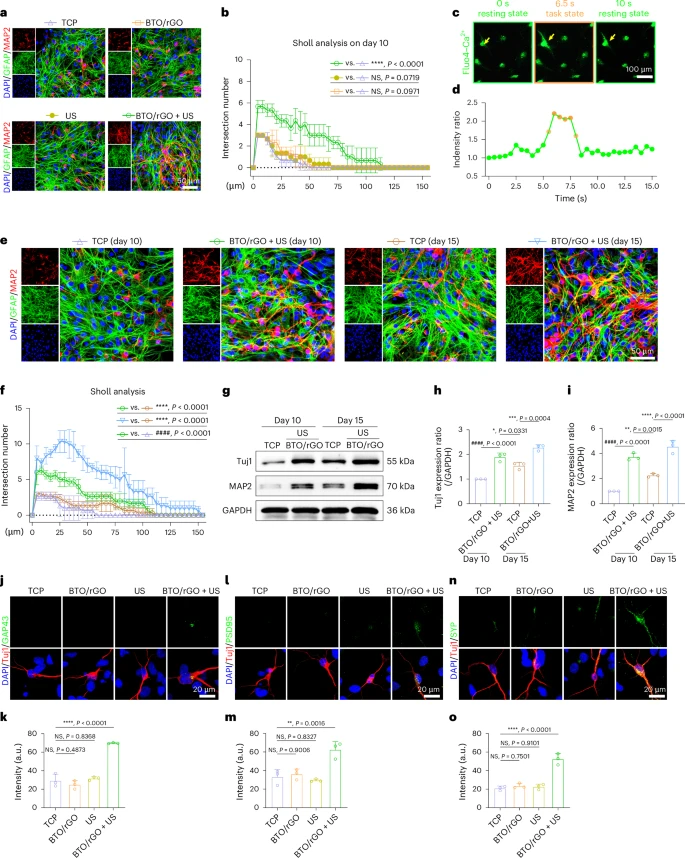
加速神经元的成熟和突触形成
除了促进分化,BTO/rGO纳米贴片还能显著加速神经元的成熟过程。经过BTO/rGO纳米贴片和超声波处理的神经干细胞分化成的神经元,在第10天就表现出更长的轴突和更复杂的神经网络结构 。钙离子成像实验显示,这些神经元在第5天就表现出明显的钙离子内流和外流现象,这是神经元功能成熟的典型特征 。更令人鼓舞的是,研究人员还观察到了相邻神经元之间的钙信号传递,表明形成了功能性的突触连接 。
相比之下,未经BTO/rGO纳米贴片和超声波处理的神经干细胞,其自发分化形成的神经元成熟速度要慢得多,至少需要15天才能达到相似的成熟度 。同时,与突触形成相关的蛋白(如GAP43, PSD95, SYP)的表达水平在BTO/rGO + 超声波处理组也显著更高,表明突触的成熟也得到了加速 。这种快速的神经元成熟和网络构建对于修复受损的神经系统至关重要 。
揭示分子机制:钙信号通路的关键作用
为了探究BTO/rGO纳米贴片促进神经干细胞分化的深层机制,研究人员进行了基因表达谱分析。结果发现,BTO/rGO + 超声波处理组的神经干细胞中,有近2000个基因的表达发生了显著变化 。其中,与神经发生相关的基因(如Sox10)表达上调,而维持干细胞特性的基因表达下调 。
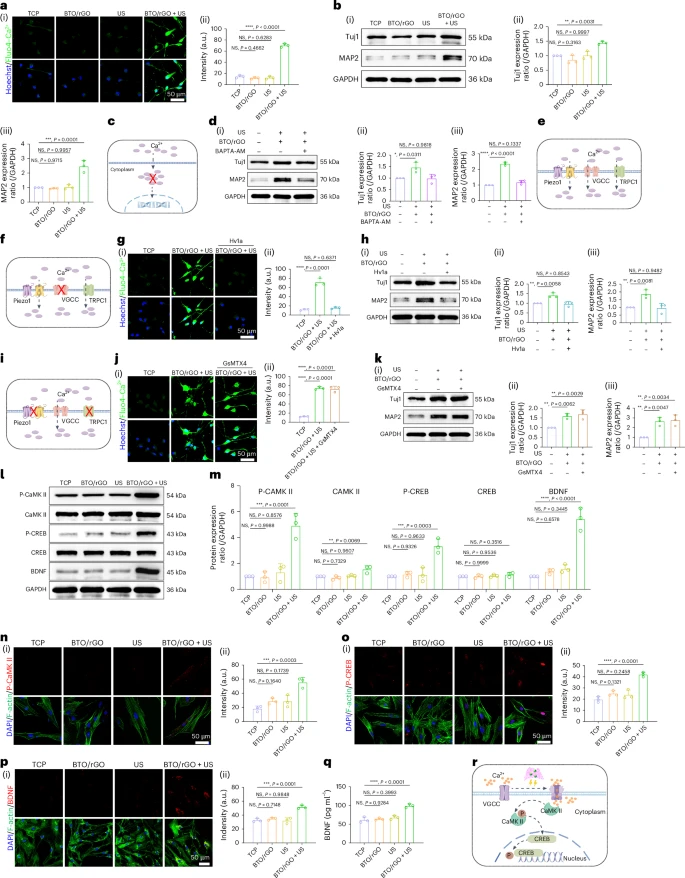
通路富集分析显示,钙信号通路以及与大脑和神经系统发育相关的基因在BTO/rGO + 超声波处理组显著富集 。这提示钙信号通路在压电纳米贴片诱导的神经分化中扮演了重要角色。进一步的实验证实,超声波激活的BTO/rGO纳米贴片能够引起细胞膜上钙通道的开放,导致钙离子内流 。
通过使用不同通道的抑制剂,研究人员发现电压门控钙通道 (VGCC) 是介导压电信号向细胞内钙信号转导的关键通道 。当VGCC被抑制后,钙离子内流受阻,BTO/rGO纳米贴片促进神经干细胞分化的效果也明显减弱 。
钙离子内流后,会激活下游的一系列信号分子。研究表明,钙离子激活了钙/钙调素依赖性蛋白激酶II (CaMKII),进而激活了cAMP反应元件结合蛋白 (CREB) 。CREB的激活最终导致了脑源性神经营养因子 (BDNF) 表达的显著升高 。BDNF是一种对神经发生至关重要的神经营养因子。如果阻断CaMKII的功能,则下游的CREB激活和BDNF表达均受到抑制,神经干细胞的分化也随之减缓 。
综上所述,超声波激活的BTO/rGO纳米贴片通过附着在神经干细胞膜表面,将压电信号传递给电压门控钙通道 (VGCC),引起钙离子内流,进而激活CaMKII/CREB信号通路,最终上调BDNF的表达,从而促进神经干细胞向功能性神经元分化和成熟 。
动物实验验证治疗效果
研究团队进一步在TBI大鼠模型上验证了BTO/rGO纳米贴片结合神经干细胞移植的治疗效果 。他们将预先与BTO/rGO纳米贴片结合的神经干细胞移植到TBI大鼠的损伤脑区,并进行间歇性的超声波照射 。
行为学评估结果显示,接受BTO/rGO纳米贴片和神经干细胞联合治疗并辅以超声波照射的TBI大鼠,其神经功能缺损评分显著低于其他治疗组,在平衡木等测试中表现出更好的运动协调能力 。
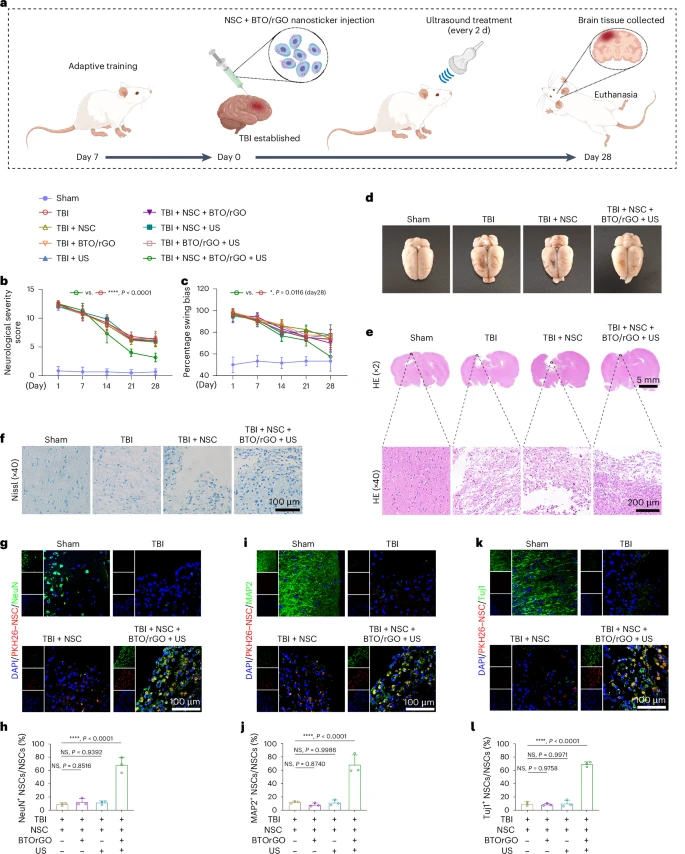
脑组织学检查也证实了其优越的治疗效果。在治疗28天后,该组大鼠脑损伤区域的空腔被新生神经组织填充,损伤面积显著减小,修复的组织结构也更为规整 。尼氏染色结果显示该组大鼠脑内有更多正常的尼氏小体,这是神经元功能正常的标志 。免疫荧光染色进一步表明,移植的神经干细胞在该组大鼠脑内大量分化为成熟神经元 (NeuN, MAP2, Tuj1 阳性细胞) 。
此外,研究还发现,BTO/rGO + 超声波治疗能够减轻损伤区域的炎症反应,为神经干细胞的分化和脑组织修复创造了更有利的环境 。
总结与展望
这项研究成功设计了一种新型的BTO/rGO杂化压电纳米贴片,它能够安全有效地附着在神经干细胞膜表面,在超声波的远程控制下产生压电信号,通过激活VGCC/Ca²⁺/CaMKII/CREB/BDNF信号通路,显著促进神经干细胞向功能性神经元的分化和成熟,并最终在TBI动物模型中展现出优异的脑组织修复和神经功能恢复效果 。
这项研究不仅为TBI的细胞治疗提供了一种极具潜力的新策略,也揭示了压电刺激在不同亚细胞定位下对细胞行为和功能的不同影响,为未来生物材料与细胞相互作用的研究开辟了新的方向 。这种压电纳米贴片与干细胞结合的治疗策略有望拓展到其他类型的细胞(如免疫细胞)以及其他神经退行性疾病(如帕金森病和阿尔茨海默病)的治疗中,具有广阔的临床转化前景 。
参考文献
Wang, W., Li, K., Ma, W. et al. Ultrasound-activated piezoelectric nanostickers for neural stem cell therapy of traumatic brain injury. Nat. Mater. (2025). https://doi.org/10.1038/s41563-025-02214-w