【Nat.Rev.Bioeng.】用于疾病诊断与治疗的有机余辉发光
摘要
余辉发光成像依赖于在停止辐照后检测化学或晶格缺陷发出的光子,与荧光成像相比,它能实现无自发荧光的生物医学成像,并具有更高的信噪比。特别是有机余辉探针,其优势在于良好的生物相容性,并可设计成多样的分子结构,适用于包括光、超声波和X射线在内的多种辐照源。在这篇综述中,我们首先介绍余辉发射的机理。接着,我们探讨有机余辉探针的设计策略,并概述提高其余辉性能的策略,特别是在余辉强度、拓展发射波长、响应性和多样化激发源方面,以实现在深层组织中具有高灵敏度和特异性的生物成像。最后,我们重点介绍其在疾病诊断和治疗中的关键生物医学应用,并对有机余辉成像领域仍然存在的挑战和机遇进行概述。
关键要点
有机余辉发光是一个将外部激发能转化为可储存的化学能,并在辐照停止后以光的形式缓慢释放出来的过程。
有机余辉发光探针通常包括一个在辐照下产生活性氧的余辉引发剂,一个与活性氧反应形成化学缺陷的余辉底物,以及一个发射余辉的中继单元。
通过优化有机探针,可以拓展余辉波长、增强亮度和实现对特定生物标志物的激活响应。
有机余辉发光可应用于多种生物医学领域,包括癌症诊断与治疗、炎症成像以及影像引导治疗。
引言
光学成像具有成本低、无创性和高时空分辨率等优点,是基础研究和生物医学应用的有力工具。与X射线计算机断层扫描和磁共振成像等成像方式相比,光学成像能够使用设计灵活、具有生物标志物响应性和多功能性的多样化探针,以在分子水平上实时可视化病理生理过程。例如,FDA批准的亚甲蓝可用于追踪淋巴结转移,而吲哚菁绿可用于血流、肿瘤和前哨淋巴结的成像。然而,荧光成像在成像过程中需要实时的光激发,这会激发内源性生物分子产生自发荧光,从而降低成像灵敏度、信噪比(SBR)和组织穿透深度(图1a)。因此,自发光成像方法,如化学发光和生物发光,因其无需外部光激发而不受自发荧光限制,更适用于高灵敏度的体内成像。
化学发光和生物发光分别依赖于活性物质引发和酶催化的氧化反应,这些反应使底物形成高能的过氧化物中间体(图1b)。随后,这些中间体的分解会产生激发态物质(例如,化学激发过程),当其弛豫到基态时便会发光。为提高体内成像的灵敏度和保真度,可以对底物进行优化,以拓展波长、提高发光效率并实现对生物标志物的特异性响应。然而,内部的氧化还原刺激和底物的可用性会影响光学信号。此外,生物发光需要基因转染。因此,研究人员正在探索其他无自发荧光的光学成像技术。
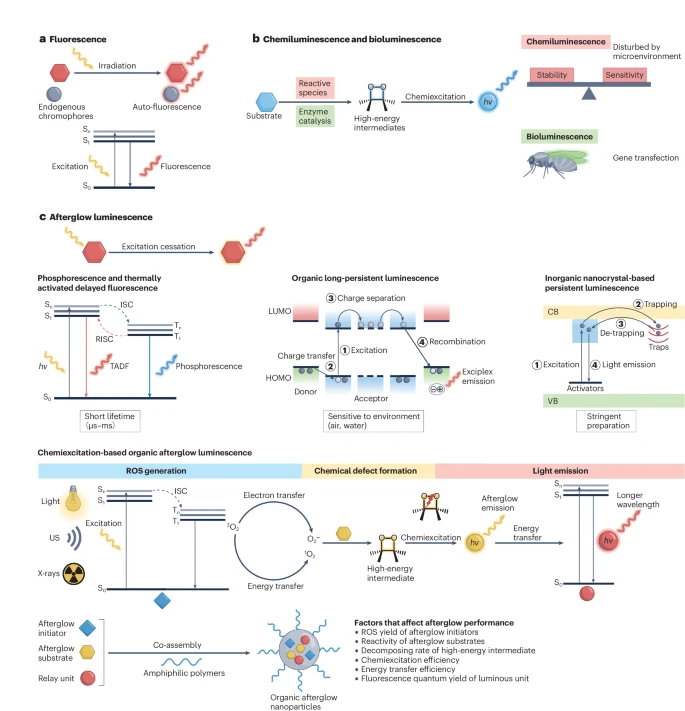 图1:光学成像模式。
图1:光学成像模式。
a, 荧光是物质吸收辐射后发光的过程。由于内源性生色团的存在,荧光成像受到自发荧光的限制。 b, 化学发光是在化学物质刺激下的持续发光,可能会受到内部氧化还原微环境的干扰。生物发光是在荧光素酶催化下的持续发光,需要基因转染以及酶与底物间的识别。 c, 余辉发光是辐照停止后的持续发光。磷光是电子从T1态到S0态的辐射跃迁,伴随着从S1态到T1态的系间窜越(ISC)。热活化延迟荧光(TADF)是电子从S1态到S0态的辐射跃迁,伴随着S1态和T1态之间的系间窜越和反向系间窜越(RISC)。这些过程的寿命很短(微秒到毫秒级)。有机长余辉发光是由长寿命电荷分离中间态的扩散和复合引起的持续发光。有机长余辉对环境因素敏感,特别是O₂和水。基于无机纳米晶体的长余辉发光是由电荷载流子俘获引起的持续发光,需要复杂的制备条件。基于化学激发的有机余辉发光(有机余辉发光)通常基于由余辉引发剂、余辉底物和中继单元组成的有机余辉纳米粒子。激发后,余辉引发剂被激发并产生活性氧(ROS),如¹O₂和O₂•⁻。ROS氧化余辉底物形成高能中间体,这些中间体在自发降解过程中能以发光的形式释放能量。中继单元可以吸收这些能量以拓展发射波长。¹O₂, 单线态氧;O₂•⁻, 超氧阴离子;CB, 导带;HOMO, 最高占据分子轨道;LUMO, 最低未占分子轨道;US, 超声;VB, 价带。
余辉发光源于辐照停止后能量可储存的缺陷。人们已经发现了具有不同发光机制的多种余辉材料,包括基于无机纳米晶体的长余辉、室温磷光、通过反向系间窜越实现的热活化延迟荧光、通过电荷分离和复合过程实现的有机长余辉,以及基于化学激发的有机余辉发光(图1c)。其中,热活化延迟荧光和磷光的寿命都很短(从微秒到毫秒)。尽管已有研究探索将具有秒级寿命的长效磷光用于生物成像,但利用现有成像设备实现这种机制仍具挑战。有机长余辉通常在固态(例如薄膜中)观察到,因为由供体和受体分子的激发态复合物形成的有机激基复合物在水溶液中倾向于通过非辐射跃迁失活。因此,磷光、热活化延迟荧光和有机长余辉通常不用于生物医学成像。掺杂有镧系或过渡金属离子的无机长余辉材料可以产生持续数小时的余辉发射,并已应用于肿瘤成像和药物追踪等多种生物医学领域。然而,它们仍然受到制备条件复杂、信号亮度低和潜在生物毒性的限制。
有机余辉发光是一个将外部激发能(如光、超声波、X射线)转化为可储存的化学能,并在辐照停止后以光的形式缓慢释放出来的过程。该过程涉及辐照诱导产生活性氧(ROS),主要是单线态氧(¹O₂),随后发生氧化反应形成高能过氧化物(如1,2-二氧杂环丁烷),这些被称为化学缺陷。这种化学缺陷不稳定,会自发分解,同时产生一个辐射性的电子激发态物质并发射余辉(图1c)。因此,有机余辉发光是一个化学激发过程,与化学发光和生物发光类似。然而,它通过对材料进行外部预辐照来原位产生ROS(主要是¹O₂)以引发氧化反应,而化学发光和生物发光则依赖于外部活性物质介导或酶催化介导的化学氧化和激发过程。因此,有机余辉发光是稳定的,即不受生物刺激的影响,且无需基因转染。
有机余辉发光依赖于具有生物相容性的有机余辉分子,这使得其设计灵活并具有结构-性质相关性。有机余辉发光最早在半导体聚合物中被发现,例如聚(2-甲氧基-5-(2-乙基己氧基)-1,4-苯撑乙烯) (MEHPPV)(图2a),其机理在2017年被揭示。基于噻吩的余辉聚合物的发现将有机余辉发光的应用拓展到光热治疗监测和区分癌症外泌体。2019年,一种构建有机余辉探针的通用策略被提出,该策略涉及三个关键组分,包括余辉引发剂、底物和中继单元。此后,多种化学发光底物,如金刚烷叉烯醇醚(AEEs)、N,N-二甲基-4-(2-苯基-5,6-二氢-1,4-氧硫杂环己-3-基)苯胺(SO)和海萤荧光素类似物(CLAs),已被用作余辉底物来制备多组分有机余辉纳米制剂。此外,二氢卟吩和卟啉衍生物可作为自持型余辉分子,简化了探针设计并增强了探针性能。此外,亚甲蓝衍生物表现出超高的激活比率;四苯基卟啉(TPP)和N,N-二甲基-4-(3-苯基-5,6-二氢-1,4-二氧杂环己-2-基)苯胺(DO)的共价偶联实现了高亮度;而三蒽衍生物则具有高灵敏度。除了光之外,临床上使用且能深入组织的超声波和X射线也可用作产生余辉的激发源。这些方式分别被称为声控余辉和放疗余辉。特别是,放疗余辉可以通过放射动力学ROS产生或放射发光诱导的光敏剂激发途径产生,为设计放疗余辉系统提供了框架。有机余辉制剂已被探索用于多种应用,包括肿瘤成像、器官损伤诊断、免疫反应监测以及精准的疾病诊疗,它们通过不同的光物理过程以及特定的探针设计和优化来发挥作用。
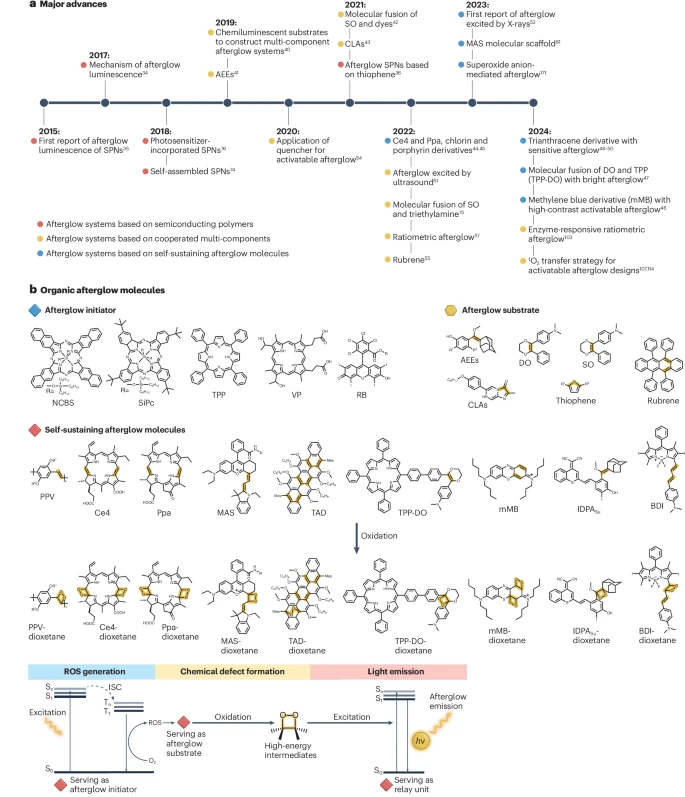
图2:有机余辉材料。
a, 有机余辉成像主要进展的时间线。 b, 余辉引发剂在辐照下产生活性氧(ROS)以触发余辉过程。余辉底物与ROS反应形成高能中间体以储存能量。自持型余辉分子可以独立维持整个余辉发光过程,包括ROS的产生、化学缺陷的形成和发光。AEEs, 金刚烷叉烯醇醚;BDI, 硼二吡咯甲川衍生物;Ce4, 二氢卟吩e4;CLAs, 海萤荧光素类似物;DO, N,N-二甲基-4-(3-苯基-5,6-二氢-1,4-二氧杂环己-2-基)苯胺;IDPASu, 含碘的二氰亚甲基-4H-苯并噻喃-苯氧基金刚烷;ISC, 系间窜越;MAS, 分子余辉支架;mMB, 3,7-双-(二丁氨基)-吩噻嗪-5-鎓盐;NCBS, 硅2,3-萘花青双(三己基甲硅烷氧基);Ppa, 焦脱镁叶绿酸-a;PPV, 聚对苯撑乙烯;RB, 玫瑰红;SiPc, 硅酞菁;SO, N,N-二甲基-4-(2-苯基-5,6-二氢-1,4-氧硫杂环己-3-基)苯胺;SPNs, 半导体聚合物纳米粒子;TAD, 三蒽衍生物;TPP, 四苯基卟啉;TPP-DO, TPP和DO的共价偶联物;VP, 维替泊芬。
在这篇综述中,我们首先讨论有机余辉发光的机理,然后概述提高其性能和特异性的方法。此外,我们重点介绍有机余辉探针在疾病诊断和治疗中的应用。最后,我们总结了当前的局限性并探讨了有机余辉探针的转化考量。
余辉发光
不同类型的余辉发光,包括基于无机纳米晶体的长余辉、室温磷光、热活化延迟荧光、有机长余辉以及基于化学激发的有机余辉发光,可以根据其各自的特性应用于各种场景。磷光是一种光物理过程,其中电子从基态(S0)被激发到单重态(S1),然后通过系间窜越到达三重态(T1),最终通过辐射跃迁返回S0(图1c)。如果T1激子通过反向系间窜越返回S1态,随后从S1到S0发生辐射跃迁,这种现象被称为热活化延迟荧光。这两个过程都涉及自旋禁阻跃迁,其跃迁速率较慢,导致辐照停止后出现延迟发光。由于其高亮度,磷光和热活化延迟荧光可应用于信息加密和防伪。然而,它们的寿命很短(从微秒到毫秒),导致成像时间窗口短,限制了其在生物医学应用中的适用性。
有机长余辉材料通常在单个体系中包含供体和受体分子(图1c),它们需要精确协作。激发后,受体部分的最高占据分子轨道(HOMO)上的电荷转移到其最低未占分子轨道(LUMO)。由于供体和受体部分之间的能级匹配,会发生从供体HOMO到受体HOMO的分子间电荷转移,从而形成自由基阴离子和自由基阳离子。随后,自由基阴离子扩散,形成电荷分离态。自由基阴离子和阳离子的逐渐复合产生激基复合物发射。然而,自由基阴离子和阳离子在水或氧气存在下不稳定,这使其在信息存储和柔性显示方面有潜力,但在生物成像方面具有挑战性。
长余辉纳米晶体,如ZnGa₂O₄:Cr³⁺和SrMgSi₂O₆:Eu²⁺/Dy³⁺,通常由过渡金属离子或镧系离子组成。在外部源(如光或X射线)激发下,纳米晶体中掺杂的激活剂被激活,导致电子跃迁到与导带重叠的更高能级,然后扩散到电子陷阱中(即陷阱过程)。浅陷阱中的电子可以转移回来并被激活剂捕获,从而产生余辉发光(即去陷阱过程)(图1c)。去陷阱速率通常很慢,因此发光可以持续数小时或数天;然而,亮度较低。这些材料具有高光稳定性和长发射波长的优点,并被用于各种生物应用,包括肿瘤成像和影像引导治疗。然而,它们的制备通常需要高温(数百或数千摄氏度),其修饰复杂,并且可能具有毒性。
有机余辉探针
机理
有机余辉发光涉及三个关键过程:ROS的产生、化学缺陷的形成以及光的发射,其中可能包含一个或多个能量转移过程(图1c)。因此,有机余辉制剂需要多个单元的协同作用,包括余辉引发剂、余辉底物和中继单元,它们通常与两亲性聚合物,如聚(乙二醇)-嵌段-聚(丙二醇)-嵌段-聚(乙二醇) (PEG-b-PPG-b-PEG),共组装形成纳米粒子。在辐照下(例如,通过光、超声或X射线),余辉引发剂吸收能量达到S1态,然后通过系间窜越到达T1态。能量通过能量转移(例如,II型途径)或电子转移(例如,I型途径)传递给周围的氧气(³O₂),具体取决于引发剂的性质,从而产生活性氧,如¹O₂或超氧阴离子(O₂•⁻)。余辉底物随后被ROS氧化,形成高能中间体(主要是1,2-二氧杂环丁烷),作为化学缺陷并且不稳定。随后,高能中间体逐渐分解,释放能量,导致形成激发态的底物,该底物可以直接发光或将能量转移给中继单元,实现拓展波长的余辉发射。考虑到这个级联过程,余辉性能受到多种因素的影响,包括余辉引发剂的ROS产率、余辉底物的反应活性、高能中间体的分解速率、化学激发效率(将高能中间体转化为电子激发能的效率)、向中继单元的能量转移效率以及发光单元的荧光量子产率。
材料与设计原则
有机余辉制剂被设计成具有不同功能,包括余辉引发剂、余辉底物和集所有功能于一体的自持型余辉分子(表1和图2b)。光敏剂可作为余辉引发剂,负责在激发时产生ROS。为了实现高光敏能力和高ROS产率,光敏剂通常具有小的单重态-三重态能隙(ΔEST)、高效的系间窜越和长的三重态寿命。在有机余辉体系中用作余辉引发剂的光敏剂包括酞菁衍生物(如硅2,3-萘花青双(三己基甲硅烷氧基) (NCBS)、硅酞菁)、卟啉衍生物(如TPP、维替泊芬)和玫瑰红。此外,可激活的光敏剂和具有聚集诱导发光特性的光敏剂也已被探索。
表1 用于生物医学应用的余辉探针
| Material | Excitation | Brightness (p/s/sr/cm2) | λem (nm) | _D_p (cm) | _t_1/2 (min) | Biomarker (mechanism) | Optimization strategy (outcomes) | Applications | Imaging signal-to-background ratio | Refs. |
|---|---|---|---|---|---|---|---|---|---|---|
| Poly(p-phenylenevinylene) analogues | ||||||||||
| SPN-NCBS, SPN-thiol (activatable) | 808 nm laser | 2.2 × 107 (12.5 μg/ml) | 780 | 4 | 6.6 | Biothiol (energy transfer) | Screening and co-assembly (brightness: 75 times enhancement; wavelength: from 580 to 780 nm) | Xenograft tumour imaging, lymph node mapping and hepatotoxicity imaging | 419 (s.c./12.5 μg) | 34 |
| SPN2.5 | White light | 1.5 × 106 (100 μg/ml) | 720 | NR | 5 | None | Molecular engineering (brightness: 6.12 times enhancement; wavelength: from 580 to 720 nm) | Peritoneal metastatic tumour imaging | 27.6 (i.v./80 μg) | 76 |
| SPPVN | 808 nm laser | 1.75 × 107 (130 μg/ml) | 780 | NR | 4.8 | None | Co-assembly (NR) | Peritoneal metastatic tumour imaging | 4,170 (s.c./6.5 μg) | 74 |
| SPNCT | White light | 6 × 104 (10 μg/ml) | 600 | 3 | 4.5 | None | NR | Guided photothermal therapy | 154 (i.v./40 μg) | 38 |
| ASPN, ASPNC (activatable) | White light | NR | 680 | NR | NR | Exosomes (energy transfer) | Molecular engineering (NR) | Differentiation of exosomes | NR | 39 |
| F12+-ANP-Gal | 808 nm laser | NR | 780 | 4 | 6.6 | H2S (energy transfer) | Co-assembly (NR) | Orthotopic liver tumour imaging | 124.5 (i.v./20 μg) | 54 |
| RAN1 | 660 nm laser | NR | 830/600 | 0.6 | NR | NO (ICT) | Co-assembly (NR) | Immune response imaging | 140 (i.v./100 μg) | 57 |
| F1-GdNP | 808 nm laser | NR | 780 | NR | NR | H2S (energy transfer) | Co-assembly (NR) | Acute hepatitis imaging | 41.4 (i.v./168 μg) | 102 |
| ALCNs | 808 nm laser | 4.5 × 106 (20 μg/ml) | 780 | NR | 2 | pH (1O2 transfer) | NR | Orthotopic liver tumour imaging | 220 (i.v./4 mg/kg) | 114 |
| Adamantylidene enol ethers | ||||||||||
| AGL AIE NPs | White light | 1.08 × 107 (100 μM) | 620 | 0.7 | 48 | None | Co-assembly (brightness: 3.2 times enhancement) | Peritoneal metastatic tumour imaging | NR | 41 |
| APtN | 808 nm laser | 1.35 × 106 (1 mg/ml) | 560 | NR | 16 | H2O2 (ICT) | Co-assembly (NR) | Drug tracking | NR | 94 |
| FDAG-1 | 635 nm laser | NR | 600 | NR | 2.83 | None | NR | Blood detection | NR | 147 |
| PA-AGL NPs | White light | 1.18 × 109 (150 μg/ml) | 630 | 1 | NR | ONOO− (ICT) | Co-assembly (brightness: 4.6 times enhancement) | Inflammatory process imaging | 461.3 (s.c./30 μg) | 56 |
| AIE/B-AGL-HCPT NPs | White light | NR | 670 | NR | 118.5 | ONOO− (ICT) | Co-assembly (NR) | Drug tacking | NR | 144 |
| NCBS/DPAs SNAP, SNAP-M (activatable) | Ultrasound | 5.8 × 106 (20 μg/ml) | 780 | 4 | 1.83 | ONOO− (ICT) | Screening | M1 macrophage imaging | 72.2 (i.v./50 μg) | 51 |
| SCAN | Ultrasound | 3.0 × 107 (47 μg/ml) | 500 | NR | NR | ONOO− (molecular structural changes) | NR | Guided sonodynamic therapy | NR | 51 |
| Q-SNAP | Ultrasound | 2.0 × 106 (10 μg/ml) | 780 | 4 | 1.5 | Granzyme B (ICT) | Co-assembly (NR) | T cell imaging | 58.3 (i.v./2 mg/kg) | 100 |
| RAG-RGD | 690 nm laser | NR | 710/520 | 2 | NR | Matrix metalloproteinase 2 (energy transfer) | Co-assembly (NR) | Orthotopic glioma imaging | 91 (i.v./599 μM, 200 μl) | 103 |
| BAAP | 808 nm laser | NR | 640 | NR | NR | Cathepsin B and granzyme B (ICT and 1O2 transfer) | Screening | Differentiation of tumour from inflammation | 19 (intratracheal injection/100 μM, 200 μl) | 107 |
| tRANP | X-rays | NR | 780 | 5 | 4.8 | H2O2 (ICT) | Screening | Guided radiodynamic therapy | 207 (i.v./25 μg) | 53 |
| N,N****-dimethyl-4-(2-phenyl-5,6-dihydro-1,4-oxathiin-3-yl)aniline and N,N****-dimethyl-4-(3-phenyl-5,6-dihydro-1,4-dioxin-2-yl)aniline | ||||||||||
| AGNPs | 680 nm laser | NR | 450 | NR | 0.04 | None | Molecular engineering (brightness: 162 times enhancement) | Lateral flow immunoassay | NR | 75 |
| UCANPs@RAW | 730 nm laser | NR | 620 | NR | 0.33 | None | Co-assembly (NR) | Joint and brain inflammation imaging | 382 (i.v./2 × 106 cells) | 178 |
| LiAGNPs | White light | NR | 630 | NR | NR | None | Co-assembly (NR) | Lateral flow immunoassay | NR | 145 |
| PDCD10, CATP (activatable) | 660 nm laser | 7.2 × 106 (1 μg/ml) | 770 | 4 | 0.097 | Cathepsin B (energy transfer) | Screening and molecular engineering (NR) | Guided photodynamic therapy | 257.8 (i.v./70 μg) | 179 |
| AG@PS | 730 nm laser | NR | 614 | NR | 0.01 | None | Molecular engineering (brightness: 550 times enhancement) | Lymph node mapping and lateral flow immunoassay | 607 (s.c./15 μg) | 180 |
| Cypridina luciferin analogues | ||||||||||
| CLA-N-Ts | 808 nm laser | 2.3 × 106 (30 μg/ml) | 780 | NR | 1 | None | Co-assembly (NR) | Guided photodynamic therapy | 17 (i.v./30 μg) | 43 |
| Thiophene | ||||||||||
| PFODBT@CPPO | White light | 7.0 × 106 (500 μg/ml) | 700 | NR | NR | None | Screening | Guided photodynamic therapy | 48 (i.v./500 μg) | 36 |
| SPN(NIR-3) | 660 nm laser | 9.0 × 105 (800 μg/ml) | 800 | 2 | 0.86 | None | Screening | Guided photodynamic therapy | 160 (s.c./50 μg) | 37 |
| Rubrene | ||||||||||
| MANS | 488 nm LED | NR | 560 | NR | NR | O2•− (energy transfer) | Co-assembly (NR) | Kidney injury imaging | NR | 55 |
| Self-sustaining afterglow molecules | ||||||||||
| NPs-Ce4 | White light | 1.4 × 106 (50 μM) | 660 | NR | 90 | None | Screening | Peritoneal metastatic tumour imaging | NR | 44 |
| Ppa-FFGYSA | 660 nm laser | 1.3 × 106 (500 μM) | 750 | 1 | NR | None | Screening | Peritoneal metastatic tumour imaging | 215.1 (i.v./500 μM, 200 μl) | 45 |
| RAN | 660 nm laser | 1.6 × 106 (500 μg/ml) | 750 | NR | NR | pH (molecular structural changes) | NR | Glycolysis visualization | NR | 81 |
| HD-Br, MAP-O2•− (activatable) and MAP-LAP (activatable) | 660 nm laser | NR | 721 | NR | 1 | O2•− or leucine aminopeptidase (ICT) | Screening | Hepatotoxicity imaging | 53 (s.c./1.25 μg) | 172 |
| Cy5-NF | 660 nm laser | NR | NR | NR | NR | None | Screening | Kidney injury imaging | 12 (i.v./1 mM, 50 μl) | 171 |
| IDPASu, MRAP (activatable) | X-rays | 2.0 × 106 (10 μg/ml) | 770 | 5 | 18.4 | Cathepsin B (ICT) | Screening | Guided radiodynamic therapy | NR | 52 |
| TAD-NPs, TAD-BHQ (activatable) | White light | NR | 640 | 6 | 16 | Granzyme B (energy transfer) | Screening | Tumour imaging, carotid plaque imaging, image-guided photodynamic therapy, immune activation in chemotherapy, radiotherapy and immune-checkpoint blockade therapy | 70 (i.v./160 μg) | 48,50 |
| TAD-NPs, TAD-BHQ (activatable) | Ultrasound | NR | 640 | 2.2 | 3 | Granzyme B (energy transfer) | Screening | Tumour imaging, lymph node mapping and immune response imaging | NR | 49 |
| TPP-DO NPs, Q-TPP-DO NPs (activatable) | White light | 4.0 × 108 (25 μM) | 655 | 6 | 2 | Glutathione (energy transfer) | Molecular engineering (brightness: 56 times enhancement) | Peritoneal metastatic tumour imaging | 3600 (i.v./40 μg) | 47 |
| SAN-M, SAN-MO (activatable) | 660 nm laser | 2.1 × 107 (75 μM) | 680 | 5 | 4 | ONOO− (molecular structural changes) | NR | Inflammatory processes and peritoneal metastatic tumour imaging | 267.4 (i.v./10 μg) | 46 |
| TAD NPs, APE1 probe (activatable) | White light | NR | 640 | NR | 15 | APE1 (energy transfer) | NR | APE1 activity imaging in tumour radiotherapy and radiation-induced liver injury | 55 (i.v./9.6 μg) | 104 |
| BDI NPs, BDIS NPs (activatable) | 660 nm laser | 2.0 × 106 (100 μM) | 780 | 4 | 1.5 | H2S (energy transfer) | Screening | Acute lung injury imaging and H2S level visualization of schizophrenia in mice | 80.1 (i.v./10 μg) | 95 |
余辉底物的功能类似于电池,需要能够被ROS氧化形成过氧化物中间体来储存化学能的材料。已经设计了多种余辉底物,包括AEEs、SO、DO、CLAs、噻吩和红荧烯。AEEs的优点在于其结构多样性,并且通常表现出可以持续数小时至数天的发光。DO和SO具有高效的化学发光能力,可以与光敏剂偶联,其余辉强度可达到与荧光相当的水平。CLAs可以与NCBS(II型光敏剂)协同实现余辉发光。然而,它们在被ROS(特别是O₂•⁻)氧化时发光的能力表明,它们可以作为基于电子转移的I型余辉体系的底物。噻吩通常用作半导体聚合物中的余辉底物单元。红荧烯也作为余辉底物进行了研究,但强度较弱。
余辉性能,如余辉亮度和半衰期,受余辉底物的可氧化性、所得过氧化物的分解速率和化学激发效率的影响,这些都与化学激发过程中的氧化和分解步骤有关。高能过氧化物(主要是1,2-二氧杂环丁烷)通常通过光敏化和随后余辉底物或余辉分子中双键的π2–π2环加成氧化产生(图2b)。双键转化为1,2-二氧杂环丁烷的效率与余辉底物的可氧化性密切相关,这可以从其HOMO能级或能垒推断。例如,二氢卟吩的可氧化性与其HOMO能级相关,这有助于其高余辉亮度。底物的氧化伴随着其结构降解和吸收减少。因此,通过测量光辐照后吸收的减少,可以评估双键转化为1,2-二氧杂环丁烷的效率。例如,3,7-双-(二丁氨基)-吩噻嗪-5-鎓盐 (mMB) 和二氢卟吩e4 (Ce4) 在每次光辐照后的转化效率估计分别约为1%和2%。
除了余辉底物的可氧化性,余辉性能还受1,2-二氧杂环丁烷稳定性的影响;在每次辐照中,对于相同量的二氧杂环丁烷中间体,稳定性越低,分解速率越高,导致余辉更亮但发射寿命更短。相反,稳定性越高,发光越暗但持续时间更长。例如,AEEs的苯氧基-1,2-二氧杂环丁烷环中O-O键的分解速率是化学激发过程中的速率决定步骤。苯氧基-1,2-二氧杂环丁烷环的稳定性可能受环张力、空间位阻和电负性的影响。或者,可以通过理论计算(例如,通过计算吉布斯自由能)来确定裂解途径中物质的热力学稳定性。
化学激发效率,即将高能中间体转化为电子激发能的效率,决定了余辉的亮度。1,2-二氧杂环丁烷分解释放的能量通过非辐射跃迁或光子发射耗散。已经提出了两种主要机制来解释1,2-二氧杂环丁烷的高效发光:化学引发的电子交换发光和电荷转移诱导的发光。这两种机制在分解过程上有所不同,取决于它是否涉及完全的电子转移或部分电荷转移。然而,它们都产生具有高效发光的电子激发单重态。通过在AEEs中酚的邻位引入吸电子基团,可以增强化学引发的电子交换发光,从而通过结构调整来提高化学激发效率以增强余辉发光强度。例如,丙烯腈可以将1,2-二氧杂环丁烷的发光效率提高数千倍。因此,理想的余辉底物应设计为具有高可氧化性、所得过氧化物的适当稳定性以及高化学激发效率以产生辐射物种。
中继单元应具有与余辉底物发射相匹配的吸收谱,并与激发的余辉底物碎片保持近距离(通常在10 nm内),以促进高效的分子间能量转移。中继单元的高共振能量转移效率和量子产率可以提高余辉亮度。荧光材料,如半导体聚合物、小分子染料和量子点,已被探索作为中继单元。此外,余辉引发剂也可以作为中继单元来拓展余辉发射波长。
结合了光敏能力、化学缺陷形成和余辉产生的分子或聚合物能够实现自持型余辉发光。例如,聚对苯撑乙烯衍生物是自持型余辉聚合物,但由于其光敏能力较差,通常表现出可见光范围内的低强度余辉发光。因此,它们需要掺杂光敏剂以放大近红外(NIR)余辉。此外,还设计了各种其他自持型余辉分子,如二氢卟吩e4、焦脱镁叶绿酸-a、三蒽衍生物和mMB。
优化余辉性能
有机余辉发光具有高灵敏度、高信噪比和深层组织穿透的优点。然而,余辉试剂通常在可见光区域(400–650 nm)发光,与长波长光(如近红外光)相比,会引起更多的光散射。此外,多组分余辉试剂需要在纳米粒子内进行级联中继过程,导致能量损失,因此强度比自持型余辉系统弱。具有高强度的红移余辉可能会提高成像质量,包括成像灵敏度和穿透深度。此外,用于疾病检测的“始终开启”型余辉探针通常通过累积发挥作用,这限制了成像的特异性和保真度。生物标志物可激活的余辉探针可能会提高成像的特异性,并扩大余辉成像的应用范围。最后,可见光和近红外光的穿透深度有限,因此不能有效激发深层组织中的余辉材料。因此,应探索允许深层组织穿透的辐照源。
余辉发光的信号亮度直接决定了成像质量,包括灵敏度、信噪比和穿透深度。余辉引发剂、余辉底物和中继单元,以及它们的能量转移过程,都影响余辉亮度。除了筛选材料外,还探索了共组装和分子工程等方法,通过提高ROS生成效率、能量转移效率和能量利用效率来提高信号亮度(图3a)。
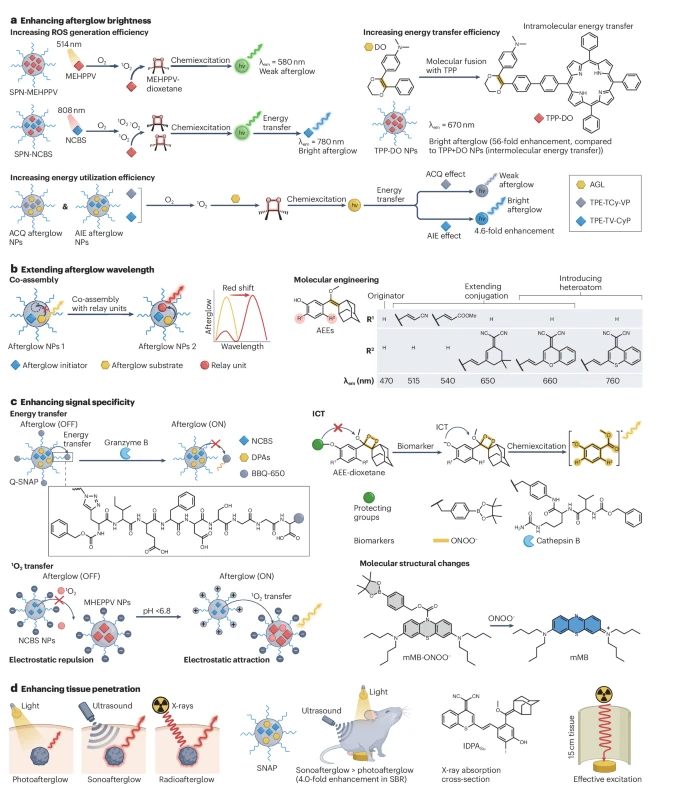 图3:有机余辉探针的优化。
图3:有机余辉探针的优化。
a, 余辉亮度可以通过提高活性氧(ROS)生成效率、能量转移效率和能量利用效率来改善。通过将余辉材料与光敏剂共组装可以提高ROS的生成。通过分子融合将分子间能量转移转化为分子内能量转移,可以提高能量转移效率。通过引入聚集诱导发光(AIE)分子避免猝灭,可以提高能量利用效率。 b, 余辉波长可以通过共组装和分子工程来拓展。与中继单元共组装可以使余辉波长红移。金刚烷叉烯醇醚(AEEs)可以通过工程改造来改变其发射波长。 c, 信号特异性可以通过能量转移、分子内电荷转移(ICT)、¹O₂转移和分子结构改变来增强。在基于能量转移的可激活余辉体系中,能量在余辉分子和猝灭剂之间发生转移。当猝灭剂被移除后,余辉被开启。基于ICT的可激活余辉底物仅在保护基团不存在时才表现出余辉。基于¹O₂转移的可激活余辉体系仅在¹O₂被转移时才表现出余辉。通过在激活和非激活状态之间引入结构差异,可以实现特定的激活比率。 d, 可以使用长波长光、超声波或X射线作为激发源来增加组织穿透深度。λem, 最大余辉发射波长;ACQ, 聚集导致猝灭;AGL, 苯基硼酸酯取代的AEEs;BBQ-650, Blackberry猝灭剂650;DPA, 二氰亚甲基-4H-苯并噻喃-苯氧基金刚烷;SPN-MEHPPV, 基于MEHPPV的半导体聚合物纳米粒子;SPN-NCBS, 基于MEHPPV和NCBS的半导体聚合物纳米粒子;TPE-TCy-VP, 具有ACQ的含四苯乙烯的异构荧光团;TPE-TV-CyP, 具有AIE的含四苯乙烯的异构荧光团;TPP + DO NPs, 基于TPP和DO物理混合的纳米粒子。
通过提高¹O₂的生成效率可以增强余辉信号,因为¹O₂参与形成高能过氧化物,这在余辉生成中起着至关重要的作用。例如,为了增加MEHPPV的余辉强度,MEHPPV通常亮度低且发射波长短(580 nm),给生物医学应用带来挑战,可以将其与光敏剂NCBS在PEG-b-PPG-b-PEG的帮助下共组装,得到半导体聚合物纳米粒子(SPN)-NCBS纳米粒子。在SPN-NCBS纳米粒子中,NCBS作为高效的余辉引发剂,放大¹O₂的生成,从而在808 nm辐照后实现75倍的信号增强,相对于在相同功率密度下用514 nm预辐照的SPN-MEHPPV(图3a)。该策略也可应用于其他余辉体系,如掺入光敏剂的共聚物和自组装的两亲性聚对苯撑乙烯衍生物。
通过分子融合可以提高多组分余辉体系中的能量转移效率。在多组分体系中,光从中继单元发射,因为余辉底物的发射波长较短,这需要余辉底物和中继单元之间的分子间能量转移。然而,分子间能量转移需要能量供体和受体(即余辉底物和中继单元)之间非常接近,并且供体的发射与受体的吸收相匹配,这会导致能量损失。为了提高能量转移效率,可以将余辉引发剂、中继单元和余辉底物融合在一起。例如,TPP作为余辉引发剂和中继单元,DO作为余辉底物,可以共价连接形成TPP-DO(图3a),由于分子内能量转移效率高以及TPP的¹O₂产率高,从而产生高亮度的近红外余辉发光。与由TPP和DO共组装的纳米粒子相比,通过两种分子融合获得的纳米粒子的亮度增加了56倍,达到10⁸ p/s/sr/cm²。类似的余辉底物和中继单元之间的分子融合策略也可以提高余辉亮度。
通过提高能量利用效率可以进一步增强余辉亮度。例如,用作纳米粒子内中继单元的荧光团或光敏剂在高浓度下通常会发生聚集导致猝灭,从而降低能量利用效率。虽然可以降低纳米粒子中荧光团的浓度,但这一过程耗时,并可能导致在使用光敏剂作为中继荧光团的体系中光敏化不足。或者,聚集诱导发光材料在分散状态下发光很弱或不发光。然而,在聚集体形式下,其分子内旋转和振动受限,促进了辐射衰减,从而产生明亮的发光和/或ROS生成。例如,两种含四苯乙烯的异构荧光团,即具有聚集诱导发光的含四苯乙烯的异构荧光团(TPE-TV-CyP)和具有聚集导致猝灭的含四苯乙烯的异构荧光团(TPE-TCy-VP),可以作为具有相似¹O₂生成效率的双功能余辉引发剂和中继单元;然而,TPE-TCy-VP会发生聚集导致猝灭,而TPE-TV-CyP则表现出聚集诱导发光荧光。因此,TPE-TV-CyP共掺杂的含有苯基硼酸酯取代的AEEs(AGL)的纳米粒子,被称为聚集诱导发光余辉纳米粒子,在被过氧亚硝酸盐(ONOO⁻)激活释放游离AEEs后,亮度比与AGL共掺杂的TPE-TCy-VP纳米粒子(聚集导致猝灭余辉纳米粒子)增加了4.6倍(图3a)。聚集诱导发光材料已被验证可作为各种余辉体系中的余辉引发剂或中继单元。
拓展余辉波长
使用长发射波长可以减少光散射,从而提高灵敏度并实现深层组织成像。可以通过将有机余辉体系与中继单元共组装或通过分子工程来使波长红移(图3b)。共组装要求两个组分紧密接触,并且它们的发射和吸收光谱重叠。例如,NCBS不仅作为余辉引发剂,还作为中继单元。因此,对于SPN-NCBS,MEHPPV、NCBS和PEG-b-PPG-b-PEG的共组装导致余辉发射从580 nm红移到780 nm。同样,含有玫瑰红作为余辉引发剂和DO作为余辉底物的余辉探针可以与不同的中继单元共组装,以调节发射波长以匹配中继单元的荧光波长(图3b)。
余辉分子也可以通过分子工程进行改造以红移余辉发光。例如,AEEs的发射波长为470 nm,但可以通过与丙烯腈、丙烯酸甲酯、2-(3,5,5-三甲基环己-2-烯-1-亚基)丙二腈或二氰基-甲基色酮共轭而移至近红外区(图3b)。此外,二氰基-甲基色酮中的氧原子可以被硫原子取代,通过增加原子半径和改变电负性来缩小带隙,从而将发射波长从660 nm拓展到760 nm。
增强信号特异性
可激活的余辉探针消除了非特异性分布探针的干扰,提高了信号特异性。通过设计能量转移、分子内电荷转移、¹O₂转移或分子结构,可以使余辉探针具有可激活性(图3c)。
能量转移是能量供体和受体之间在近距离下的物理相互作用。通过能量转移构建可激活的余辉探针通常需要一个与余辉组分共组装的猝灭剂。例如,Blackberry猝灭剂650(BBQ-650)在550 nm至750 nm范围内有很强的吸收谱,可以通过一个可被颗粒酶B特异性切割的肽底物连接到纳米粒子表面(图3c)。通过将BBQ-650置于余辉组分附近,余辉通过能量转移被猝灭。一旦肽被颗粒酶B切割,BBQ-650被释放,终止能量转移过程并激活余辉。类似的策略可用于检测H₂S、生物硫醇、基质金属蛋白酶2和脱嘌呤/脱嘧啶核酸内切酶1(APE1)等生物标志物。此外,通过合理调节由中继单元发射的生物标志物响应性余辉信号,并结合由余辉底物发射的惰性余辉信号,可以实现比率型余辉,用于检测与疾病相关的生物标志物。
分子内电荷转移是在电子供体和受体基团之间直接(即D-A)或通过π电子桥(即D-π-A)的分子共轭过程中发生的光化学过程,其中光激发导致电子从供体转移到受体。通过将生物标志物特异性部分共轭到供体或受体上,可以破坏分子内电荷转移,从而创建可激活的光学探针。例如,AEEs被¹O₂氧化形成苯氧基-1,2-二氧杂环丁烷,当邻位被保护时,它们是稳定且不发光的(图3c)。然而,当保护基被特定生物标志物移除时,去质子化的酚取代基作为给电子基团,导致快速分解并产生发光。基于这一策略,可以设计出对ONOO⁻和组织蛋白酶B(CatB)有响应的余辉探针。这是一种通用的方法,通过替换保护基团并利用邻位取代的苯氧基金刚烷基-1,2-二氧杂环丁烷,可以创建对各种生物标志物有响应的余辉探针。
余辉材料也可以通过¹O₂转移实现可激活性。能量转移通常要求供体和受体之间的距离小于10 nm。相比之下,¹O₂在水溶液中可以传播高达200 nm,因此可以利用¹O₂转移进行激活。例如,一个混合纳米系统,包括作为¹O₂供体的余辉引发剂纳米粒子和作为¹O₂受体的余辉底物纳米粒子,两者都带有负电荷(图3c),可以设计成供体和受体之间的距离因静电排斥而阻止¹O₂转移。然而,在酸性微环境(pH < 6.8)中激活后,余辉底物纳米粒子的电荷反转,使得供体和受体之间能够产生静电吸引,从而缩短它们之间的距离。这使得¹O₂能够从供体转移到受体,从而实现可激活的余辉发光。利用长距离的¹O₂转移,一个双酶锁定的可激活余辉探针,通过长链连接一个可激活的引发剂和一个可激活的余辉底物,实现了双酶锁定的余辉。由于双酶锁定设计提供的高特异性,该系统能够以高灵敏度和特异性追踪肿瘤浸润的细胞毒性T细胞,并区分肿瘤与小鼠的局部炎症。
有机余辉材料的分子结构在激活前后可以改变,从而改变其光学性质。例如,mMB不仅提供自持型余辉发光,还可以以类似于亚甲蓝的方式被激活(图3c)。例如,mMB的中心共轭结构可以在其吩噻嗪环上用一个ONOO⁻响应基团(例如,苯基硼酸酯)进行修饰,使其能被ONOO⁻破坏,导致响应基团的移除和吸收、荧光、ROS生成以及余辉信号的恢复。结果,观察到激活比率高达4,523的余辉信号。类似地,一个基于半花菁和罗丹明染料融合的余辉分子支架,允许可激活的吸收、荧光、ROS生成和余辉信号。在这里,激活是通过罗丹明染料的螺环化实现的,从而能够响应pH、Al³⁺、Cu²⁺和三磷酸腺苷。
增强组织穿透深度
有机余辉发光依赖于将预辐照的外部激发转化为可储存的化学缺陷,这些缺陷以光的形式衰减。因此,外部源的穿透深度对于确保照亮深部位的余辉材料至关重要(图3d)。光是机余辉成像中常用的激发源,但其组织穿透深度有限。或者,与光相比,可以更深地穿透组织的超声波和X射线,可以分别用作声控余辉和放疗余辉成像的激发源。
超声波是一种频率高于人类听觉范围(>20 kHz)的周期性振动机械波。超声波可以深入生物组织,并且由于其无创性和安全性,通常在临床环境中使用。超声激发下产生ROS的机理尚未完全阐明,但可能包括声致发光诱导的光敏剂激发和超声诱导的压电催化。声致发光是由声场中气泡空化期间等离子体的产生引发的。这种光发射比声控余辉弱且寿命短,因此不适合直接用于生物成像。然而,产生的光可以被光敏剂吸收以引发余辉发光。超声波还可以在压电材料中引起极化,产生一个内源性电场,分离电子和空穴。分离的电荷可以参与水溶液中的氧化和还原反应,导致ROS的产生并触发余辉级联。例如,以声敏剂NCBS作为余辉引发剂的纳米粒子在近红外范围内实现了高强度的余辉发光;在这里,光和超声波作为激发源来激活被小鼠身体覆盖的纳米粒子,其信噪比是光控余辉的四倍。一些自持型余辉材料,如三蒽衍生物和mMB,也可以被超声波激发。
X射线是临床使用的高能电磁波,可以深入组织。X射线诱导的余辉发光可以通过放射动力学ROS产生或放射发光诱导的光敏剂激发实现。在放射动力学ROS产生中,余辉材料被X射线激发,通过康普顿散射和光电效应产生高能电子。这些电子可以与周围原子发生热化,产生电子-空穴对,根据自旋守恒导致三重态激子的形成。三重态激子将能量转移给周围的氧气以产生ROS。有机材料通常具有小的X射线吸收截面,因此需要引入重原子,如碘,以实现放疗余辉。例如,放疗余辉分子含碘的二氰亚甲基-4H-苯并噻喃-苯氧基金刚烷(IDPASu)在仅5 mGy的剂量下可以实现亮度约为2.1 × 10⁶ p/s/sr/cm²的余辉发光。重要的是,材料可以在15 cm的组织深度被激发,这是光无法实现的。在放射发光诱导的光敏剂激发中,闪烁体吸收X射线并将能量转化为光,然后激活光敏剂以启动余辉发光的级联。该策略也允许在深层组织(高达15 cm)中产生余辉发光。
有机余辉探针的生物医学应用
病变通常以异常的生理特性为特征,这可以被利用于余辉探针的积累和/或其被疾病相关生物标志物激活以进行生物医学成像(表1)。此外,与余辉发光相关的ROS生成可用于治疗。
生物医学成像
癌症
早期诊断极大地有益于癌症的治疗和生存。纳米粒子由于增强的渗透性和滞留效应和/或主动转运和滞留效应而在肿瘤部位积聚,这可用于余辉发光。例如,基于三蒽衍生物纳米粒子的余辉探针可以准确地可视化一系列肿瘤,包括异种移植肿瘤、原位胶质瘤、原位胰腺肿瘤以及可能的小鼠其他类型肿瘤(图4a)。三蒽衍生物纳米粒子的高灵敏度允许通过手电筒或室内光照射来实现余辉发光和肿瘤可视化。此外,余辉发光信号可以在15次光照射循环后保持。二氢卟吩e4纳米粒子和ONOO⁻可激活的含四苯乙烯的余辉纳米粒子显示出比三蒽衍生物纳米粒子更长的半衰期(即数小时),并且可以在注射前在体外进行照明,从而无需重复预辐照即可进行体内肿瘤成像。通过这种方法,可以解决外部激发的穿透深度限制。例如,二氢卟吩e4纳米粒子可用于成像腹膜转移性肿瘤和健康组织之间的边界,以指导小鼠的手术切除。
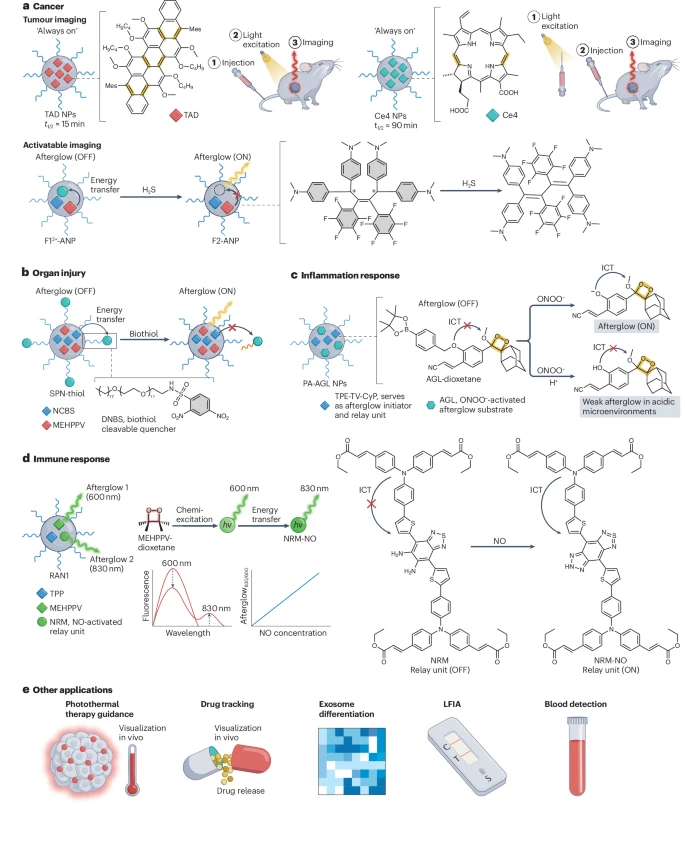 图4:有机余辉发光成像的应用。
图4:有机余辉发光成像的应用。
a, 肿瘤成像可以通过基于三蒽衍生物(TAD)的纳米粒子(NPs)实现,这些纳米粒子能够进行原位激发的余辉成像。二氢卟吩e4(Ce4)NPs允许体外预激发的余辉成像。H₂S响应性余辉探针允许对肝脏肿瘤进行可激活成像。 b, 生物硫醇激活的余辉NPs可通过检测肝脏生物硫醇水平应用于肝损伤成像。 c, 过氧亚硝酸盐(ONOO⁻)激活的余辉(PA-AGL)NPs可通过检测微环境中的ONOO⁻和pH水平用于炎症反应成像。 d, NO激活的比率型余辉纳米粒子(RAN1)可通过检测微环境中的NO水平实现免疫反应成像。 e, 余辉成像还可应用于光热治疗指导、药物追踪、外泌体区分、侧向流免疫分析(LFIA)和血液检测。AGL, 苯基硼酸酯取代的金刚烷叉烯醇醚;DNBS, 2,4-二硝基苯磺酰基;F12+-ANP, 含猝灭剂的余辉纳米粒子;F2-ANP, 激活后的F12+-ANP;ICT, 分子内电荷转移;MEHPPV, 聚(2-甲氧基-5-(2-乙基己氧基)-1,4-苯撑乙烯);NCBS, 硅2,3-萘花青双(三己基甲硅烷氧基);NRM, NO激活的中继单元;NRM-NO, NRM在NO刺激后的激活形式;SPN-thiol, 生物硫醇激活的半导体聚合物纳米粒子;t1/2, 半衰期;TAD, 三蒽衍生物;TPE-TV-CyP, 具有聚集诱导发光的含四苯乙烯的异构荧光团;TPP, 四苯基卟啉。
通过使用可激活的余辉探针,可以在遇到肿瘤相关生物标志物时特异性地开启其信号,从而提高肿瘤成像的特异性。例如,“始终开启”型余辉探针在肝脏中的优先积聚可能对肝脏肿瘤的特异性成像构成挑战。为了赋予余辉材料肿瘤特异性,可以使其对H₂S具有可激活性,H₂S是一种活性内源性信号分子,通常在肿瘤中高浓度表达。例如,由NCBS、MEHPPV、猝灭剂EM F12⁺和PEG-b-PPG-b-PEG共组装形成的H₂S响应性纳米粒子(F12⁺-ANP)(图4a),在H₂S的刺激下被激活,从而能够区分肝脏肿瘤组织和健康的肝脏组织。此外,还设计了其他对肿瘤中高表达的生物标志物有响应的可激活余辉探针,如谷胱甘肽响应性余辉纳米粒子和H₂O₂可激活的放疗余辉纳米粒子。
器官损伤
药物过量可导致器官损伤,特别是肝脏和肾脏损伤。早期诊断对于防止损伤进一步发展至关重要。然而,器官损伤的早期临床症状通常很微妙,这凸显了开发用于早期诊断器官损伤的灵敏方法的重要性。生物硫醇,包括半胱氨酸、同型半胱氨酸和谷胱甘肽,在肝毒性的早期阶段在肝脏中耗尽,使其成为肝损伤的可行早期指标。例如,SPN-thiol在其表面设计有强吸电子基团(即2,4-二硝基苯磺酰基),通过能量转移猝灭余辉信号(图4b)。在生物硫醇的刺激下,2,4-二硝基苯磺酰基被移除,从而激活余辉信号。该系统在对乙酰氨基酚诱导的小鼠肝损伤模型中进行了测试,结果表明,未经处理组和用其他药物预保护的组均表现出比对乙酰氨基酚处理组更强的余辉信号。这表明SPN-thiol能够检测肝损伤。余辉发光成像也可能应用于肾损伤的诊断,因为O₂•⁻的过量产生可作为肾损伤的指标。例如,可以将O₂•⁻响应性余辉引发剂和余辉底物红荧烯结合起来,制造一种O₂•⁻可激活的余辉探针,用于诊断顺铂诱导的小鼠急性肾损伤。
肺损伤也可以通过余辉发光成像进行评估。例如,基于硼二吡咯甲川衍生物的H₂S可激活的余辉纳米粒子,可以通过监测异常升高的H₂S水平,应用于小鼠急性肺损伤的检测。与荧光成像相比,由于背景噪音极小和余辉信号的高激活对比度,该方法能够实现更早期和更特异性的诊断。
炎症反应
可视化病理生理过程可以深入了解生物过程和机制以及治疗方式。例如,炎症反应可以通过余辉成像进行可视化(图4c)。在炎症反应的早期阶段,中性粒细胞被招募到炎症区域,在那里它们通过产生活性氧和活性氮物质如ONOO⁻来发挥促炎作用。因此,ONOO⁻的水平反映了中性粒细胞的招募过程,并可以通过ONOO⁻激活的余辉(PA-AGL)纳米粒子进行监测,这些纳米粒子是余辉引发剂和ONOO⁻响应性余辉底物与两亲性聚合物的共组装体。在ONOO⁻存在下,PA-AGL纳米粒子在630 nm处呈现出专门增强533倍的余辉信号,相对于未经ONOO⁻处理但对酸性pH有余辉降低响应的PA-AGL纳米粒子。在小鼠炎症模型中,原位注射的PA-AGL纳米粒子在10分钟内在炎症区域显示出余辉发光,表明中性粒细胞已迅速被招募到炎症部位。此外,与酸化相关的炎症反应在脂多糖接种后最早0.5小时发生。由于其能够可视化中性粒细胞,PA-AGL纳米粒子也可用于区分过敏和炎症。
免疫反应
巨噬细胞是肿瘤微环境中的关键免疫调节器,具有二元极化(M1和M2表型)。极化的M1巨噬细胞产生NO,这在免疫反应中起着关键作用。巨噬细胞极化可以使用比率型余辉纳米粒子进行可视化,这些纳米粒子由余辉引发剂(TPP)、余辉底物(MEHPPV)和NO响应性余辉中继单元与两亲性聚合物共组装而成(图4d)。比率型余辉纳米粒子在600 nm处显示余辉发射,源于MEHPPV,而中继单元的发射可忽略不计。与NO相互作用后,中继单元在830 nm处出现发射峰。因此,随着NO浓度的增加,纳米粒子显示出比率型余辉信号(830 nm/600 nm)。在不同的巨噬细胞极化调节剂中,干扰素-γ(IFNγ)处理在体外导致最高比率,表明巨噬细胞极化程度最高,这与流式细胞术分析和用不同调节剂处理的小鼠肿瘤体积非常一致。
M1巨噬细胞释放的NO可以进一步与来自线粒体电子传递链的O₂•⁻反应,形成ONOO⁻,使得ONOO⁻成为监测巨噬细胞极化的另一个合适的生物标志物。例如,一个ONOO⁻响应性声控余辉探针可以用于可视化巨噬细胞极化。此外,可以对T细胞进行成像以评估免疫治疗中的免疫反应。例如,颗粒酶B在细胞毒性T细胞中过表达,可以使用一种探针进行监测,该探针包含一个通过颗粒酶B可切割肽连接到余辉纳米粒子表面的猝灭剂;在这里,余辉信号在猝灭剂被颗粒酶B切割后被激活。这种方法已应用于声控余辉纳米探针和颗粒酶B可激活的三蒽衍生物纳米粒子,以将余辉信号与细胞毒性T细胞水平相关联。
其他应用
由于余辉是由化学反应引发的,而化学反应随温度升高而加速,因此其强度与温度相关。因此,余辉成像可用于监测病变部位的温度,例如,在光热治疗期间指导治疗(图4e)。此外,药物释放可以通过集成药物和余辉材料的系统进行可视化;在这里,余辉信号在特定刺激下与药物释放同时被激活。此外,还探索了使用连接有猝灭剂的适配体通过静电相互作用附着在余辉纳米粒子表面以猝灭余辉,从而区分癌症外泌体。当遇到癌症外泌体时,猝灭剂适配体被移除,导致余辉恢复,用于癌症外泌体的多重区分。此外,余辉纳米粒子可用于侧向流免疫分析、H₂O和D₂O的同位素分析以及血液中卟啉的检测。
疾病治疗
余辉成像还为治疗提供了策略。余辉成像过程中产生的ROS通常处于低、非细胞毒性浓度。然而,增加辐照功率和持续时间可以产生过量的ROS,导致细胞死亡(图5a)。随后的余辉发光可以进一步原位激发光敏剂以达到治疗目的。此外,余辉成像可以引导靶向治疗到疾病部位。
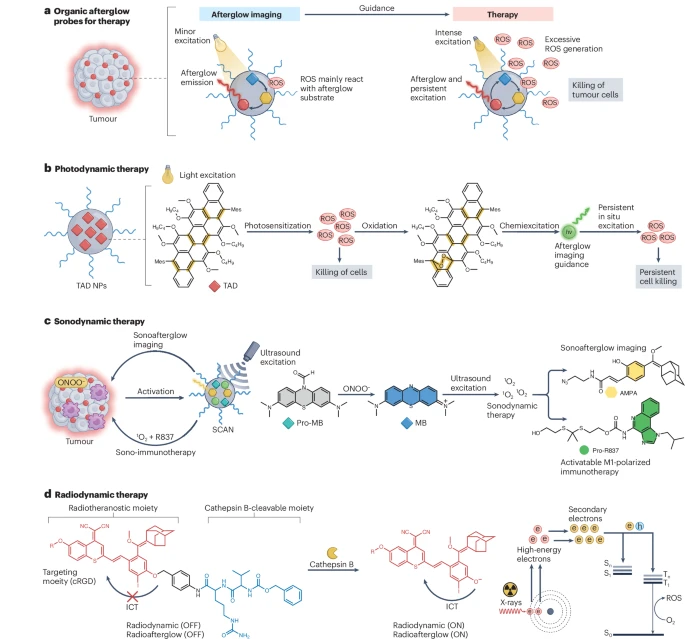 图5:有机余辉发光在治疗中的应用。
图5:有机余辉发光在治疗中的应用。
a, 余辉材料可以被设计用于产生过量的活性氧(ROS)来杀死癌细胞。 b, 余辉成像通过提供辐照的时间、位置和间隔信息来指导光动力疗法。此外,余辉引发剂可以被持续激发以产生ROS,用于持久性治疗。 c, 余辉成像可用于指导声动力疗法。例如,在肿瘤微环境中,过氧亚硝酸盐(ONOO⁻)激活一个声控余辉癌症纳米免疫诊疗探针(SCAN),用于声控余辉发光,导致¹O₂的释放和¹O₂可激活的前药Pro-R837的激活。¹O₂诱导的声动力疗法和R837诱导的巨噬细胞极化导致肿瘤微环境的调节,从而增加ONOO⁻浓度。此外,可以进行声控余辉成像以评估肿瘤免疫微环境并指导治疗。 d, 放射动力疗法可以由余辉成像指导。例如,一个包含环状精氨酸-甘氨酸-天冬氨酸(cRGD)肽和组织蛋白酶B可切割部分的分子放疗余辉探针,仅在被组织蛋白酶B激活后才表现出放疗余辉和放射动力疗法。AMPA, 叠氮-丙烯酸甲酯-苯氧基金刚烷;ICT, 分子内电荷转移;MB, 亚甲蓝;NPs, 纳米粒子;TAD, 三蒽衍生物。
光动力疗法
光动力疗法是一种利用光敏剂和光源选择性地破坏异常细胞的治疗方式。该方法临床上用于治疗癌前角化病皮肤病变和一些非黑色素瘤皮肤癌,并已显示出在治疗食管癌、肺癌和前列腺癌方面的临床潜力。然而,光敏剂通常在治疗过程中不提供反馈,这使得难以控制光照射的时间、位置和范围。余辉成像中的高信噪比以及产生的ROS与余辉强度的相关性,允许纵向余辉成像监测探针富集并在治疗期间可视化ROS的生成,从而实现精确的光动力疗法(图5b)。此外,余辉可以在辐照停止后继续激发光敏剂以产生ROS,从而实现延长的肿瘤根除。例如,静脉注射的三蒽衍生物纳米粒子在携带CT-26肿瘤的小鼠中16小时后显示出最大的肿瘤积聚,这表明了光动力疗法的最佳时机。重要的是,余辉发光持续20分钟,以持续激发光敏剂产生ROS。这使得能够进行分次光动力疗法以克服肿瘤缺氧。
声动力疗法
声控余辉可用于声动力疗法,提供深层组织穿透。例如,一种声动力学诊疗纳米探针允许对肿瘤进行声控余辉成像,以监测免疫激活和联合声动力疗法与免疫疗法(图5c)。这种诊疗纳米探针是一个多组分的声控余辉系统,包含ONOO⁻可激活的声控余辉引发剂前体亚甲蓝、基于AEE衍生物的声控余辉底物和用于联合治疗的¹O₂可激活前药Pro-R837。超声激发随后导致¹O₂的产生,这有助于余辉发光以指导治疗,发挥声动力学效应并激活M1巨噬细胞极化前药。激活的前药(R837)还促进M1巨噬细胞极化,导致进一步产生ONOO⁻,从而实现协同放大效应。每次治疗的余辉亮度与ONOO⁻的浓度相关,这反映了肿瘤免疫微环境,允许指导治疗决策。在4T1荷瘤小鼠中进行两轮治疗后,余辉强度变强,表明免疫疗法的有效性。在第四轮治疗后,余辉强度保持稳定,表明肿瘤微环境变化极小,建议停止治疗。
放射动力疗法
X射线可作为放射动力疗法的激发源,用于治疗深部肿瘤。然而,使用X射线的放射疗法通常缺乏特异性。或者,配备有环状精氨酸-甘氨酸-天冬氨酸肽部分以增加肿瘤摄取和CatB可切割肽部分的余辉分子IDPASu可用于放射动力疗法(图5d)。由于CatB可切割部分赋予的电子给与能力降低,放疗余辉和放射动力学效应仅在CatB存在时才表现出来。CatB在多种癌症类型中上调;因此,这种方法允许肿瘤响应性成像和治疗,最大限度地减少对健康组织的毒性。例如,这种余辉探针可以静脉注射,并在颅内胶质母细胞瘤小鼠模型中在低剂量(5 mGy)照射下捕获余辉信号。由此产生的余辉发光可以可视化肿瘤区域,以指导治疗时机。在这里,放射动力疗法在高剂量0.8 Gy下进行,每3天给药一次,共进行四次,导致肿瘤大小显著减小,生存率提高。类似地,通过放射发光诱导的光敏剂激发发射余辉的纳米粒子也已被探索用于放射动力疗法。
展望
有机余辉发光能够实现无自发荧光、高信噪比的生物医学成像。然而,为了提高成像灵敏度、增加组织穿透深度、减少注射剂量并简化设备要求,有机余辉探针仍需实现更亮、波长更长的发射。具有高亮度的近红外有机余辉探针可实现高灵敏度成像。例如,TPP和DO的共价偶联产生了高亮度的近红外发射和高灵敏度,能够在充分激发下检测到小至0.048 mm³的肿瘤,组织穿透深度可达6 cm。其亮度允许使用传统的光谱荧光计进行检测,无需更灵敏和昂贵的电荷耦合器件探测器。然而,成像深度也受外部激发的限制。适用于低吸收探针的短激发波长在有效激发深层组织中的探针方面面临挑战。相比之下,通过长波长光、超声波或X射线激发已显示出深层组织成像的前景。例如,具有第二近红外区域(1000–1700 nm)光学特性的光敏剂可以被整合到纳米粒子中,并作为深层组织中的余辉引发剂。
揭示余辉发光产生的每一步机理以及余辉材料的结构-性质关系,对于合理设计探针至关重要。例如,声控余辉的机理尚未完全理解,其激发效率仍然较低,通常需要高功率,这会导致额外的热量产生。同样,放疗余辉也面临挑战,因为有机分子通常具有低的X射线吸收能力。虽然引入重原子增加了X射线吸收截面,但由此产生的余辉通常比光控余辉低一到两个数量级。基于闪烁体的策略涉及多个能量转移过程,导致能量损失和信号强度降低。为了增强放疗余辉,需要开发具有高效X射线吸收、发光和ROS生成的分子。此外,可以应用分子融合策略来最小化能量损失。
余辉发光中涉及的氧化和分解过程有助于余辉发光,但也引发了对余辉探针不稳定性的担忧。例如,由于其降解和不稳定性,SPN-NCBS在10次辐照循环后余辉强度下降约65%。不稳定性损害了进行定量和实时纵向成像的能力。一些有机余辉探针可以吸收可见光以发射余辉。然而,这一特性也导致其在环境条件下大量分解,需要避光储存并可能导致非特异性信号。这或许可以通过不依赖氧化和降解过程,同时保持稳定和灵敏的有机余辉系统来解决。
必须仔细评估有机余辉系统的体内行为和潜在毒性(专栏1)。大多数有机余辉探针是由多种疏水性组分在两亲性聚合物中共组装而成的纳米粒子。这些纳米粒子通常用聚乙二醇进行表面修饰,聚乙二醇是水溶性的,具有生物利用度、低免疫原性、长循环时间和生物相容性的优点。在余辉纳米粒子中,余辉引发剂通常作为光敏剂,在没有激发的情况下是无细胞毒性和安全的。然而,在光动力疗法的临床研究中,已显示光敏剂血卟啉衍生物可以在皮肤中积聚数周,存在光毒性反应的风险。重要的是,应评估余辉纳米粒子的解体行为和体内代谢,以检查每个组分(余辉引发剂、余辉底物和中继单元)的毒理学和长期影响。此外,余辉纳米粒子在肝脏和脾脏中积聚,可能导致潜在毒性。为了提高纳米粒子的生物相容性,可以将其设计成小尺寸(<5.5 nm)和带表面电荷,使其能够通过肾小球过滤并随后在尿液中清除。或者,基于单分子的余辉系统具有可重复性和结构灵活性的优点。例如,基于花菁5衍生物的小分子余辉探针显示出余辉发光,并在小鼠中快速代谢,血浆半衰期约为10分钟。然而,快速清除可能导致在靶部位积聚不足和与生物标志物的相互作用有限。此外,基于单分子的余辉探针的亮度显著低于基于纳米粒子的系统。因此,需要进一步深入研究其结构-性质关系以改善其余辉特性。
到目前为止,余辉发光主要在小鼠模型中进行研究。然而,小鼠中的光穿透深度可能无法转化为人体尺度。特别是,由白光激发的余辉探针更适合于浅表组织而非深层组织。因此,可能需要大型动物模型来评估余辉成像和治疗的功效。重要的是,小型动物模型在免疫学上与人类不同,包括CD45表达(一种在大多数免疫细胞表面表达的跨膜蛋白)和酶活性的差异。因此,可能需要为在人类中的应用探索不同的肽底物。通过将人类细胞移植到免疫缺陷小鼠中产生的人源化小鼠模型,可能有助于缓解其中一些挑战。
专栏1 转化考量
有机余辉发光的临床转化需要在一个复杂的监管框架下进行,包括严格的实验室和制造控制、临床前研究以及三个阶段的临床试验。余辉探针通常基于纳米粒子制剂,其监管批准需要对其药代动力学、药效学和毒性进行彻底调查。重要的是,必须确保足够的功效、生物安全性、批次间一致性和设备兼容性。
为确保功效,需要通过研究结构-性质关系及其光学特性,包括强度、发射波长、激发源多功能性和信号可重复性,对余辉探针进行系统筛选和优化。除了在小鼠模型中进行临床前研究外,还应应用大型动物模型进行功效评估,以确保成像参数(如组织穿透深度和探针设计)可转化为人类。特别是,应考虑物种间的差异。
应研究余辉纳米粒子的体内行为,包括药代动力学、稳定性、生物分布、代谢和毒理学。为简化转化,可以使用临床批准的材料。例如,亚甲蓝在临床上用于影像引导治疗。其衍生物3,7-双-(二丁氨基)-吩噻嗪-5-鎓盐表现出高对比度的可激活余辉成像,并可能简化基于3,7-双-(二丁氨基)-吩噻嗪-5-鎓盐的余辉成像应用的监管批准。用于治疗目的的余辉探针还必须测试剂量和辐照条件。
应确保探针质量的一致性。不同的制造方法可能导致余辉特性、药代动力学和生物分布的差异。FDA指导文件《包含纳米材料的药品,包括生物制品》强调了标准化制备和严格表征以确保质量一致的重要性。纳米粒子的多组分性质引入了额外的复杂性。相比之下,将所有功能单元集成在单一实体中的自持型余辉分子可能提供更高的可靠性和工业可扩展性。
需要配备用于余辉激发的辐照源和用于信号收集的灵敏电荷耦合器件的医疗仪器。对于具有高信号强度和与临床使用染料(如吲哚菁绿)相匹配的光学特性的余辉材料,可以应用重新配置的荧光成像设备。然而,用于余辉发光的设备需要更高功率的激发光、延迟的信号采集和灵敏的探测器。