“环”游在癌症世界:解锁RNA家族的“隐藏大佬”——环状RNA
在人体每一个细胞的生命剧本中,DNA是那部厚重的法典,而RNA则是执行法典指令的信使与调控者。长久以来,科学界的目光主要聚焦于线性的信使RNA(mRNA),它们如同从DNA蓝图上复印的指令单,指导着蛋白质的合成。然而,在过去十年中,一个长期被忽视的RNA家族成员——环状RNA(circular RNA,简称circRNA)——正从科学的边缘地带强势崛起,成为癌症研究领域一颗冉冉升起的新星。
这篇发表于顶尖期刊《自然综述:癌症》的重磅文章,系统性地梳理并展望了circRNA在癌症研究中的广阔前景。它告诉我们,circRNA远非基因表达过程中的“意外产物”或“噪音”。而是一类功能多样、影响深远的分子“操盘手”,它们凭借着比线性RNA高出10倍的变体多样性和超强的稳定性,深度参与并影响着癌症从萌芽到扩散的每一个阶段。
第一章:揭开神秘面纱——环状RNA是什么?
想象一下,一条普通的绳子(代表线性RNA)总有两个易于磨损的末端。但如果将这条绳子的两端无缝地连接起来,形成一个闭合的环,它无疑会变得更加稳定和耐用。CircRNA正是这样一种特殊的RNA分子,它没有“头”和“尾”,是一个共价闭合的完美环状结构。
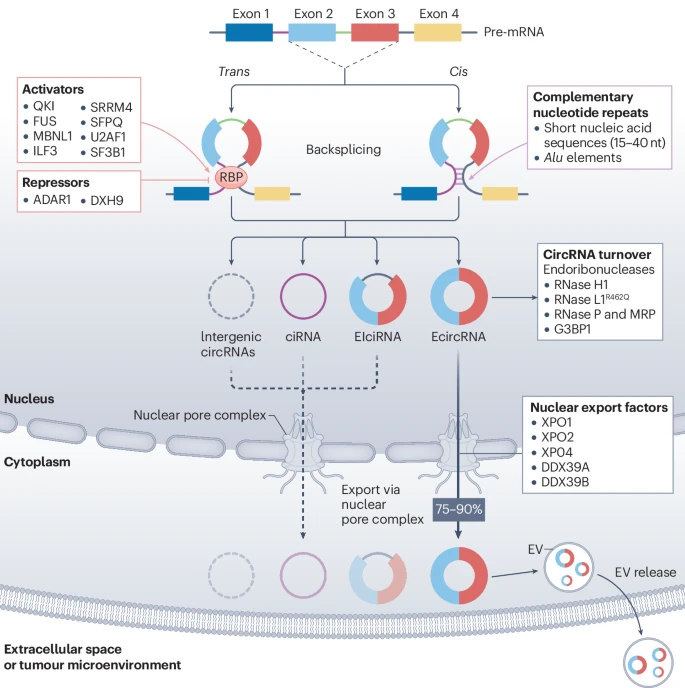
1.1 “返向剪接”:独特的诞生方式
在传统的认知中,DNA转录出的“前体信使RNA”(pre-mRNA)会经过一个叫做“剪接”的过程,由一个庞大而精密的分子机器——剪接体(spliceosome)——将无用的内含子序列切除,再将有用的外显子序列按顺序(5'端到3'端)拼接起来,形成成熟的线性mRNA。
然而,circRNA的形成源于一种被称为“返向剪接”(backsplicing)的非经典剪接事件。在这个过程中,一个外显子的下游3'端会出人意料地“回头”攻击并连接到上游一个外显子的5'端,从而形成一个闭合的环状结构。这个独特的连接点被称为“返向剪接点”(backsplice junction, bsj),是鉴定circRNA的“分子指纹”,也是区分它与线性RNA的关键。
1.2 稳定且多样的超凡特性
正是因为这种闭合的环状结构,circRNA没有暴露的末端,从而能够抵抗大多数负责降解RNA的核酸外切酶的攻击,使其在细胞内的半衰期远超对应的线性RNA,表现出极高的稳定性。
更令人惊叹的是,circRNA的种类极其繁多和多样。它们不仅可以由一个或多个外显子构成(EcircRNA),还可以同时包含外显子和内含子(ElciRNA),甚至完全由内含子构成(ciRNA)。这些不同类型的circRNA在细胞内的分布也各有特点:EcircRNA主要被运输到细胞质中发挥功能,而含有内含子的circRNA则更倾向于留在细胞核内调控转录。
1.3 精密的“生产调控”
CircRNA的产生并非随机的剪接错误,而是一个受到精确调控的过程。
顺式作用元件 (Cis-acting elements):基因序列本身的一些特征会促进返向剪接。例如,外显子两侧的内含子中存在的互补序列(特别是反向重复的Alu元件),能够相互配对形成“发夹”结构,将待环化的两个剪接位点在空间上拉近,从而促进环的形成。
反式作用因子 (Trans-acting factors):多种RNA结合蛋白 (RBP) 在此过程中扮演着“催化剂”或“抑制剂”的角色。例如,QKI、FUS等蛋白可以结合到特定的RNA序列上,促进环化 18;而DHX9和ADAR1等蛋白则会解开RNA的双链结构,抑制环化。在癌症中,这些调控蛋白的突变或表达异常,会直接导致circRNA的谱系发生剧变。
第二章:功能百变——circRNA在细胞中的多重角色
circRNA并非沉默的分子,它们通过与细胞内其他的生物大分子(RNA、蛋白质、DNA)发生相互作用,扮演着多样且关键的调控角色。
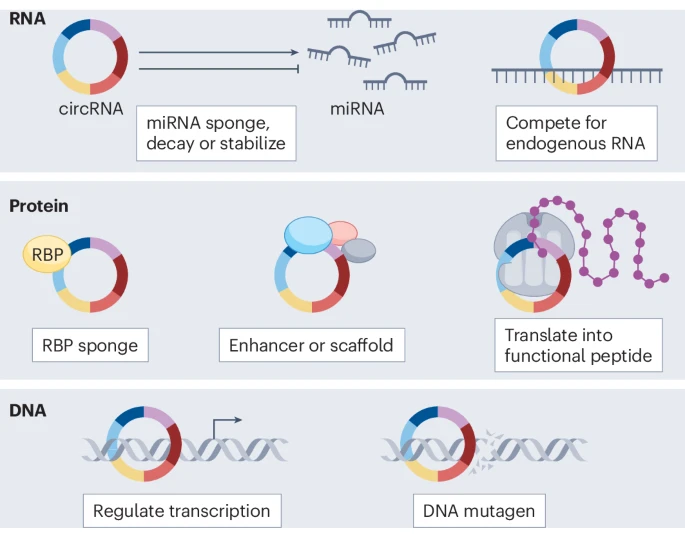
2.1 作为“海绵”:吸附microRNA
这是circRNA最广为人知,也是早期研究最多的功能,被称为“miRNA海绵”(miRNA sponging)。MicroRNA(miRNA)是一类微小的RNA分子,能降解或抑制其目标mRNA的翻译。一些circRNA分子上富含miRNA的结合位点,能够像海绵一样大量吸附特定的miRNA,从而解除该miRNA对其下游靶基因的抑制,间接调控基因表达。
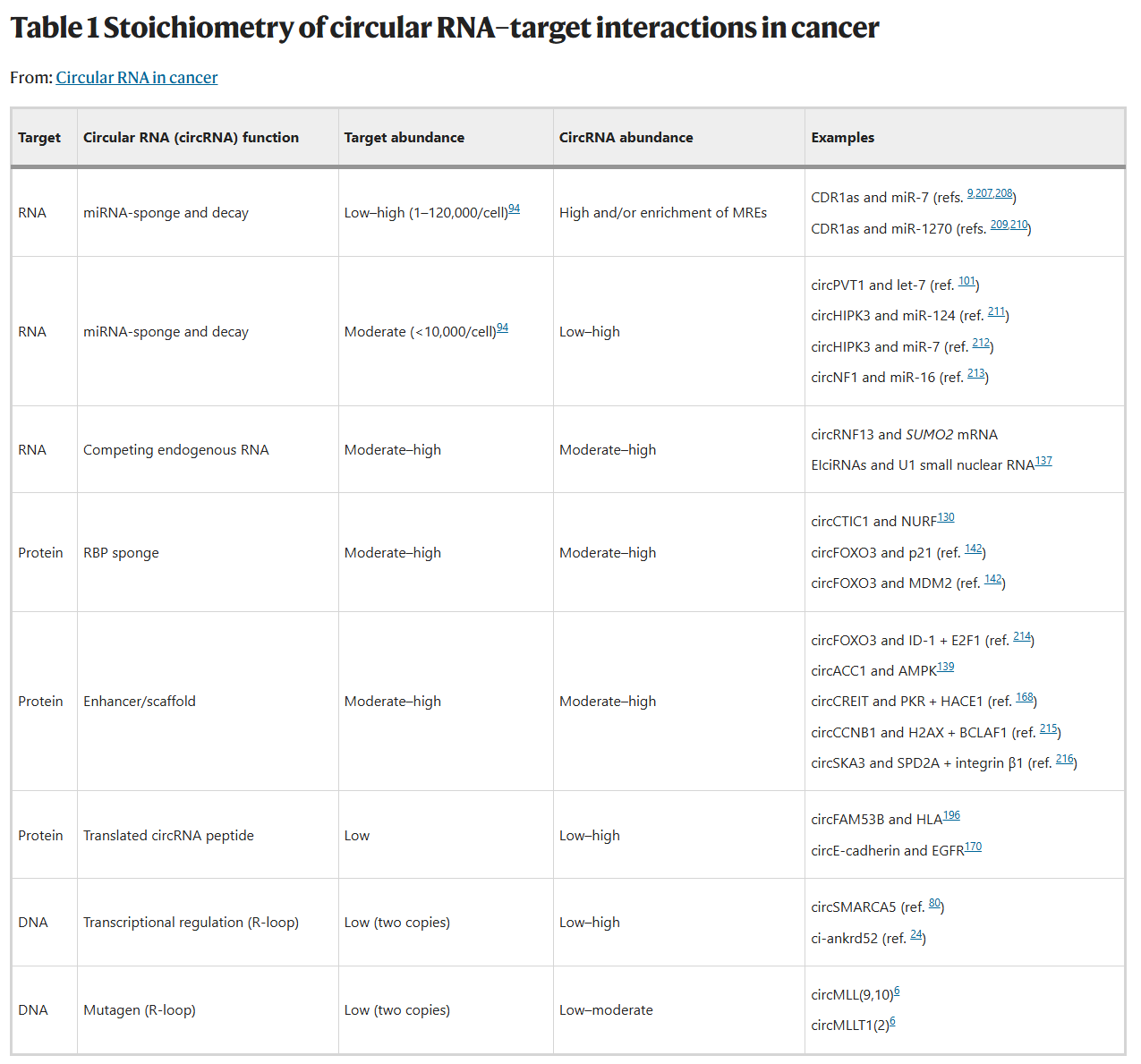
经典的例子是circCDR1as,它在人类细胞中拥有超过70个miR-7的结合位点,能高效地吸附miR-7。然而,文章也批判性地指出,化学计量学(stoichiometry)是评估这一功能的关键。大多数circRNA的丰度远低于其潜在的miRNA靶标,因此“海绵”效应可能并没那么普遍。只有当circRNA的表达量极高,或者其分子上富集了大量的结合位点时,这种调控才可能具有显著的生物学意义。
2.2 作为“支架”或“诱饵”:与蛋白质互作
CircRNA可以作为一个平台或支架,招募多个蛋白质,促进它们形成功能性的蛋白复合物。例如,circFOXO3可以同时结合p21和MDM2蛋白,促进p53的降解,从而影响细胞凋亡。此外,它们还可以作为“诱饵”,结合并隔离某些RNA结合蛋白,阻止这些蛋白发挥其正常功能。
2.3 惊人的潜能:翻译成蛋白质
传统观点认为,只有线性的mRNA才能被核糖体识别并翻译成蛋白质。然而,越来越多的证据表明,部分circRNA由于含有内部核糖体进入位点(IRES) 或m⁶A修饰等特殊结构,可以被核糖体识别,从而进行“滚环翻译”,产生功能性的多肽或蛋白质。尽管这一领域仍存在争议。但已有研究证实,由circRNA翻译出的蛋白在癌症中发挥着重要作用。例如,在胶质母细胞瘤中,由circE-cadherin翻译出的一个蛋白变体能够激活EGFR信号通路,促进肿瘤的恶性进展。
2.4 直接对话DNA:调控转录与引发突变
这或许是circRNA最令人震惊的功能之一。一些存在于细胞核内的circRNA,可以回到其来源的DNA位点,通过碱基互补配对原则与DNA双螺旋中的一条链结合,形成一种被称为“circR-loop”的RNA-DNA杂合三链结构。 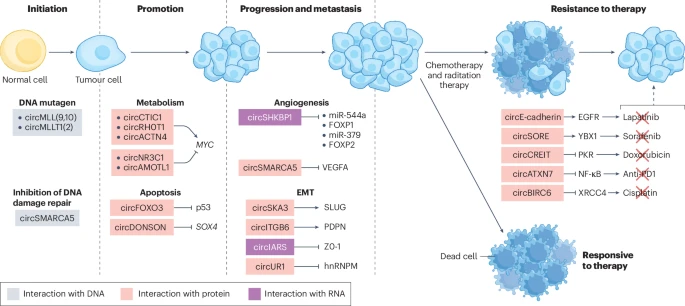 这种结构可以:
这种结构可以:
调控转录:例如,ci-ankrd52和circSMARCA5通过形成R-loop,能够招募转录因子,增强其母基因的转录。
引发DNA损伤和突变:这是一项里程碑式的发现。研究表明,在急性白血病中,来源于_MLL_基因的circMLL能够在其基因组位点形成R-loop,这种结构会干扰RNA聚合酶II的正常行进,从而引发DNA双链断裂和染色体易位,直接驱动了致癌基因融合的产生。这是
首个被证实能够直接导致癌症突变的内源性RNA分子,揭示了circRNA在癌症起始阶段的黑暗面。
第三章:贯穿始末——circRNA在癌症演进中的“四部曲”
文章系统地阐述了circRNA在癌症发生发展的四个关键阶段——起始、促进、进展与转移、治疗抵抗——所扮演的角色。
3.1 癌症起始 (Initiation)
如前所述,circRNA最直接的致癌作用就是作为DNA诱变剂。circMLL的例子表明,它们可以通过“内源性RNA介导的DNA损伤”(ER3D)机制,引发关键的致癌突变,为癌症的发生埋下第一颗种子。此外,circSMARCA5通过与DNA损伤修复相关蛋白互作,抑制DNA损伤的修复,也可能在癌症起始中发挥作用。
3.2 癌症促进 (Promotion)
一旦癌细胞形成,circRNA会通过多种途径促进其增殖和生存。
重塑代谢:癌细胞的快速增殖需要大量的能量和物质。许多circRNA参与调控癌细胞的代谢重编程,尤其是“瓦博格效应”(即有氧糖酵解)。例如,circCTIC1和circRHOT1都能上调关键癌基因 MYC的表达,而MYC是细胞代谢的主要调控者。在结直肠癌中,circACC1则能稳定并激活AMPK蛋白激酶,促进糖酵解,为肿瘤发展提供能量。
抑制凋亡:癌细胞的一个重要特征就是逃避程序性死亡(凋亡)。circFOXO3通过促进p53的降解来抑制凋亡。而在胃癌中,circDONSON则通过激活SOX4信号通路来抑制细胞凋亡,促进肿瘤生长。
3.3 癌症进展与转移 (Progression and Metastasis)
当肿瘤生长到一定大小后,就需要新的血管来提供营养,并通过转移侵袭远处器官。
促进血管生成:circSHKBP1在胶质瘤中可以通过“海绵”吸附miR-544a和miR-379,上调血管生成相关通路。
驱动上皮-间质转化 (EMT):EMT是癌细胞获得迁移和侵袭能力的关键过程。在结直肠癌中,高表达的circSKA3能够结合并稳定EMT关键转录因子SLUG,从而抑制其降解,促进肿瘤转移。
3.4 治疗抵抗 (Resistance to therapy)
化疗、靶向治疗和免疫治疗是现代癌症治疗的三大支柱,但耐药性的产生是导致治疗失败的主要原因。CircRNA在其中扮演了不容忽视的角色。
化疗耐药:在肝癌中,circSORE能够结合蛋白YBX1,阻止其进入细胞核,从而介导对靶向药物索拉非尼的耐药。
免疫治疗抵抗:在结直肠癌的肿瘤特异性T细胞中,circATXN7的表达会上调,它能结合并抑制促炎转录因子NF-κB的活性,导致T细胞死亡,从而帮助肿瘤逃避免疫系统的攻击,并对PD-1抑制剂产生抵抗。
第四章:走向临床——circRNA的应用潜力与未来展望
凭借其高稳定性、组织特异性和在癌症中的广泛作用,circRNA正在成为极具潜力的临床工具。 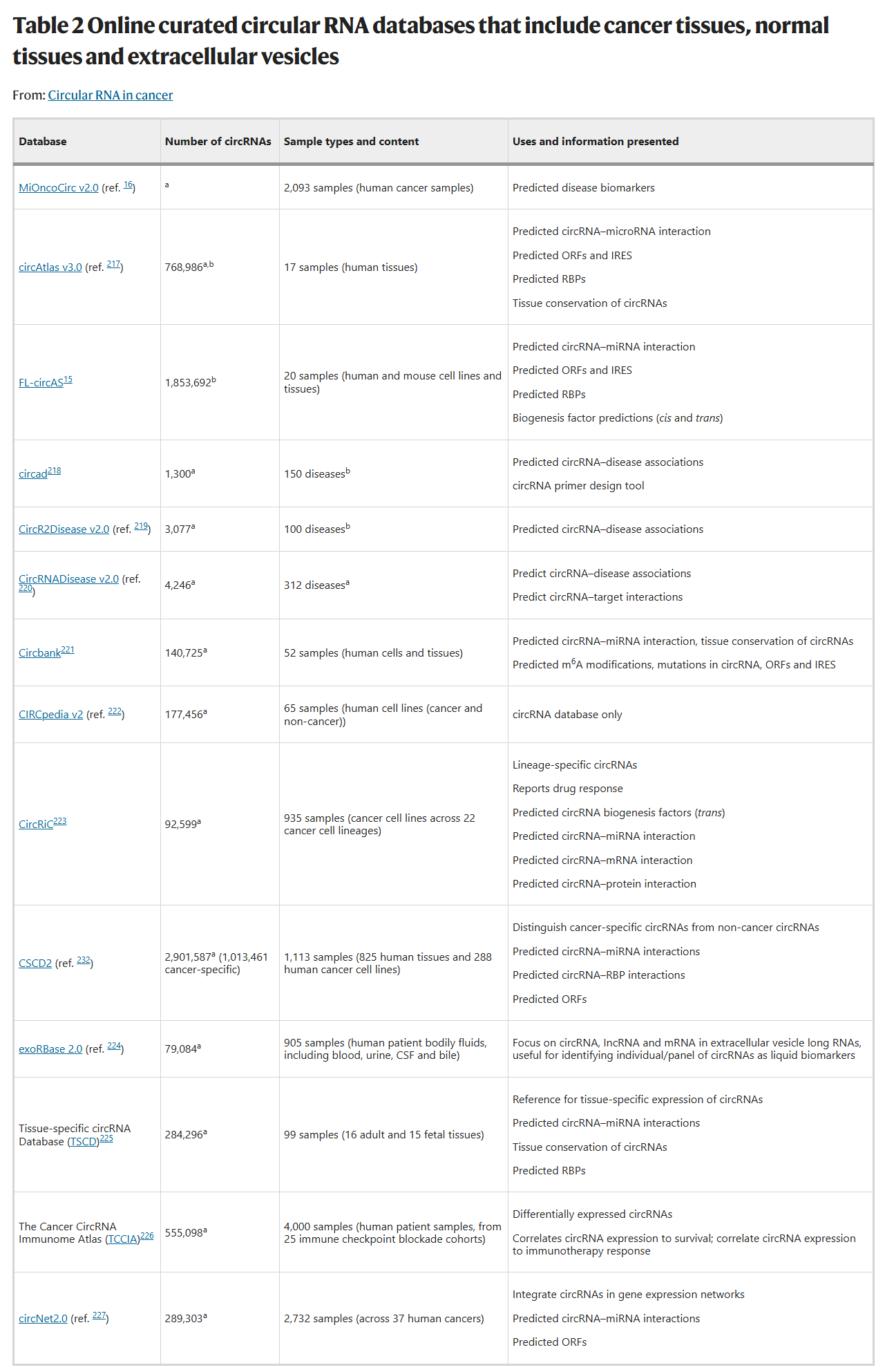
4.1 作为“液体活检”的明星生物标志物
由于circRNA在血液、尿液、唾液等体液中稳定存在,并且可以被包裹在
细胞外囊泡(如外泌体)中进行长距离运输,它们成为了理想的液体活检标志物。通过检测患者体液中特定circRNA的水平,有望实现癌症的早期诊断、预后判断和治疗反应监测。例如,一个由五种circRNA组成的组合已被证明可以高灵敏度地筛查出胰腺癌患者。
然而,挑战依然存在。大多数circRNA丰度较低,需要高灵敏度的检测技术;此外,如何区分来源于肿瘤细胞和健康细胞的circRNA也是一个需要解决的问题。
4.2 作为治疗靶点和治疗工具
circRNA的应用前景远不止于诊断。
作为治疗靶点:对于那些促进癌症发展的“致癌circRNA”,可以设计反义寡核苷酸(ASO)或利用CRISPR-Cas13系统来特异性地降解它们,从而抑制肿瘤生长。
作为治疗工具:反过来,可以人工合成circRNA,将其设计成编码肿瘤抗原的RNA疫苗。这种circRNA疫苗不仅比传统的线性mRNA疫苗更稳定,还能持续地在体内表达抗原蛋白,激发出强大而持久的抗肿瘤免疫反应。近期研究发现,由circFAM53B翻译出的“隐秘肽”能够被免疫系统识别,并触发针对乳腺癌和黑色素瘤的免疫攻击,为开发新型癌症疫苗提供了令人振奋的新思路。
4.3 未来的挑战与机遇
尽管circRNA的研究在过去十年取得了爆炸性进展,但要真正将其转化为临床应用,仍需克服诸多挑战,包括:大规模生产circRNA的工艺、高效且靶向的递送系统、避免脱靶效应和潜在的免疫原性等。
总而言之,这篇综述为我们描绘了一幅波澜壮阔的画卷:circRNA不再是基因表达的“副产品”,而是一个深度融入癌症生物学方方面面的核心调控层。从引发第一个致癌突变,到帮助癌细胞逃脱药物和免疫系统的追杀,它们无处不在。随着研究的不断深入,我们有理由相信,在未来5到10年内,针对circRNA的诊断和治疗策略将走出实验室,为癌症患者带来全新的希望。这位RNA世界的“隐藏大佬”,终将在抗击癌症的战场上大放异彩。