纳米药物如何设计才能获得更好的癌症靶向效果,这篇大子刊综述为你提供多种设计策略
引言:当抗癌药物装上“纳米导航”
想象一下,如果抗癌药物能像精确制导的导弹一样,只攻击肿瘤细胞,而对健康细胞“视而不见”,癌症治疗将会发生怎样的革命?这正是“癌症纳米医学”的核心愿景。通过将化疗药物、生物制剂或诊断剂等“货物”封装在纳米尺寸的载体中,科学家们希望能够克服传统疗法毒性大、药效差的局限性。
然而,实现这一目标的道路远比想象的要复杂。早期的纳米医学研究很大程度上依赖于一个被称为“增强渗透与滞留效应”(EPR效应)的理论。该理论认为,肿瘤区域的血管通常存在缺陷,像“漏水的管道”,使得纳米颗粒更容易渗透进去并滞留下来。尽管这一发现推动了领域的飞速发展,并促成了一些药物的临床成功,但越来越多的研究表明,EPR效应在人体内的普适性受到质疑,纳米药物在肿瘤中的实际富集量往往不到注射剂量的1%。
这促使科学家们重新思考:如何才能真正为纳米药物打造一个更高级、更智能的“导航系统”?近期发表于《自然综述:癌症》的一篇综述文章,系统性地探讨了该领域的前沿工程设计策略。文章指出,未来的癌症纳米医学必须超越传统的EPR观念,从给药途径、生理屏障、细胞靶向乃至亚细胞定位等多个层面进行综合、理性的设计。特别是,文章强调了利用静电吸附等非共价修饰技术来“装扮”纳米颗粒表面的巨大潜力,这为设计出能够精准穿梭于人体复杂环境、巧妙伪装以躲避免疫系统追捕,并最终精确命中目标的下一代纳米疗法开辟了新的道路。
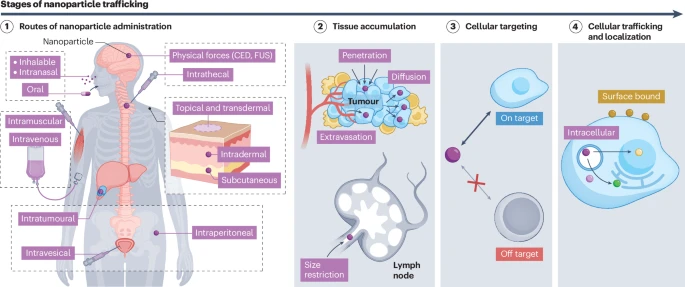
第一章:万里长征第一步——穿越人体的重重关卡
将纳米药物递送到肿瘤,就像一场需要穿越重重关卡的“长征”。从注射点开始,纳米颗粒就面临着一系列复杂的生物学屏障的挑战。
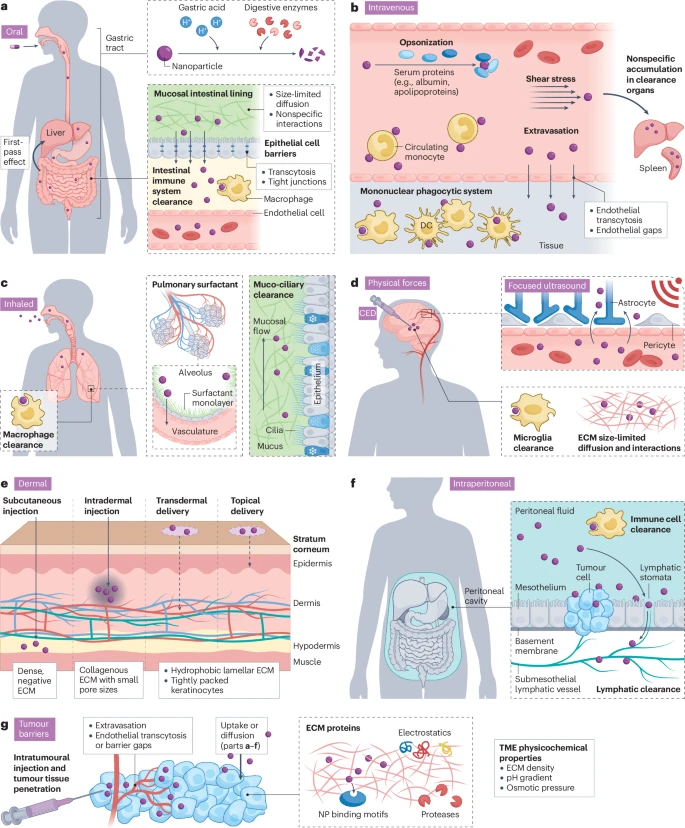
1.1 选择正确的“出发点”:多样化的给药途径
传统的静脉注射虽然方便快捷,能让药物迅速进入全身循环,但纳米颗粒必须在血液中保持足够长的循环时间,同时躲避肝、脾等“过滤”器官和免疫系统的清除。因此,科学家们正积极探索更多样化的给药途径,以“抄近道”的方式直接抵达“战场”。
局部直达,精准打击
肿瘤内注射 (Intratumoral):直接将药物注射到肿瘤内部,是最高效的局部给药方式,特别适用于递送那些全身使用毒性极大的强效药物,如免疫激活分子。然而,它只适用于黑色素瘤、肝癌等位置表浅、易于穿刺的肿瘤。
腹膜腔注射 (Intraperitoneal):对于易发生腹腔转移的卵巢癌、胰腺癌等,通过腹腔注射可以使药物在病灶区域达到很高的局部浓度。但药物仍需克服腹腔液中巨噬细胞的清除和淋巴系统的快速引流。
鞘内注射 (Intrathecal):针对脑部肿瘤,通过将药物注入脊髓周围的脑脊液中,可以绕过坚固的“血脑屏障”。
皮肤给药,另辟蹊径
- 皮肤作为人体最大的器官,提供了多种给药入口,如皮下 (subcutaneous)、皮内 (intradermal) 和 透皮 (transdermal) 给药。这些途径对于开发癌症疫苗尤为重要,因为皮肤中富含树突状细胞等重要的免疫细胞,可以高效启动抗肿瘤免疫反应。
吸入与口服,面向未来的便捷给药
吸入给药 (Inhaled) 主要用于治疗肺部肿瘤,但纳米颗粒需要克服肺部黏液和表面活性物质的阻碍。
口服给药 (Oral) 是最方便的给药方式,但挑战巨大,药物必须能抵抗胃酸和消化酶的降解,并有效穿过肠道黏膜屏障进入血液。
1.2 攻克“铜墙铁壁”:跨越组织和细胞的障碍
无论选择哪种途径,纳米颗粒都必须穿越致密的组织屏障才能到达目标细胞。
血脑屏障 (BBB):这是保护大脑免受血液中有害物质侵害的生理屏障,也阻挡了绝大多数药物进入脑部。科学家们正通过调节纳米颗粒的大小、电荷、表面化学性质,或利用聚焦超声等物理手段暂时打开屏障,来帮助纳米药物“闯关”。
肿瘤微环境 (TME):肿瘤内部并非一盘散沙,而是由癌细胞、免疫细胞、基质细胞以及致密的细胞外基质(ECM)共同构成的复杂生态系统。这种致密的基质会阻碍纳米颗粒的渗透和扩散。此外,肿瘤内部异常的血管和较高的组织间液压力也会将纳米颗粒“冲刷”出去。
第二章:伪装的艺术——纳米颗粒的“隐身”与“社交”
纳米颗粒进入人体后,其表面会立刻被血液或体液中的各种蛋白质包裹,形成一层被称为“蛋白冠”的生物分子层。这层蛋白冠在很大程度上决定了纳米颗粒的“生物身份”和最终命运——是被免疫系统识别为“入侵者”并清除,还是能顺利到达目的地。因此,对纳米颗粒的表面进行巧妙的化学修饰,就如同为它穿上合适的“伪装服”和“社交礼服”,至关重要。
2.1 传统“隐身衣”:聚乙二醇(PEG)的辉煌与困境
长期以来,聚乙二醇(PEG)化是应用最广泛的纳米颗粒表面修饰技术。PEG分子链像一层水合的“保护罩”,通过空间位阻效应减少蛋白质的吸附,从而延长纳米颗粒在血液中的循环时间,实现“隐身”效果。
然而,这种“一刀切”的隐身策略也带来了所谓的**“PEG困境”** :
影响靶向和内吞:过于严密的PEG层会像一件厚重的大衣,遮蔽了用于主动靶向的配体,并阻碍纳米颗粒被细胞有效吞噬。
引发免疫反应:反复使用PEG化的药物可能导致人体产生针对PEG的抗体,从而加速药物清除,甚至在某些人群中引发过敏反应。
2.2 新一代“智能外衣”:非共价修饰的崛起
为了克服传统共价修饰(如同用强力胶水粘合)反应条件苛刻、可能破坏配体活性的缺点,文章重点介绍了一种更温和、更灵活的策略——非共价表面修饰。这种方法主要利用静电吸引、疏水相互作用、氢键等较弱的分子间作用力,将各种功能分子“吸附”到纳米颗粒表面。这种“魔术贴”式的方法不仅操作简便,更极大地扩展了可用于修饰的分子库,为纳米颗粒赋予了前所未有的多功能性。
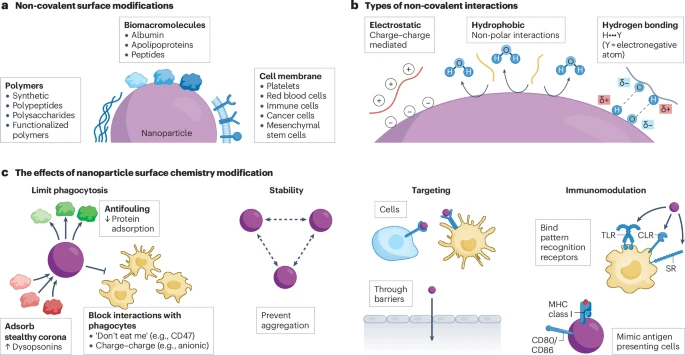
2.2.1 披上“天然外衣”:利用生物大分子
蛋白质:
白蛋白 (Albumin):预先用白蛋白包裹纳米颗粒,可以形成一层“友好的”蛋白冠,显著延长其在体内的循环半衰期。临床上已获批的白蛋白结合型紫杉醇(Abraxane)就是成功典范。
载脂蛋白 (Apolipoproteins):特定类型的载脂蛋白(如ApoE)可以与血脑屏障内皮细胞上的受体结合,引导纳米颗粒“乘坐”特定的转运系统进入大脑,为治疗脑瘤提供了新思路。
多糖 (Polysaccharides):
透明质酸 (Hyaluronic Acid):这是一种天然存在于人体的多糖,可以特异性地与许多肿瘤细胞表面高表达的CD44受体结合。通过静电吸附的方式将透明质酸包裹在纳米颗粒表面,不仅能实现对癌细胞的精准靶向,其亲水性还能起到类似PEG的“隐身”效果。研究表明,这种吸附方式相比共价连接,能更灵活地展示透明质酸分子,从而更有效地与细胞表面的多个CD44受体结合,靶向效率甚至可提升十倍。
葡聚糖、甘露聚糖等:这些糖类分子可以靶向免疫细胞(如巨噬细胞、树突状细胞)表面的特定凝集素受体,这在开发用于肿瘤免疫治疗和淋巴结成像的纳米系统中具有重要价值。
2.2.2 穿上“仿生迷彩”:细胞膜伪装技术
这是纳米医学领域最令人兴奋的策略之一,其核心思想是“以彼之道,还施彼身”。通过将从特定细胞中提取的细胞膜包裹在纳米颗粒表面,使其完美伪装成该种细胞,从而实现特殊的生物学功能。
红细胞膜:红细胞表面有CD47等“别吃我”的信号蛋白,可以有效躲避免疫细胞的吞噬。用红细胞膜包裹的纳米颗粒,其血液循环时间甚至超过了PEG化的颗粒,展现出卓越的“隐身”能力。
癌细胞膜:用来自肿瘤细胞自身的膜来包裹纳米颗粒,可以利用癌细胞间的“同源识别”机制,使其精准地“寻亲归巢”到肿瘤部位。
免疫细胞膜:包裹上白细胞或血小板的细胞膜,纳米颗粒就能“继承”这些细胞的特性,例如靶向肿瘤炎症区域的能力。
第三章:决胜终点线——精准递送至细胞内部
成功抵达肿瘤组织后,纳米药物的使命才完成了一半。对于许多药物而言,它们必须进入细胞内部,甚至到达特定的细胞器(如细胞核或线粒体),才能发挥最大疗效。
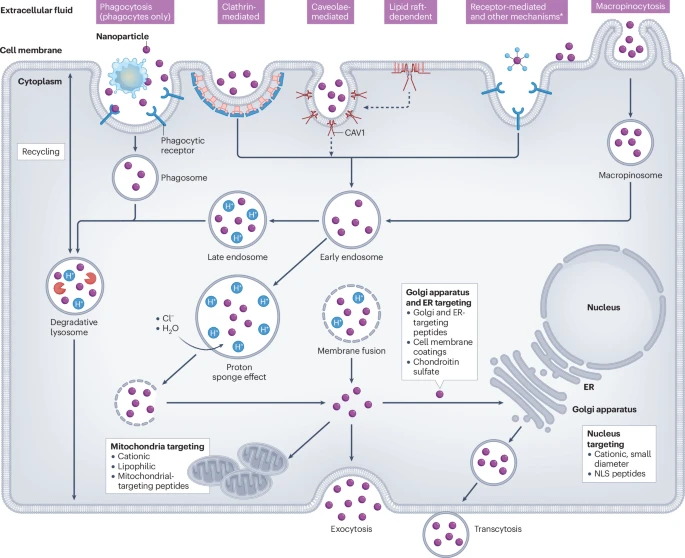
3.1 敲开细胞之门:细胞内吞机制的选择
由于尺寸较大,纳米颗粒无法自由穿过细胞膜,主要依赖于细胞的内吞作用 (endocytosis) 进入细胞。细胞内吞有多种途径,如网格蛋白介导的内吞 (CME)、小窝蛋白介导的内吞等,就像进入一栋大楼有不同的门。纳米颗粒表面的化学性质,例如电荷和靶向配体,会决定它“敲”哪一扇门。例如,研究发现,透明质酸修饰的纳米颗粒倾向于通过CME途径进入卵巢癌细胞,而聚天冬氨酸修饰的颗粒则更喜欢小窝蛋白介导的途径。
3.2 “越狱”挑战:逃离内涵体-溶酶体
通过内吞进入细胞后,纳米颗粒会被包裹在一个叫做“内涵体”的囊泡中。这个囊泡会逐渐酸化,并最终与“溶酶体”融合。溶酶体是细胞的“消化系统”,充满了各种降解酶,如果药物不能及时从中“越狱”到细胞质中,就会被降解失效。因此,“内涵体逃逸”是细胞内药物递送的最大瓶颈之一。科学家们通过设计可离子化的脂质或具有“质子海绵效应”的聚合物,来破坏内涵体膜,帮助药物成功“越狱”。
3.3 室内导航:靶向亚细胞器
对于某些药物,如作用于DNA的化疗药或基因编辑工具,最终目标是细胞核。而另一些药物则需要进入细胞的“能量工厂”——线粒体,才能发挥作用。通过在纳米颗粒表面修饰核定位信号肽或线粒体靶向肽等“通行证”,可以实现更深层次的精准靶向。
第四章:未来展望——走向整合与智能化的新时代
为了将这些先进的设计理念转化为真正有效的临床疗法,未来的癌症纳米医学需要与工程学、数据科学和临床医学进行更深度的融合。
更逼真的“演练场”:利用类器官 (organoids) 和器官芯片 (organ-on-a-chip) 等先进的体外模型,可以在实验室中更好地模拟人体复杂的生理环境,用于筛选和评估纳米药物的性能,从而减少对动物模型的依赖。
大数据与人工智能的赋能:通过高通量筛选技术,可以快速合成并测试成千上万种不同设计的纳米颗粒。结合机器学习算法,可以从海量数据中挖掘出纳米颗粒的结构与药效之间的构效关系,从而预测和设计出性能更优的纳米药物,极大地加速研发进程。
迈向“个性化定制”:最终的目标是实现个性化的纳米医学。通过分析具体患者的肿瘤基因组信息、组织病理学特征(如血管密度、基质硬度等),未来有望为每一位患者“量身定制”出最适合其病情的纳米药物,从而实现治疗效果的最大化。
结语
癌症纳米医学正从一个依赖于简单物理原理的早期阶段,迈向一个以多层次、理性工程设计为核心的成熟新纪元。未来的纳米药物将不再是简单的药物“包裹”,而是一个高度集成的智能递送系统。通过灵活选择给药途径、巧妙运用非共价修饰技术进行“伪装”和“社交”、精准导航至目标细胞乃至细胞器,并结合人工智能和患者大数据进行优化设计,我们有理由相信,这一前沿领域将为攻克癌症带来更多、更有效的新武器。抗癌之战的“导航系统”正在经历一场深刻的技术革命,引领我们驶向更精准、更高效的未来。