💡【Nat.Rev.Chem.】一文看懂:超分辨显微镜领域最火的“7大”知识体系与探针革命!
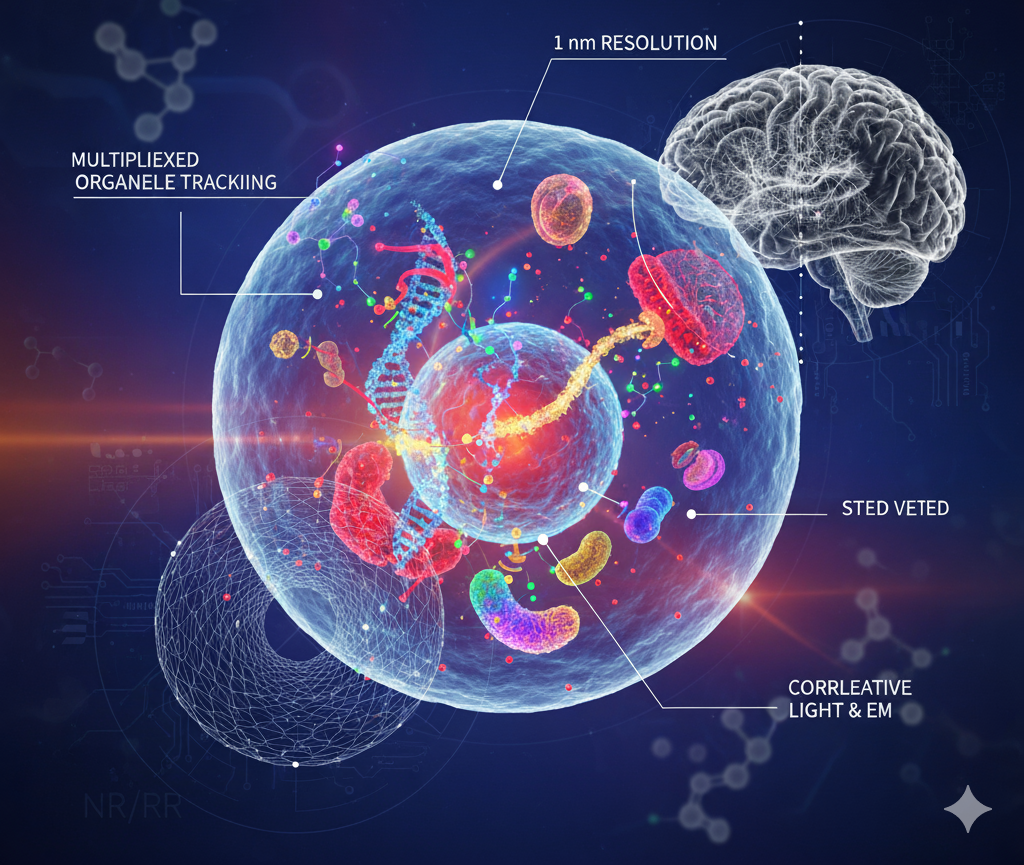
在生命科学领域,我们对细胞内部世界的探索从未停止。传统的显微镜受限于一个被称为**“阿贝衍射极限”的物理魔咒,无法看清小于约 200 纳米的精细结构,而细胞内的许多生命活动,例如蛋白聚集、染色质动力学、细胞器融合,都发生在 10 纳米甚至 1 纳米的纳米尺度** 。
为了打破这一限制,科学家们开发出了超分辨显微镜(Super-Resolution Microscopy, SRM),它像给生命科学装上了“超清摄像头” 。然而,再好的相机也需要清晰的“灯光”和“涂料”。传统的有机荧光染料(如 AlexaFluor)虽然常用,但普遍存在光漂白、斯托克斯位移窄和荧光寿命短等“硬伤” 。这些缺陷极大地限制了长时间、高强度照射下的活细胞动态观察。
一篇发表在《自然评论·化学》(Nature Reviews Chemistry)上的权威综述,系统性地梳理了近年来新兴的、最具颠覆性的探针体系——过渡金属配合物(Transition Metal Complexes, TMCs) 。本文将基于这篇综述,为你拆解这一领域的三大技术路径、四大核心挑战,以及未来的发展趋势,帮助你一窥纳米世界的终极奥秘!
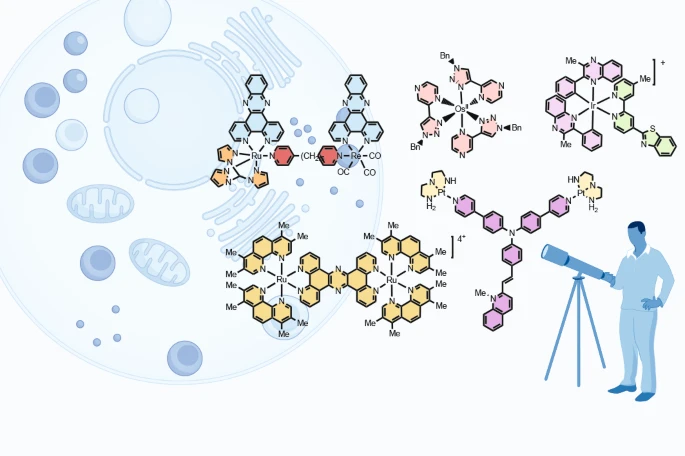
领域全景图与主要进展梳理:TMCs 的“三大技术路径”
过渡金属配合物凭借其可调控的光激发态和卓越的抗光漂白稳定性,正在成为超分辨成像领域的核心工具 。根据其金属中心和核心应用,我们可以将其系统性地归纳为三大技术路径:
路径一: 构型配合物——经典 SRM 的“主力军”
以第二行和第三行过渡金属离子为中心的配合物,例如钌(Ru)、锇(Os)和铱(Ir),是 SRM 探针的经典代表 。它们具有 电子构型,形成了低自旋、抗磁性的配合物,其优势在于:
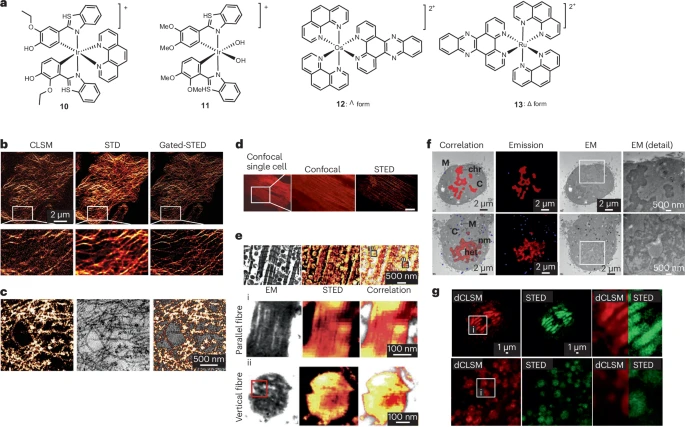
超高光稳定性和长寿命:这些配合物通常在基态和光激发态都具备动力学惰性,抗光漂白能力极强 。它们通过高效的系间窜越()形成三重态金属到配体电荷转移(MLCT)激发态,这导致了相对长的发射寿命(如 Ru(II) 配合物在有氧水溶液中约为 ,Ir(III) 约为 ) 。
- 应用:这种长寿命特性使其成为 荧光/磷光寿命成像(FLIM/PLIM) 的理想选择,可以轻松区分短寿命的自发荧光,实现多重成像 。
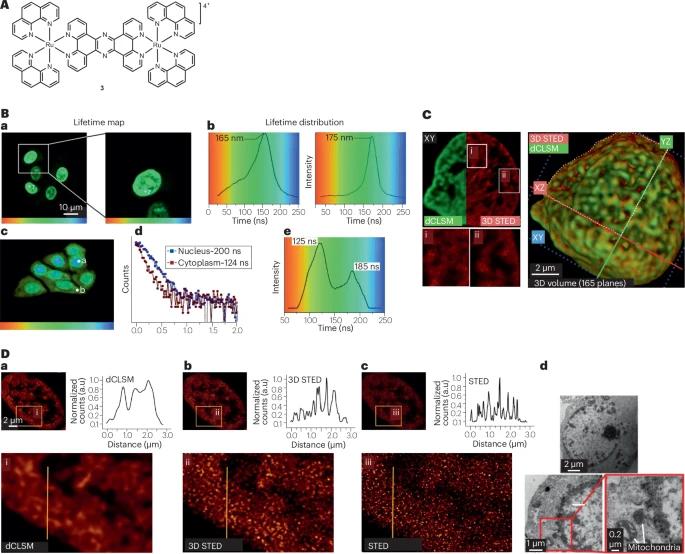
大斯托克斯位移和远红光发射:由于发射源于三重态,它们通常表现出大于 的大斯托克斯位移 。这对于依赖高强度耗尽激光的 受激发射损耗显微镜(STED) 至关重要,可有效避免激发光与耗尽光之间的相互干扰,提高成像质量 。
- 应用:例如,Ru(II) 配合物 3 具有 的大斯托克斯位移,完美匹配 的 STED 耗尽光,适用于门控 STED(Gated STED),用于核 DNA 成像 。Os(II) 配合物甚至能将发射波长推到 ,实现近红外 STED 。
路径二:CLEM 探针——光学与电子显微的“跨界融合”
CLEM(Correlative Light and Electron Microscopy, 相关光电显微镜)的目标是结合 SRM 的高选择性与 EM 的超高分辨率。TMCs 在这方面的优势在于其独特的双功能性:
电子致密性:第二行和第三行过渡金属原子(Ru, Ir, Os)具有较高的原子序数,使配合物分子本身就是电子致密的 。这意味着它们在透射电镜(TEM)中可以直接作为对比剂,无需传统复杂的重金属染色步骤,从而减少样品制备对细胞结构的破坏。
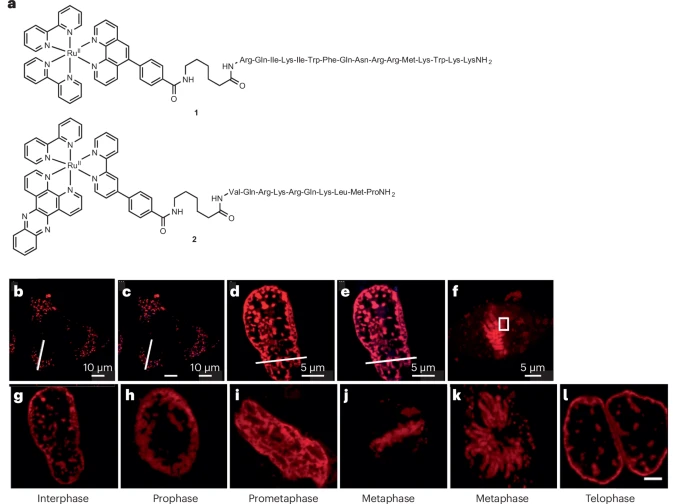
高精度定位:例如,Ir(III) 配合物 10 和 11 既能通过 STED 实现微管和肌动蛋白丝的超分辨成像,又能作为 TEM 对比剂。通过这种方式,研究人员得以以亚纳米级分辨率识别细胞内单个微管或肌动蛋白丝,实现了真正的超分辨 CLEM 。
- 应用:Chiral Os(II) 配合物 12 和 Ru(II) 配合物 13 不仅是 DNA 光开关探针,还被用于实现核 DNA 甚至有丝分裂过程中染色体聚集的 CLEM 图像 。
路径三:第一行金属配合物——成本效益与多模态的“新兴力量”
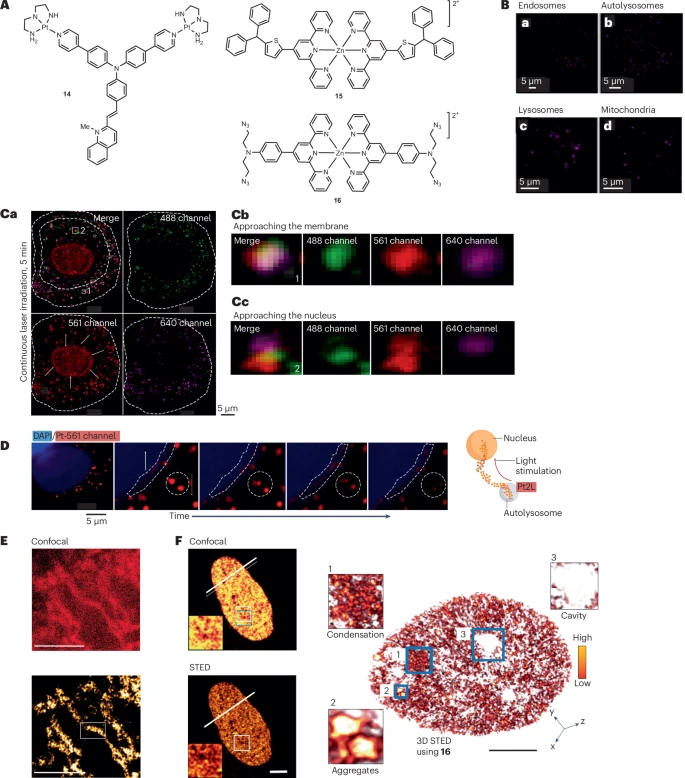
尽管 Ru、Ir、Os 效果突出,但它们属于贵金属,成本较高 。以锌(Zn)、锰(Mn)为代表的第一行过渡金属配合物因其地壳丰度高、成本效益好,正成为一个有吸引力的替代方案 。
配合物( 构型):由于 轨道已填满,排除了金属中心态(Metal-Centered States)的干扰,使得 MLCT 激发态相对更稳定,光物理性质得以利用 。
- 应用:Zn(II) 配合物 15 通过靶向线粒体 DNA,实现了活细胞 STED 成像,清晰地展示了线粒体内膜的嵴结构 。Zn(II) 配合物 16 则被用于可视化组蛋白乙酰化导致的染色质凝集形态变化 。
配合物( 构型):Mn(II) 的优势在于其顺磁中心,使其具备 **MRI(磁共振成像)**活性,从而实现光学显微和 MRI 的多尺度、多模态成像 。
- 应用:Mn(II) 配合物 17 实现了对完整小鼠大脑的 MRI 增强对比成像,同时其荧光特性还能通过 STED 观察脑切片中神经轴突的髓鞘结构 。Mn(II) 配合物 18 则被用于高分辨率 STED 成像核仁 RNA,揭示了核仁内的致密纤维组分(DFC)和纤维中心(FC)等精细结构 。
关键挑战与争议热点分析:TMCs 探针的“四大未解之谜”
尽管 TMs 配合物展现出巨大潜力,但该领域仍面临共同的挑战和一些亟待解决的难题。综述文献对这些挑战进行了精辟的总结:
挑战一:探针特性与 SRM 模式的“适配”难题
超分辨技术并非“一招鲜吃遍天”,不同的 SRM 模式对探针有截然不同的要求 。这是当前探针设计中最大的适配挑战:
STED/SIM 的要求:需要探针具有极高的光稳定性(抗光漂白)和大斯托克斯位移(避免再激发),以承受高强度耗尽激光并获得更长的观察时间 。TMCs 在这方面表现优秀。
SMLM(STORM/PALM)的要求:需要探针具备极低的荧光开/关占空比(on-off duty cycle) 。这意味着探针必须能在“开”和“关”状态之间高效地、随机地切换,并且“开”的时间要足够短,以避免空间上激活的探针发生重叠 。
- 争议热点:综述指出,目前在 STORM/PALM 等随机成像技术中,探索 TMs 配合物作为探针的活动量“出奇地少” 。尽管已有 (salen)配合物成功作为线粒体 STORM 探针的案例,证明 TMs 的发光特性可与随机 SRM 技术兼容 30303030,但该领域仍是研究的真空地带。
挑战二:第一行过渡金属的“先天不足”
尽管 配合物( 构型)表现良好,但对于其他第一行 构型金属(如 ),其应用受到了内在物理限制的困扰 31313131:
激发态不稳定:与第二行和第三行金属相比,第一行过渡金属的晶体场分裂较小 。这导致其激发态更容易布居到能量较低的金属中心态(MC 态)(如 MC 和 MC) 。MC 态是非辐射衰减的有效途径 34,从而导致激发态寿命更短、光稳定性更差。
技术瓶颈:这种“先天不足”解释了为什么目前高性能的 SRM 探针仍主要集中在 等贵金属上。要解决此问题,需要精巧的螯合配体设计,以提高 MLCT 态的能量,同时压低非辐射衰减的 MC 态能量,从而开发出具有亚稳态(寿命 )的第一行过渡金属配合物 。
挑战三:成像应用中的“双刃剑”:光毒性
在高强度激光照射下,所有荧光探针都面临**光毒性(Phototoxicity)**的风险,这是活细胞成像的共同难题 。
活性氧的生成:探针的光漂白常常导致**活性氧(ROS)**的产生 。
Type I 反应:光激发态的探针通过直接氧化还原反应生成超氧化物、过氧化物等 ROS 。
Type II 反应:探针的三重态通过能量转移过程生成 单线态氧 。
平衡点:在光学生物成像中,研究人员必须选择亮度高、发射能量相对低的探针,并结合低强度激光源和低探针浓度,将 Type I 和 Type II 过程最小化 。这要求探针设计必须在发光效率和ROS 产生效率之间找到微妙的平衡点。
挑战四:复杂生物环境下的“递送与干扰”
在实际应用中,尤其是在厚组织成像中,探针仍面临诸多限制:
非均匀递送:在厚组织或致密组织样本中,探针的淬灭(quenching)和非均匀递送会严重影响其有效性和成像质量 。
靶向性挑战:虽然 TMCs 的配体功能化提供了靶向细胞器的可能 42,但实现对肿瘤微环境中免疫细胞、基质或恶性细胞等复杂多组分的多重靶向,仍是一个挑战,但具有重要的转化医学价值 。
趋势展望与未来应用:迈向 级分辨率的“终局”
基于上述的挑战与突破,过渡金属配合物在超分辨显微镜领域的未来发展趋势可以归纳为以下几点:
奔向 极限分辨率:随着 MINFLUX 等新兴技术的出现,活细胞成像的空间分辨率已经声称可达惊人的 1 纳米,时间分辨率达到毫秒级 。未来,探针的设计必须专门针对 MINFLUX 等下一代技术的需求,提供具有高度明确光物理和生物物理特性的专用探针 。
SMLM 探针的“补课”:针对目前探索不足的 STORM/PALM 领域,将会有更多的研究集中于设计具有高荧光“开/关”比率和高特异性的 TMs 配合物,以克服随机成像的技术瓶颈 。
多重成像(Multiplexing)的成熟:未来将重点识别具有明显不同发光衰减曲线(Lifetime)的细胞器特异性 TMs 配合物,以实现多个细胞器(如线粒体、溶酶体、核仁)的同时成像,从而精细地检查细胞器之间的微妙相互作用 。
CLEM 探针的标准化:专用 CLEM 探针的开发将继续深化,以实现荧光图像与电子图像的精确叠加 。这种光电双功能探针的标准化,将为研究细胞超微结构和动态细节提供无与伦比的工具。
总而言之,过渡金属配合物作为一种高度可设计、高稳定性的荧光探针,正在引领 SRM 领域的新一轮技术革命。它们不仅帮助科学家打破了阿贝衍射极限,更通过多功能和多模态的设计,为我们提供了从宏观组织到 纳米分子细节的全尺度成像解决方案,有望在癌症诊断、神经退行性疾病研究等领域带来革命性的应用前景。
参考文献:
Sumit Kumar Pramanik, Sreejesh Sreedharan, Noufal Kandoth, Jorge Bernardino de la Serna, Amitava Das & Jim A. Thomas. Transition metal complexes as optical probes for super-resolution microscopy. Nature Reviews Chemistry. DOI: 10.1038/s41570-025-00764-w.