【JACS】精准“炸弹”!新一代化疗药效率狂飙10倍,仅对白血病细胞开启9.8倍荧光信号大门!
✨文章标题:Hypochlorous Acid-Gated Hydrolysis of a Phosphinate Ester Dye in Living Cells ✉️作者: Cliff I. Stains 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c12615
化疗的困境与“智能药物”的诞生
在与癌症的长期搏斗中,化疗无疑是人类手中的一把重要武器,但它同时也是一把双刃剑 。传统的细胞毒性化疗药物,如同不加区分的“地毯式轰炸”,在杀伤癌细胞的同时,也会对体内健康的细胞造成严重附带伤害,导致患者生活质量急剧下降,甚至引起治疗相关的并发症或死亡 。这是当前肿瘤治疗中一个亟待解决的核心痛点。
为了减轻这种“脱靶效应”,科学家们提出了“治疗诊断学”(Theranostics)平台,目标是开发出既能精确靶向癌细胞,又能实时监测药物递送过程的智能分子平台 。然而,传统的智能分子通常设计复杂,需要在一个分子上集成荧光报告基团、反应性连接子、靶向配体和药物分子等多个部分,导致分子量过大,反而影响了细胞的摄取效率 。
有没有一种方法,可以大大简化分子结构,同时实现药物的“智能门控释放”和“实时光学监控”呢?
这就是弗吉尼亚大学Cliff I. Stains教授团队在这篇《JACS》重磅研究中给出的颠覆性答案。他们首次直接证明了利用一种简化的磷酸酯染料——Nebraska Red(NR)染料,可以实现小分子药物的“门控递送” 。这种简化的系统将荧光报告基团、反应性连接子和潜在的靶向功能集成为一个单一的物种——即磷酸酯染料本身,有望从根本上解决分子结构复杂、分子量过大的问题 。
他们设计的这种分子,就像一个携带药物的“智能包裹”,只有在遇到急性髓系白血病(AML)细胞中特有且高水平存在的生物标志物时,才会触发水解,释放出药物和荧光信号,从而实现极高的选择性和光学可追踪性 。这项技术,为开发具有更低脱靶效应、更优临床结果的精准医学药物,开辟了一条激动人心的新路径 。
核心方法与技术细节解密:如何用“一把钥匙”打开“两扇门”?
核心机制:磷酸酯染料的“门控水解”
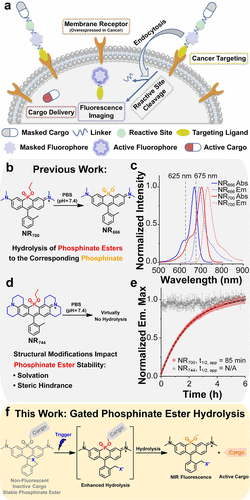
该研究的核心创新,在于利用了磷酸酯水解速率的可调控性和氧化还原反应的门控作用 。
在正常的生理条件下,某些NR磷酸酯衍生物(如)在的条件下几乎不发生水解,表现出极高的稳定性 。研究团队的机制分析表明,磷酸酯水解是一个二级反应,其限速步骤是五价中间体被羟基阴离子攻击后形成的五价中间体的塌陷 。增加这个中间体的空间位阻,会阻碍溶剂化作用,从而极大地提高其稳定性,使得水解几乎停止 。
该团队的设想是:如果能通过一个外部“触发器”的反应,来改变这个染料分子的整体电荷和结构,使得原本稳定的磷酸酯结构发生“增强型水解”,那么就能实现药物的 “门控释放” 。
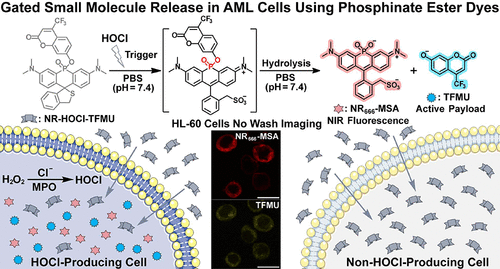
“智能包裹”:NR-HOCI-TFMU的精妙设计
基于上述理论,研究人员设计并合成了一个关键的“治疗诊断”探针:NR-HOCI-TFMU 。
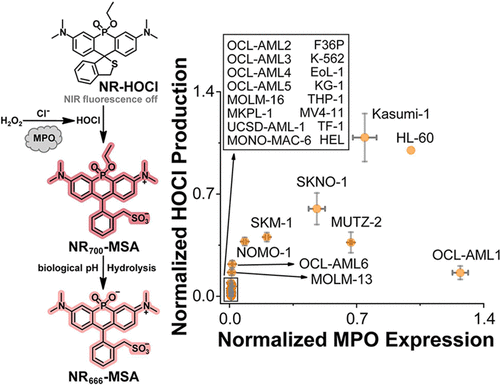
“门控开关”(Trigger):他们选择的是次氯酸(HOCl)。HOCl是髓过氧化物酶(MPO)的酶促产物,在急性髓系白血病(AML)细胞中被发现异常高表达和非受限地产生 。因此,HOCl可以作为特异性识别AML细胞的“钥匙” 。
“药物载体”(Platform):使用Nebraska Red(NR)磷酸酯染料作为核心支架 。
“药物分子”(Cargo):选择4-(三氟甲基)伞形酮(TFMU)作为模型药物,TFMU具有酚羟基,可以连接到磷酸酯上,并且自身具有蓝色荧光,便于直接可视化药物的释放 。
在NR-HOCI-TFMU中,HOCl的触发机制是:
第一步:门控开启。 在AML细胞中,内源性HOCl与NR-HOCI-TFMU中的螺环硫醚(Spirocyclic Thioether)结构发生反应 。这个氧化反应会使原本不发荧光、呈中性的分子,转化为一个带电荷(两性离子)、且具有NIR近红外荧光的中间体(-HOCI的类似物) 。
第二步:增强型水解。 分子电荷和结构的改变(从非荧光、中性到荧光、两性离子)大大降低了磷酸酯的稳定性,从而增强了磷酸酯键的水解速率 。
第三步:药物与荧光信号释放。 磷酸酯键水解,同时释放出两个产物:
成像报告分子:-MSA(具有近红外(NIR)荧光,适用于深层组织成像) 。
活性药物分子:TFMU(具有蓝色荧光) 。
这整个过程,就像一个“双保险”的智能包裹:HOCl是唯一的启动钥匙,它不仅开启了近红外荧光信号(用于实时监测),还触发了药物的快速、定向释放 。
酚羟基的秘密:选择最优“栓子”
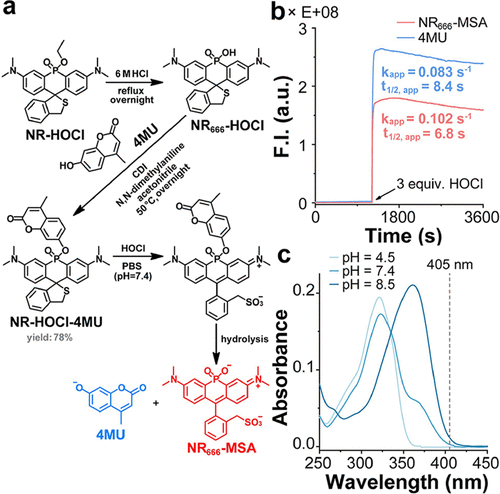
为了确保药物在没有HOCl时绝对稳定,研究团队对连接药物的酚羟基的进行了筛选。结果发现,具有较低 的酚(如NBD-OH ,Resorufin )与NR染料形成的磷酸酯极不稳定,Resorufin衍生物甚至在冷冻干燥过程中就发生了分解和药物泄漏 。
最终,他们定义了对于这种-HOCI(四甲基罗丹明类似物)骨架,酚羟基的底物是最佳选择,以保证磷酸酯在生理条件下(PBS中)能保持数天稳定,不发生泄漏 。他们选择的TFMU的为,满足了这一“高稳定性” 要求 。 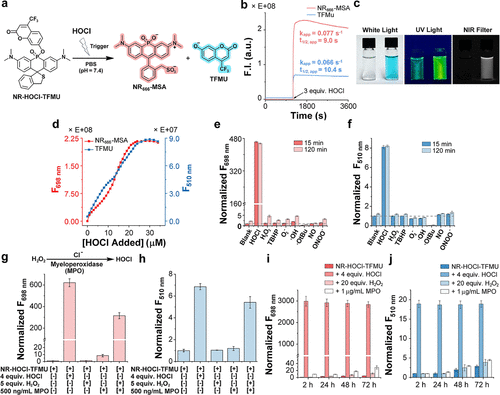
数据背后的创新与颠覆性分析:9.8倍选择性与“毒性逆转”
该研究通过一系列严谨的体外、细胞和动物实验,获得了多项具有突破性冲击力的关键数据。
1. 毫秒级快速释放,NIR荧光是药物释放的“完美代理解”
在体外实验中,NR-HOCI-TFMU加入3当量的HOCl后,近红外荧光 (-MSA) 和蓝色荧光 (TFMU) 的信号同时急剧增加 。
-MSA生成(NIR信号)的表观一级反应速率常数 () 为 。
TFMU生成(药物释放)的表观一级反应速率常数 () 为 。
这表明TFMU药物的释放是紧随HOCl反应之后快速发生的,半衰期仅为约9到10秒 。更重要的是,-MSA的近红外荧光强度与TFMU的释放量直接成正比 。在加入4.5当量的HOCl后,NIR信号增强了惊人的1646倍,蓝色信号增强了18倍,随后信号进入平台期 。这一发现具有颠覆性意义:未来的药物平台,不再需要额外的复杂设计来监测药物,直接通过NIR荧光信号,就能实时、定量的监测药物在体内的递送和释放程度 。 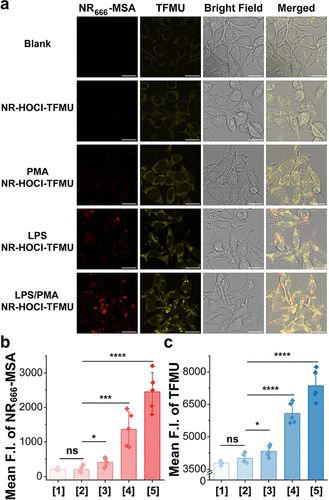
此外,NR-HOCI-TFMU对其他常见的活性氧/氮物种(如、TBHP、、OH、NO、ONOO等)显示出极高的选择性。在5倍于HOCl的过量浓度下,这些物质在2小时内均未引起任何明显的-MSA或TFMU信号的产生。其对HOCl的检测限(LOD)可达,与已知的高灵敏度探针相当 。
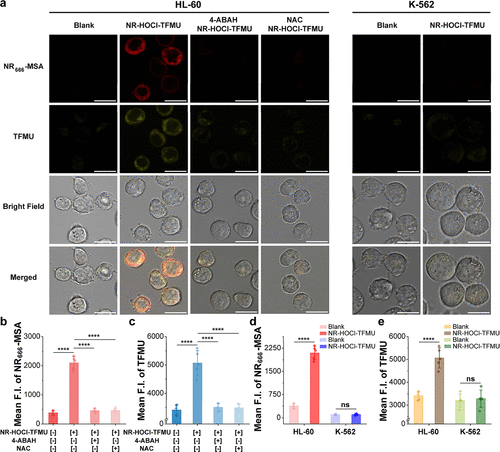
2. 活细胞中的9.8倍选择性:精准靶向AML细胞
研究人员在活细胞中验证了这种“门控释放”机制的超高选择性:
HL-60细胞(HOCl高产出AML细胞):与未处理的空白对照组相比,NR-HOCI-TFMU在HL-60细胞中引起了-MSA信号5.5倍的增强和TFMU信号1.5倍的增强 。
K-562细胞(HOCl低产出CML对照细胞):在K-562细胞中,未观察到任何-MSA或TFMU荧光信号的明显增加 。
抑制剂验证:如果用MPO抑制剂(4-ABAH)或活性氧清除剂(NAC)预处理HL-60细胞,荧光信号会降至背景水平 。
在诱导型巨噬细胞(RAW 264.7)中,经LPS和PMA刺激后产生HOCl,-MSA信号的增强更是达到了惊人的9.8倍,TFMU信号增强了1.9倍 。
这一系列数据强有力地证明了该平台成功实现了药物释放的细胞内“门控”,即:只有在HOCl高表达的“靶细胞”中,药物和NIR信号才会被有效释放,而在对照细胞中则保持“沉默”状态 。
3. 动物模型中的共定位与药效“逆转”
在荷瘤小鼠模型中,研究人员将高HOCl的HL-60-Luc2肿瘤和低HOCl的K-562-Luc2肿瘤分别接种到小鼠体内 。
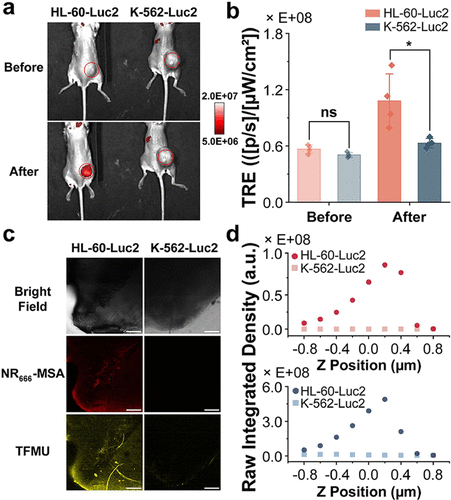
体内成像:在注射NR-HOCI-TFMU后,HL-60-Luc2肿瘤的NIR荧光 (-MSA) 增强了1.9倍,而K-562-Luc2肿瘤则没有显著增强 。
离体验证:对肿瘤切片进行共聚焦成像,清晰地看到-MSA和TFMU的荧光信号仅在HL-60-Luc2肿瘤中出现并共定位 。
最令人震惊的发现来自细胞毒性实验。TFMU本身是无毒性的 。在长达24小时的孵育中,NR-HOCI-TFMU在HOCl低产出的K-562细胞中,即使浓度高达也几乎没有毒性 。
然而,在HOCl高产出的HL-60细胞中,50 的NR-HOCI-TFMU在24小时后导致细胞活力下降了50% 。
为了确定这种毒性来自于NR骨架还是TFMU,他们又用MPO基因敲除(MPO-knockout)的HL-60细胞进行实验 。结果是:
在MPO敲除的HL-60细胞中,NR-HOCI-TFMU和NR-HOCI(不含TFMU的类似物)的毒性几乎完全消失,细胞活力与对照组相当 。
在野生型HL-60细胞中,NR-HOCI和NR-HOCI-TFMU表现出相似的毒性谱,在下均导致超过50%的细胞死亡 。
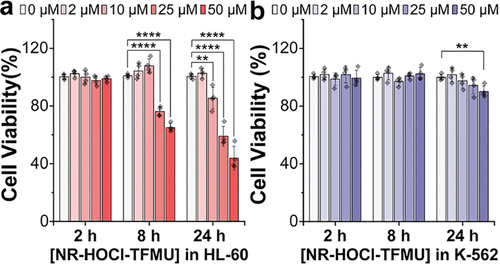
这一关键的 “毒性逆转” 数据,彻底证明了细胞毒性是严格由HOCl“门控”的,且毒性很可能来自HOCl反应后生成的 -MSA近红外染料骨架本身 。这为进一步研发提供了两个令人兴奋的方向:一是利用NR骨架本身的细胞毒性;二是将更强效的细胞毒性药物连接到该平台上 。
这一系列的严谨数据,无可辩驳地表明了HOCl-门控磷酸酯水解策略在选择性药物递送方面的巨大潜力 。
应用展望、局限性与未来路线图:精准医疗的下一站
应用展望与潜在影响
这项研究首次证明了磷酸酯染料可以作为一种高度简化的智能平台,实现小分子药物在活细胞和动物模型中的HOCl门控递送 。
精准抗癌: 由于HOCl在大多数AML患者的癌细胞中异常高表达,但其在正常生理中被严格限制在吞噬性白细胞(如激活的中性粒细胞和巨噬细胞)的吞噬体中 ,因此,基于HOCl的门控系统,可以实现对AML细胞的超高选择性靶向,大大降低传统化疗的脱靶效应 。
实时监测: -MSA的NIR荧光可以作为药物释放的直接光学代理,实时监测药物递送的部位和程度,这对于未来临床试验中评估疗效和副作用至关重要 。
普适性平台: 这种磷酸酯水解门控策略不仅限于HOCl。鉴于许多疾病相关的分析物或酶活性都可以通过螺环开环策略来感应,该方法可以推广到针对其他疾病标志物(如其他活性氧/氮物种、甲醛、重金属等)的精准治疗剂开发中 。
局限性与未来路线图
尽管成果喜人,研究团队也客观地指出了该平台的当前局限性以及下一步的攻关方向 。
药物效力: 目前的模型药物TFMU本身无毒,而观察到的毒性主要来自-MSA骨架,且效力较低(,24小时) 。未来的工作将集中于将更强效的细胞毒性药物(如微管聚合抑制剂、DNA烷基化剂等)连接到磷酸酯位点上,以期大幅提高对HOCl阳性细胞的杀伤效率 。
体内稳定性与药代动力学: 需进一步解决磷酸酯在血液循环中的稳定性问题,以及其到达目标肿瘤和细胞的能力 。
潜在脱靶风险: 虽然AML患者多伴有中性粒细胞减少症(Neutropenia),降低了在正常激活的白细胞中脱靶释放的风险 ,但仍需通过严格的动物模型(Preclinical testing)来全面评估潜在的脱靶毒性,例如在激活的巨噬细胞或中性粒细胞中 。
总而言之,这项工作为新一代低分子量、可成像的智能治疗诊断剂提供了强大的概念验证 。通过将靶向、连接子和报告功能集成到单一的磷酸酯染料分子中,它有望克服传统复杂探针的缺点,为开发针对AML及更广泛疾病的精准药物递送平台奠定基石 。