【JACS】炸裂!首款病毒“特洛伊木马”近红外荧光探针:寨卡病毒感染M1巨噬细胞特异性暴涨25倍,或能提前阻断病毒入脑!
✨文章标题:Activatable Fluorescent Probes for In Vivo and Ex Vivo Dynamic Profiling of Virus-Infected Macrophages ✉️作者:Yan Zhang 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c15321
从“痛点”到“突破”:为什么看不见是最大的难题?
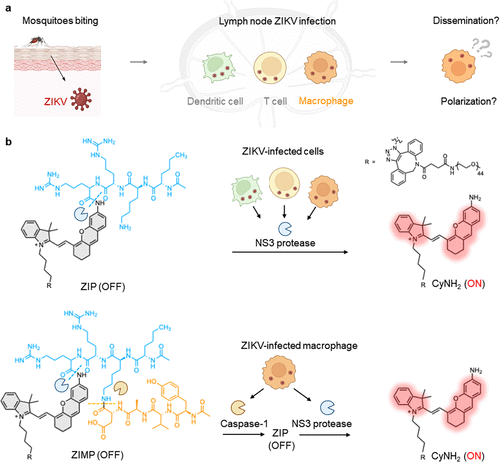
在全球公共卫生的威胁名单上,病毒无疑占据着最令人头疼的位置。它们不仅能直接攻击我们的器官,更狡猾的是,一些病毒会劫持人体内的“免疫卫兵”——巨噬细胞,将其转化为病毒复制和传播的“特洛伊木马” 。
巨噬细胞,这种作为人体内主要的吞噬细胞,本应是抗病毒的主力军,但它们扮演的角色却充满矛盾 。一旦被病毒感染,它们会发生功能极化,决定着是促进抗病毒防御,还是反过来促进病毒的持续存在和传播 。寨卡病毒(ZIKV)就是其中一个典型的例子,它与神经系统疾病和先天性异常相关,其传播路径与感染的免疫细胞息息相关 。
然而,要理解巨噬细胞在病毒感染后如何极化、迁移和传播的详细机制,我们却面临着一个巨大的技术“盲区” 。传统的检测方法,如流式细胞术和免疫染色,大多是侵入性的,无法对体内病毒感染的巨噬细胞进行实时动态监测 。缺乏这种实时、非侵入性的分析工具,使得病毒感染后巨噬细胞极化的动态过程及其在病毒传播或限制中的确切作用,至今仍知之甚少 。
想象一下,你面对一个即将引爆的炸弹(病毒入脑),但你却无法实时追踪那个携带炸弹的“特洛伊木马”(受感染的巨噬细胞)正走向何方。这就是当前抗病毒研究中的核心痛点。
为了打破这个僵局,华中科技大学和东南大学的研究团队带来了一项颠覆性的解决方案:开发出两款可激活的近红外荧光探针——ZIP和ZIMP 。这项研究不仅首次实现了对病毒感染的免疫细胞的动态分析,更重要的是,它提供了一种全新的工具,有望帮助我们在病毒进入中枢神经系统前,提前锁定并阻断这条“特洛伊木马”的传播路径,为早期诊断和抗病毒治疗筛选带来革命性的影响 。
核心方法与技术细节解密:打造病毒追踪的“双重锁”探针
这项研究的精妙之处,在于其探针的设计采用了 “逻辑门控” 的思路,通过结合病毒特有的酶和宿主细胞特有的标志物,实现了前所未有的检测特异性 。
研究团队设计了两种近红外荧光(NIRF)探针,它们都基于一种名为 的半花菁荧光团骨架构建,这种荧光团在被肽底物笼罩时处于“熄灭”(OFF)状态,一旦肽链被切割,荧光团就会被释放,发出明亮的近红外光(ON),实现“激活” 。
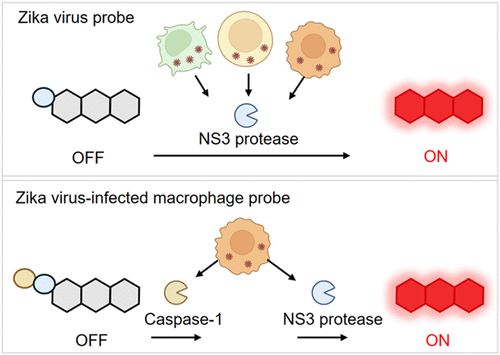
1. 单锁探针 ZIP:病毒感染的“通用警报”
首先是ZIP (ZIKV-infected cells Probe),这是一种“单锁”探针,用于广泛检测所有被寨卡病毒(ZIKV)感染的细胞 。
激活机制: ZIP被设计为专门响应寨卡病毒NS3蛋白酶的活性 。NS3蛋白酶是寨卡病毒复制和多蛋白加工的关键病毒酶 。
工作原理: 研究者将一段特异性靶向NS3蛋白酶的肽底物共轭到 荧光团上 。当细胞被ZIKV感染时,NS3蛋白酶大量表达并被激活 。ZIP进入细胞后,如果遇到活跃的NS3蛋白酶,其肽链就会被NS3切断,释放出 荧光团,从而发出近红外荧光信号 。
功能: 这种单锁机制确保了ZIP能广泛检测所有正在进行病毒复制的ZIKV感染细胞,就像一个针对病毒存在的“通用警报” 。
体外实验证实,ZIP在与NS3蛋白酶孵育后,荧光强度显著增加了7.95倍,而在缺乏NS3的情况下则没有变化 。
2. 双锁探针 ZIMP:精准定位“特洛伊木马”巨噬细胞
真正实现突破的是ZIMP (ZIKV-infected Macrophage Probe),这是一种创新的“双锁”探针,用于特异性识别被ZIKV感染的巨噬细胞 。
激活机制: ZIMP的激活需要双重条件:一是寨卡病毒的NS3蛋白酶活性(证明病毒感染),二是Caspase-1(Cas-1) 的活性(巨噬细胞高表达的标志物) 。
工作原理: ZIMP在ZIP的结构基础上,进一步引入了一段针对巨噬细胞标志物 Caspase-1的特异性肽底物 。Cas-1是巨噬细胞中过度表达的酶,与炎症小体的激活相关 。
串联“双保险”: ZIMP的设计巧妙地形成了一个串联逻辑门。要激活ZIMP的荧光,必须先由Cas-1切割掉第一段肽链,露出ZIP的中间体结构,随后ZIP中间体再被NS3蛋白酶切割,最终释放 荧光团,激活NIRF信号 。用一个生动的类比来说,ZIMP就像一扇有两个锁的门:Cas-1是第一把钥匙(巨噬细胞的身份),NS3是第二把钥匙(病毒感染的证明) 。只有这两把钥匙同时存在,门才能打开(荧光激活)。
这种双锁机制确保了ZIMP的超高特异性:它只在“被ZIKV感染”的“巨噬细胞”中发光,实现了对“特洛伊木马”的精准锁定 。
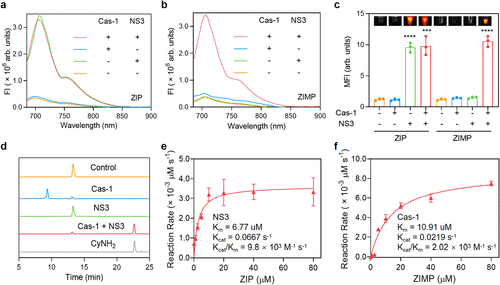
体外实验也严格证实了这一点:ZIMP只有在同时与Cas-1和NS3孵育时,才会激活荧光,荧光强度增加了8.82倍,而在单独与Cas-1或NS3孵育时,均无明显变化,充分证明了其对两种酶的串联切割特异性 。此外,研究者还通过高效液相色谱(HPLC)证实,ZIMP的裂解需要Cas-1和NS3共同作用才能产生最终的荧光团 产物 。
在活性方面,NS3对ZIP的催化效率()为 ,Cas-1对ZIMP的催化效率()为 ,均显示出良好的敏感性 。
数据背后的创新与颠覆性分析:追踪“木马”入脑的路线图
这项研究最引人注目的部分,是利用ZIP和ZIMP这两把“钥匙”在活体小鼠和离体细胞中,首次揭示了寨卡病毒感染和传播的动态过程,特别是病毒如何利用巨噬细胞实现全身播散。
1. 细胞水平的精准区分:ZIP和ZIMP的“分工”
在细胞实验中,研究者使用了两种细胞模型:Vero细胞(非免疫细胞)和骨髓来源的巨噬细胞(BMDMs) 。所有细胞均用寨卡病毒感染24小时,然后与探针孵育。
ZIP的表现: 像预期的“通用警报”一样,ZIP在被感染的Vero细胞和被感染的BMDMs中都显示出强烈的荧光信号 。这证实了ZIP能够广泛检测病毒感染细胞 。
ZIMP的突破: ZIMP则表现出极高的选择性。它仅在被ZIKV感染的BMDMs中显示出增强的荧光,其强度比对照组(包括被感染的Vero细胞、非感染细胞以及经过NS3抑制剂处理的BMDMs)高出约14.26倍 。这无可辩驳地证明了ZIMP对“寨卡病毒感染的巨噬细胞”的特异性识别能力 。
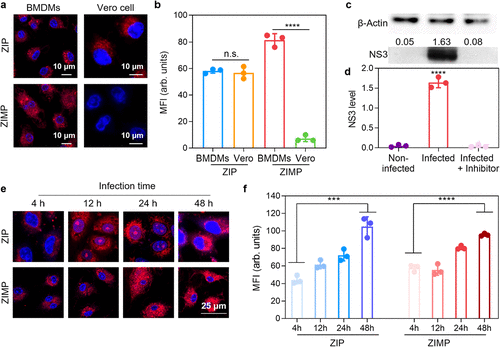
此外,这种巨噬细胞特异性信号与细胞内NS3和Cas-1的水平呈强烈的正相关 。Western blot分析显示,在ZIKV感染的BMDMs中,NS3的表达水平比未感染的对照组高出32.60倍 。同时,流式细胞术分析显示,感染的细胞群中Cas-1的激活增加了3.87倍 。探针的荧光激活与病毒感染时间呈依赖性增加,进一步体现了其作为病毒复制监测工具的潜力 。
2. 活体追踪:M1巨噬细胞在淋巴结中的“招募与极化”
为了模拟病毒的自然感染途径,研究人员通过小鼠足垫注射ZIKV,然后监测病毒引流淋巴结(LNs)中的感染动态 。
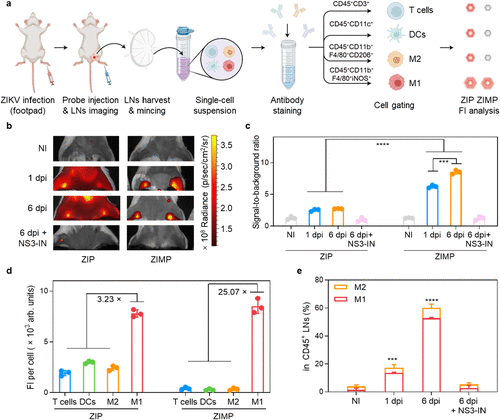
在活体小鼠实验中:
在感染后第1天(1 dpi),ZIP和ZIMP在感染小鼠的淋巴结中都显示出显著升高的荧光信号,分别比未感染组高出10.72倍和9.55倍 。
关键的动态变化出现在感染后第6天(6 dpi):ZIP的信号强度保持相似,但ZIMP的信号进一步增加了1.27倍 。这表明,随着感染时间的延长,受感染的巨噬细胞群体在不断扩大,而其他被感染的免疫细胞则保持在稳定状态 。
更具颠覆性的是,ZIMP的信噪比(Signal-to-background ratio) 比ZIP高得多,在1 dpi和6 dpi分别高出2.58倍和3.12倍 。这证明了ZIMP作为高度特异性活体探针的优越性。此外,NS3抑制剂能有效地抑制这两种探针的激活,将荧光水平降至接近非感染组,证实了信号的特异性来源于病毒NS3的活性 。
3. 颠覆性数据:M1巨噬细胞的“特异性暴涨”
为了深入了解病毒在淋巴结免疫细胞中的确切位置,研究人员对分离出的淋巴结细胞进行了流式细胞术分析。结果揭示了本研究最核心的颠覆性发现:M1型巨噬细胞是病毒最主要的受感染群体。
- ZIP的信号分析: ZIP的荧光在所有免疫细胞中均有检测到(包括T细胞、树突状细胞(DCs)、M2巨噬细胞和M1巨噬细胞),但在M1巨噬细胞中的信号最高,比其他免疫细胞高出3.23倍 。
- ZIMP的特异性确认: ZIMP的激活几乎完全集中在M1巨噬细胞中,其荧光强度比其他免疫细胞高出25.07倍 。
这个25.07倍的信号暴涨,是 ZIMP 探针特异性与病毒感染后 M1 巨噬细胞数量和活性的双重结合结果,完美地锁定了寨卡病毒感染后最具风险的“特洛伊木马” 。
此外,数据还显示,ZIKV感染后淋巴结中M1巨噬细胞的比例显著增加,在1 dpi和6 dpi分别比未感染小鼠高出9.83倍和37.69倍 。相比之下,M2巨噬细胞的增幅则小得多 。
这一系列结果共同描绘了一幅清晰的动态图景:寨卡病毒感染首先会招募巨噬细胞到淋巴结,并促使它们极化成M1表型 。这些对ZIKV高易感的M1巨噬细胞随后成为了病毒复制和传播的关键“宿主”或“载体” 。
4. 病毒入脑:M1巨噬细胞介导的“特洛伊木马”传播
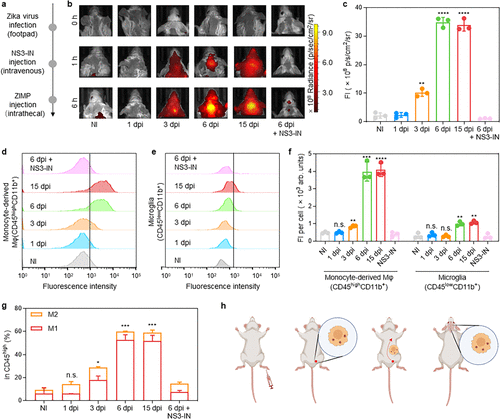
研究进一步将视野扩展到脑部,以探究ZIKV进入中枢神经系统(CNS)的机制 。通过鞘内注射ZIMP探针,研究人员实时监测了病毒在脑部的动态。
病毒入脑时间线: ZIMP的NIRF信号在感染后第1天(1 dpi)未见明显,但在3 dpi时信号增强了4.66倍,并在6 dpi达到峰值(增强15.97倍) 。
脑部细胞分析: 流式细胞术分析显示,ZIMP的荧光信号主要集中在单核细胞衍生的巨噬细胞(Monocyte-derived Macrophages, ) 中,在6 dpi和15 dpi分别增加了8.06倍和8.25倍 。
微胶质细胞的差异: 相比之下,ZIMP在 微胶质细胞(Microglia, ) 中的荧光信号显著延迟且有限,在6 dpi和15 dpi仅增加2.47倍和2.66倍 。
这证实了脑部感染的巨噬细胞主要来源于循环招募的单核细胞 。结合淋巴结和脑部的成像数据,研究者最终揭示了ZIKV传播的完整“特洛伊木马”路线图:ZIKV感染淋巴结 招募并感染单核细胞衍生的巨噬细胞 极化为M1巨噬细胞 这些受感染的M1巨噬细胞作为“特洛伊木马”载体,促进全身病毒播散至脑部 。
通过 ZIMP 实时追踪这一过程,研究者还成功地演示了利用 NS3 抑制剂进行及时治疗干预的潜力,有效抑制了探针的激活,使荧光信号降至接近非感染组水平 。
应用展望、局限性与未来路线图
这项研究不仅提供了强大的科学工具,其在应用层面的潜力更是巨大。
1. 广阔的应用前景
早期诊断与治疗筛选: ZIMP能够特异性追踪高风险的M1巨噬细胞,这意味着可以在病毒尚未大规模复制和致病前,实现对病毒播散风险的早期评估,并用于实时评估抗病毒药物的疗效 。
流式细胞术的革命: 值得注意的是,目前市场上没有商业抗体能够特异性地靶向这些被病毒感染的巨噬细胞表型 。ZIMP作为一种新型流式细胞术工具,可以替代复杂且耗时的细胞内染色过程,在数小时内提供结果,极大地简化和加速了对感染巨噬细胞的鉴定和表征 。
病毒免疫学的新视角: 这种双锁探针平台不仅限于ZIKV,其设计理念可以推广到其他劫持免疫细胞进行传播的病毒(如HIV、登革热病毒等) 。它为动态分析病毒感染的免疫细胞及其在病毒发病机制和免疫中的复杂作用提供了新的研究范式 。
2. 客观存在的局限性
尽管ZIMP展现了强大的潜力,但我们必须客观地认识到其局限性:
探针的生物分布: 尽管探针设计为近红外荧光(NIRF)以提高活体成像的穿透深度,但对于深层组织(如脑部)的长期、高分辨率活体成像仍然具有挑战 。鞘内注射给药方式在动物模型中有效,但在临床应用中需要开发更优化的、非侵入性的给药策略。
M1/M2极化动态的复杂性: 探针的特异性虽然高,但M1和M2巨噬细胞的极化是一个连续的光谱,而非简单的二元开关 。探针目前是针对M1型高表达的Cas-,但未来需要更精细的工具来捕捉巨噬细胞极化状态的细微变化。
病毒泛用性: 尽管原理可推广,但每一种新病毒都需要根据其特有的蛋白酶和宿主细胞标志物来重新定制探针的肽底物,这需要大量的结构活性关系(SAR)研究。
3. 未来路线图
未来的研究将沿着两个主要方向发展:
临床转化: 将ZIMP或基于类似原理的新型双锁探针进行优化,开发出毒性更低、体内稳定性更好、生物分布更理想的探针,以期用于临床的早期病毒感染诊断和抗病毒药物疗效的非侵入性监测。
多重追踪: 开发多色、多目标的激活型探针,实现对不同免疫细胞亚群、不同病毒感染阶段的同步动态追踪,从而构建更复杂的活体病毒免疫网络图景。例如,设计一个可以同时监测M1和M2极化的双通道探针。
总而言之,ZIP和ZIMP的诞生,不仅为寨卡病毒研究提供了一个前所未有的“GPS”,更重要的是,它为动态追踪病毒与免疫系统之间的复杂互动,开辟了一个全新的、实时可见的窗口。这项工作预示着,在不久的将来,我们或许可以提前一步,阻止那些携带病毒的“特洛伊木马”,大幅提升人类对抗病毒感染的胜算。