【JACS】准确率飙升!南京大学开发新型“侦察兵”:11.3倍信号增强,实时识破肿瘤免疫“伪装”
✨文章标题:A Fluorescence-Afterglow Reporter for In Vivo Differentiation of Three Tumor Immunophenotypes ✉️作者:Xu Zhen* 等 🔗链接:https://doi.org/10.1021/jacs.5c17176
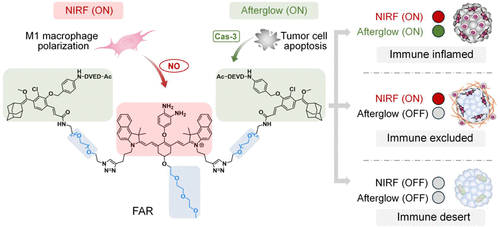
从“痛点”到“突破”:为什么免疫治疗总是“盲人摸象”?
在当代医学的版图上,癌症免疫治疗无疑是最具革命性的疆域。它不直接攻击癌细胞,而是通过激活人体自身的免疫大军来收复失地。然而,现实却十分骨感:尽管这一疗法在临床上创造了无数奇迹,但并非所有患者都能从中获益。
目前的困境在于,同一种癌症在不同患者身上,甚至同一患者的不同肿瘤结节里,其“免疫面貌”可能完全不同。有的肿瘤内部战火纷飞,免疫细胞奋勇杀敌;有的肿瘤则像一座孤岛,免疫细胞被挡在“围墙”之外;更有甚者,肿瘤内部是一片荒凉的“免疫沙漠”。
医生如果想了解肿瘤的内部情况,传统手段通常是穿刺活检。这就像是在茫茫大海上随机捞一把沙子,不仅会让患者痛苦,而且得到的只是局部、静态的信息,很难反映肿瘤全貌的动态变化。
面对这种“盲人摸象”的局面,如何实现非侵入性、实时且精准的肿瘤分型,成了决定免疫治疗成败的“最后一公里”。近日,南京大学团队在《美国化学会志》(JACS)上发表了一项颠覆性研究,他们开发出一种名为 FAR(荧光-余辉报告分子) 的新型“侦察兵”,能够一眼识破肿瘤的三种免疫伪装。
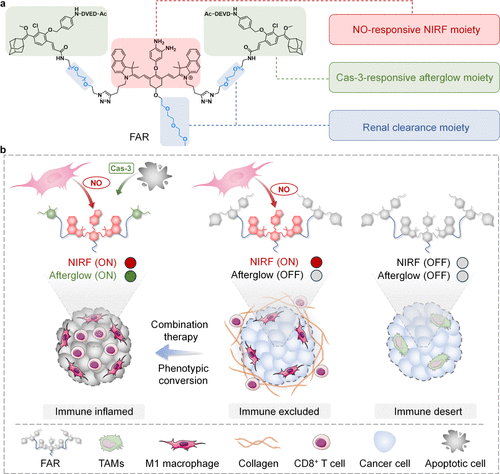
核心方法与技术细节:双重逻辑锁,打造细胞界的“红绿灯”
要理解 FAR 的精妙之处,我们先得认识免疫系统里的两个关键角色:M1型巨噬细胞和Caspase-3酶。
M1型巨噬细胞是免疫系统的“前线督战队”,它们大量产生的一氧化氮(NO) 是免疫激活的核心标志。而 Caspase-3 酶则是细胞凋亡的“刽子手”,它的出现意味着癌细胞正在成规模地走向死亡。
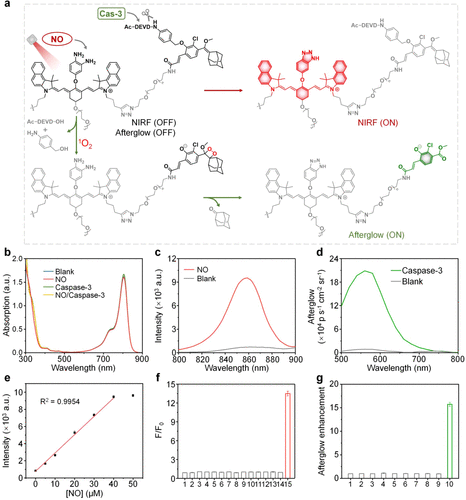
FAR 的设计逻辑,就像是一个精密的“双重逻辑门”:
1. 它是如何“隐身”的?
在未遇到目标前,FAR 处于 “静默状态”。它内部设计了一种光致电子转移(PET)机制,就像给发光基团装上了“吸能海绵”,把所有的能量都悄悄吸收了,因此不发荧光。
同时,它的“余辉基团”被一把特定的化学锁(DEVD多肽)锁住。这就好比一只手电筒不仅关了灯,还被塞进了密不透风的黑盒子里。
2. 第一道锁:一氧化氮(NO)响应
当 FAR 进入肿瘤区域并遇到 M1 型巨噬细胞释放的一氧化氮时,化学反应会迅速发生。一氧化氮会破坏掉那个“吸能海绵”(PET 效应消失),让 FAR 瞬间发出强烈的近红外荧光(NIRF)。
这种近红外光具有极强的穿透力,能够避开生物组织的干扰,让医生在体外清晰地看到免疫激活的信号。
3. 第二道锁:Caspase-3 激活的“余辉”
如果免疫系统激活后成功杀伤了癌细胞,癌细胞会释放出 Caspase-3 酶。这把“剪刀”会精准地剪开 FAR 上的多肽锁。
最神妙的地方在于,这不仅仅是开启了普通的荧光。在激光照射后,即使关闭光源,FAR 仍能持续发出 “余辉”。这种余辉信号就像夜明珠一样,没有背景杂光干扰,灵敏度极高,专门用来报告“癌细胞死亡”这一最终战果。
通过这种 “荧光+余辉” 的双信号组合,FAR 建立了一套完美的逻辑判别系统:
- 双灯齐亮(荧光开+余辉开): 战况大好,免疫已激活且癌细胞正在大面积死亡(炎症型)。
- 亮黄灯(荧光开+余辉关): 有名无实,免疫虽然激活了,但被挡在门外杀不到癌细胞(免疫排除型)。
- 双灯全灭: 彻底哑火,免疫系统根本没进场(免疫沙漠型)。
数据背后的创新与颠覆性:11.3倍的质变,精准预判2周后的结局
为了验证这位“侦察兵”的本领,研究团队进行了一系列严苛的体外和体内测试,数据表现令人惊叹。
1. 极致的灵敏度与特异性
在实验室环境下,当 FAR 遇到一氧化氮时,其荧光信号强度在短短 30 分钟内迅速飙升,最高增强了 11.3 倍。这种极高的信噪比意味着哪怕只有极少量的免疫激活,也逃不过它的法眼。
更重要的是,它非常“专一”。面对钾、钙、铁等离子,或者谷胱甘肽、半胱氨酸等生物干扰物,FAR 基本保持沉默。这种高特异性确保了它发出的每一个信号都是可靠的战报。
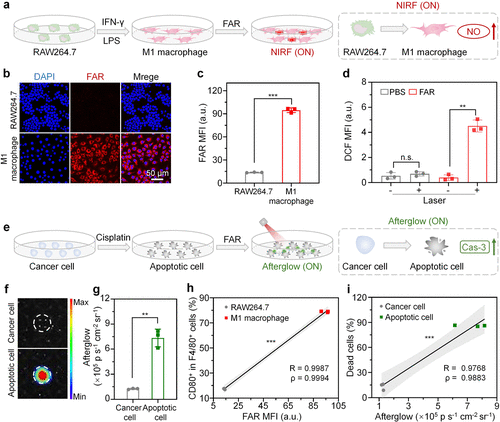
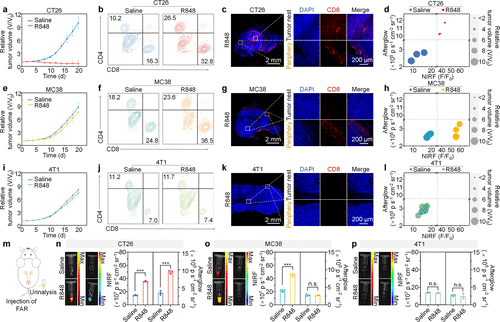
2. 三种免疫分型的完美“神还原”
在活体实验中,研究人员构建了三种不同特点的肿瘤模型。
在 CT26 肿瘤(炎症型)中,注射 FAR 后,荧光增强了 3.7 倍,余辉增强了 4.6 倍。这证实了该肿瘤内部免疫不仅进场了,还在高效收割癌细胞。
但在 MC38 肿瘤(免疫排除型)中,情况发生了诡异的变化:荧光同样增强了 3.7 倍,代表免疫激活了;但余辉信号却几乎为零!这组数据精准捕捉到了该肿瘤的特性——免疫细胞被厚厚的胶原蛋白“围墙”挡在了边缘,虽然在叫阵,却杀不进内城。
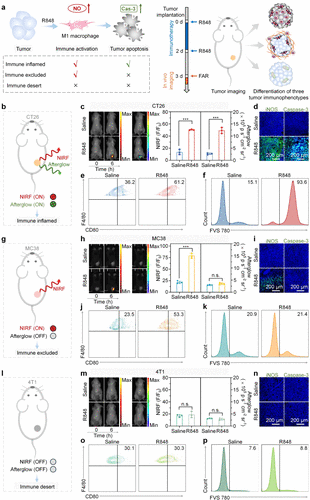
3. “尿液检测”:最温柔的诊断方案
研究团队还给 FAR 设计了一个贴心的功能——肾清除设计。
因为 FAR 的骨架是水溶性极好的聚合物,它们在完成“侦查任务”后,会随着血液循环通过肾脏排出。这意味着,医生甚至不需要对着肿瘤进行复杂的成像,只需要采集患者的一小杯尿液,通过检测尿液中的荧光和余辉模式,就能准确判断肿瘤的免疫类型。
实验显示,尿液中的信号模式与肿瘤内部的情况高度一致。这种“光学尿检”为未来的居家癌症监测提供了一种极具想象力的可能。
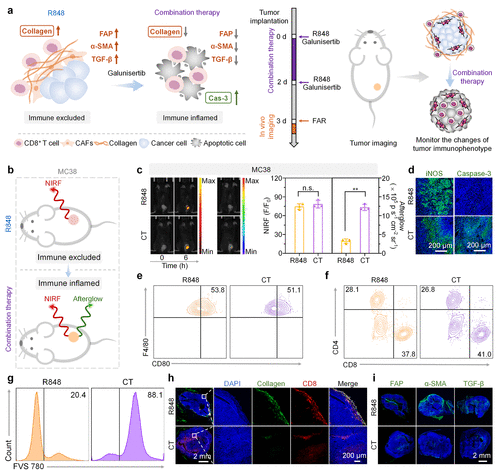
4. 2周前的“神预言”
最让科研界振奋的是 FAR 的预测能力。研究发现,在治疗开始后的第 3 天,FAR 提供的信号模式就能够准确预示治疗的终局。
相比于传统的测量肿瘤体积(通常需要观察 20 天左右才能看出趋势),FAR 将预测时间提早了整整 2 周。这意味着,如果 FAR 发现当前疗法是“免疫排除型”(有信号无杀伤),医生可以立即调整方案,引入打破基质屏障的药物,而不是等到半个月后发现肿瘤长大了才追悔莫及。
应用展望、局限性与未来路线图:开启“精准免疫”的新纪元
FAR 的出现,标志着我们从“盲目免疫治疗”向“精准免疫治疗”迈出了一大步。它不仅是一个诊断工具,更是一个疗效监控平台。
潜在应用场景
- 个性化方案筛选: 在治疗前先用 FAR 探测,如果是“排除型”肿瘤,就先拆墙(加抗纤维化药物);如果是“沙漠型”,就先招兵(加免疫激动剂)。
- 新药研发加速: 制药公司可以利用 FAR 实时观察药物是否真的激活了免疫系统,大大缩短研发周期。
- 术后复发预警: 通过定期的尿液检测,实时监控体内免疫环境的微小波动。
科学的客观性:挑战与局限
当然,作为一项前沿研究,FAR 走向临床仍需跨越几座大山。首先,虽然近红外光的穿透力很强,但对于人体深部器官(如深层肝脏或肺部中心)的肿瘤,光学信号的衰减仍是挑战。
其次,一氧化氮和 Caspase-3 虽然是经典标志物,但在极其复杂的疾病背景下,如何进一步排除其他炎症性疾病导致的“假阳性”,仍需要更大规模的临床数据支持。
未来路线图
研究团队表示,下一步将探索更长波长的成像技术,以获得更深的穿透深度。同时,他们也在尝试将 FAR 与其他类型的成像手段(如 PET 或 MRI)结合,打造一套全方位的“免疫卫星监控系统”。
总结来说,FAR 的研发成功,为癌症治疗提供了一双能够洞察肿瘤微环境的“火眼金睛”。它让我们看到,癌症治疗的未来不再是千篇一律的公式,而是根据每一位患者、每一个肿瘤的实时免疫动态,量身定制的“斩首行动”。