【JACS】效率飙升至97%!中国科学家研发“超声驱动”黑科技,实现了对深层耐药细菌感染的精准、高效、安全治疗
✨文章标题:Ultrasound-Triggered Type I Supramolecular Photosensitizer for Precise In Situ Chemiluminescence-Based Photodynamic Cyclic Therapy ✉️作者:Pengfei Wang* 等 🔗链接:https://doi.org/10.1021/jacs.5c15389
[!summary]
核心科学问题与挑战
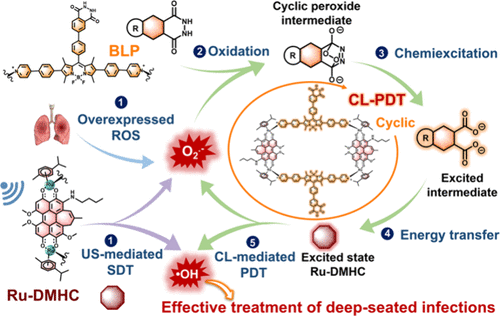
传统光动力疗法(PDT)主要依赖外部激光激发光敏剂产生活性氧(ROS)来杀灭细菌。然而,由于生物组织对光的吸收和散射,激光的穿透深度通常不足2厘米,这限制了PDT在肺炎等深部感染中的应用。虽然化学发光(CL)可以作为“内置光源”解决穿透力问题,但传统的化学发光体系面临能量转移效率(CRET)低下、发光强度弱以及依赖氧气等瓶颈。
关键技术创新与材料设计
研究团队通过超分子组装策略,构建了一种名为 RDL 的新型纳米颗粒,其核心亮点包括:
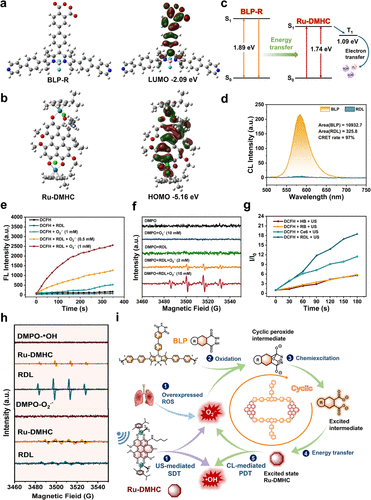
1. 高效的“能量接力”设计: 团队将一种新型的超低氧依赖、超强自由基产生能力的钌(II)金属配合物作为“能量接收器”,与一种对超氧阴离子敏感的化学发光供体(BLP)结合。通过配位共价键的精确组装,将两者之间的距离缩短到极限,实现了高达 97% 的化学发光共振能量转移(CRET)效率。
2. “声-光-化学”多重触发机制: 该系统不仅能通过化学发光激发,还能响应超声(US)信号。超声产生的空化效应不仅能直接激活光敏剂产生ROS,还能显著增强化学发光的强度。更精妙的是,超声产生的超氧阴离子会触发化学发光,进而再次激活光敏剂,形成一个“自我增强”的循环。
3. 仿生“隐身”护甲: 为了让药物能够精准找到感染部位,研究团队在纳米颗粒表面包裹了一层由红细胞膜(负责长效循环)和巨噬细胞膜(负责炎症靶向)融合而成的复合细胞膜。这层“护甲”赋予了药物卓越的肺部炎症定位能力。
实验结果与性能突破
在体外实验中,RDL表现出了极强的杀菌能力,在极低浓度下对耐药金黄色葡萄球菌(MRSA)的杀灭率超过 99%。在生物模拟实验中,该系统在 10厘米 深的组织模型中依然能产生强劲的杀伤信号,彻底打破了传统光疗的深度限制。
在小鼠肺炎模型实验中,静脉注射后的纳米药物精准聚集在受损肺部。结合超声治疗,小鼠肺部的细菌负载量显著下降,肺水肿得到缓解,炎症因子水平恢复至健康状态。此外,基因组学分析证实,该疗法通过破坏细菌细胞膜、抑制多重耐药外排泵以及干扰细菌通信(群体感应)等多种途径协同作战,有效攻克了超强耐药菌。
研究结论
该研究成功开发了一种由超声驱动、具有“原位自我增益循环”功能的超分子平台,实现了对深层耐药细菌感染的精准、高效、安全治疗。
一、从“痛点”到“突破”:后抗生素时代的深处危机
在人类与致病微生物长达一个世纪的战争中,我们正步入一个令人不安的转折点。耐甲氧西林金黄色葡萄球菌,也就是臭名昭著的超级细菌MRSA,正在全球范围内悄然蔓延。这种细菌不仅对绝大多数传统抗生素产生了严重的耐药性,更擅长在肺部、骨骼等深层组织中安营扎寨,构建起坚固的细菌生物膜。面对这些深藏不露的敌人,口服或注射抗生素往往因为难以穿透生物膜的物理屏障,或者因全身毒性过大而无法达到足够的杀菌浓度,导致治疗陷入僵局。
为了打破这种局面,科学家们曾寄希望于光动力疗法(PDT)。这种疗法的原理非常迷人:利用光线激活一种名为光敏剂的物质,使其产生杀伤力极强的活性氧(ROS),像“分子炸弹”一样炸碎细菌。然而,光动力疗法在临床应用中遇到了一个无法逾越的物理屏障:光的穿透深度有限。可见光甚至近红外光在人体组织中的穿透能力通常不足两厘米,这使得它对于人体深器官的感染几乎无能为力。就像是一支威力巨大的狙击枪,却被一堵厚墙挡住了视线。
为了解决这个“光进不去”的死穴,中国科学院理化技术研究所在化学顶级期刊《美国化学会志》(JACS)上发表了一项震撼性的研究成果。他们巧妙地将化学发光、超声驱动与超分子化学结合在一起,开发出一种名为RDL@RM NPs的智能纳米平台。这种技术不仅实现了惊人的97%能量转移效率,还打破了光疗的深度禁区,在模拟十厘米深度的组织中依然展现出恐怖的杀菌威力。这标志着人类在精准、深度打击耐药细菌的道路上,迈出了颠覆性的一步。
二、核心方法与技术细节:微观世界的“精准制导导弹”
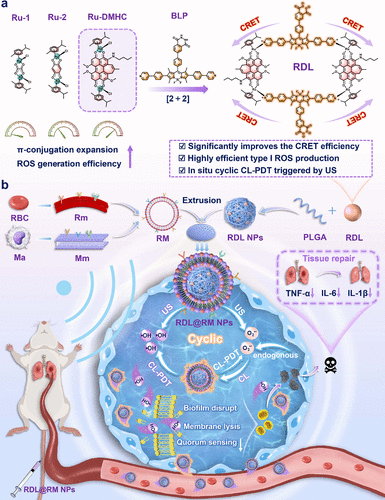
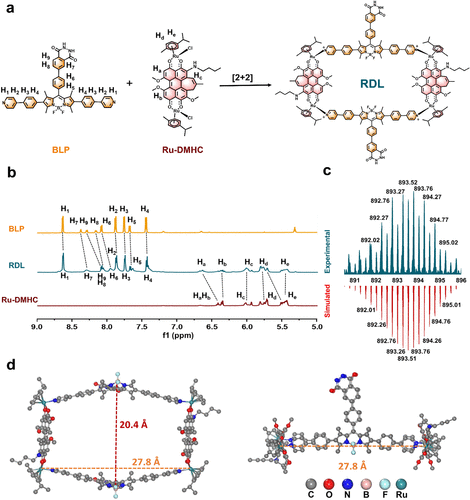
(一)精妙绝伦的超分子“2+2”组装工艺
要理解这项研究的精髓,首先要从这个系统的结构设计说起。研究团队并没有简单地将发光分子和杀菌分子混合在一起,而是利用超声触发型超分子化学的原理,构建了一个极其精密的“长方形”金属环结构。这个结构被称为RDL,它是通过一种名为“2+2自组装”的策略形成的。具体来说,就是将两个能够灵敏探测超氧阴离子的化学发光供体(BLP) 和两个高效产生自由基的钌(II)金属配合物受体(Ru-DMHC),通过配位共价键精准地锁死在一起。
这种设计的巧妙之处在于,它通过化学键将能量供体和受体之间的距离压缩到了原子级的物理极限。在传统的能量转移系统中,能量传递就像两个隔着马路的人在传球,球很容易在空中丢掉。而在RDL系统中,供体和受体紧紧相邻,能量传递变成了 “手递手”的交接。实验测得,其化学发光共振能量转移(CRET)效率高达97%。这意味着几乎每一份被激发的化学能量都能被精准地引导至杀菌单元,极大程度地减少了能量损耗。
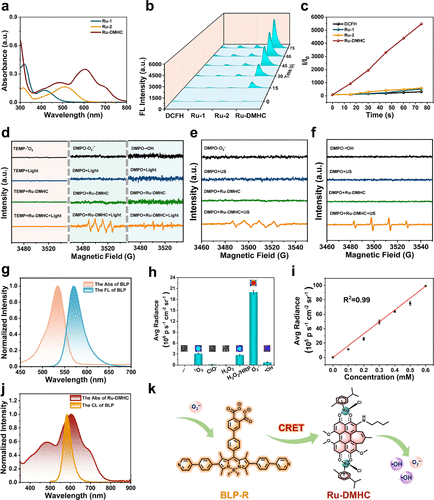
(二)π体系扩张策略:让杀手更加冷酷
除了结构上的紧凑,研究团队还对杀菌核心组件进行了深度改造。他们对光敏剂进行了π体系扩张,这是一种通过增加分子共轭程度来增强其性能的高级化学策略。经过改造的钌配合物不仅吸收光谱发生了显著的红移,更重要的是,它从一个依赖氧气的传统杀手转变为一个氧气依赖度极低的“I型自由基产生器”。
在许多深部感染灶,环境往往是非常缺氧的。传统的PDT在缺氧环境下会像熄火的发动机一样失去效力。但改造后的RDL系统能够直接产生羟基自由基和超氧阴离子,这两种活性氧具有极强的氧化还原电位,能够在完全没有氧气参与的情况下,直接从内部瓦解细菌的防御体系。这种“不挑环境”的特性,使其在面对极其顽固的深层生物膜感染时,展现出了无可比拟的适应性。
(三)多重驱动的“正反馈”杀菌循环
整个系统最令人拍案叫绝的机制在于其 “声-光-化学”三位一体的协同效应。研究人员引入了超声波作为外部的远程遥控器。超声波具有无与伦比的组织穿透力,能够轻松穿透十厘米以上的软组织。当超声波照射到感染区域时,会通过物理层面的“空化效应”产生能量,直接激活纳米粒子。
更神奇的是,超声波激发的活性氧会触发BLP产生化学发光,这些光能量再通过高效的能量链路传输给受体,产生更多的自由基。这个过程形成了一个 “原位自增益循环”:自由基触发光,光产生更多的自由基。这种闭环的正反馈机制,让杀菌信号在病灶内部不断放大。这就好比在敌方堡垒内部埋下了一个能自我增值的能量站,源源不断地输出杀伤火力,直到将敌人彻底清扫干净。
(四)仿生隐身外壳:躲避侦察与精准靶向
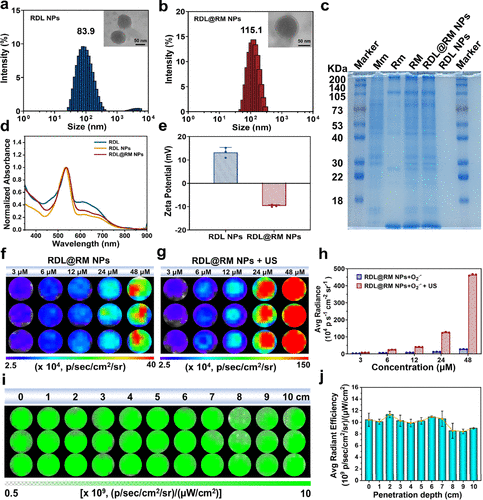
为了确保这些“微型导弹”能够顺利抵达战场,团队还为其研发了一套先进的复合仿生外壳。他们将红细胞膜与巨噬细胞膜融合在一起,包裹在纳米粒子的表面。红细胞膜就像是“通行证”,让免疫系统将其视为自己人,从而在血液循环中长期维持活力。而巨噬细胞膜则像是一个“追踪雷达”,能够利用其表面天然的受体,自动寻找并黏附在炎症部位的细菌生物膜上。这套“隐身+定位”的双重护甲,确保了药物能够实现精准的肺部靶向递送,极大地提高了治疗效率并降低了全身副作用。
三、数据背后的创新与颠覆性:从实验室到战场的降维打击
(一)超越极限的物理穿透深度
数据是评价科研成果含金量的硬指标。研究团队在组织模拟实验中展示了令人震惊的结果。在长达十厘米的模拟组织深度下,利用超声激发的活性氧信号几乎没有发生显著的衰减。这与传统激光驱动下“一公分就熄火”的窘迫局面形成了鲜明对比。这项数据有力地证明了,这种基于超声触发和原位化学发光的方案,彻底解决了光动力疗法数十年来的深度痛点。这种穿透力的提升不是百分之几的改良,而是跨数量级的颠覆。
(二)对超级细菌MRSA的恐怖杀灭效率
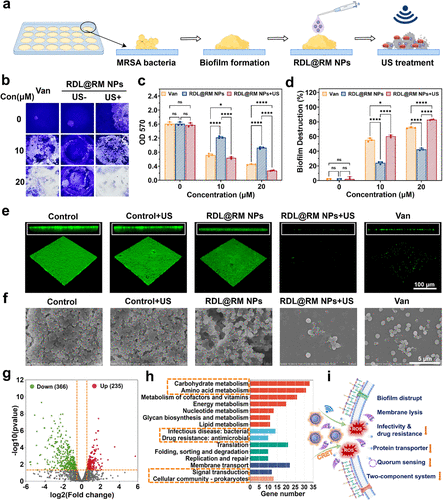
在体外实战测试中,RDL系统展现出了极佳的性价比。当纳米药物的浓度低至1微摩尔时,在超声波的配合下,对MRSA细菌的杀灭率就超过了99%。通过共聚焦显微镜观察,原本聚集在一起、厚度惊人的细菌生物膜在治疗后变得支离破碎。原本充满生机的绿色荧光(代表活菌)被代表死亡的大面积红色荧光所取代。
与传统的“万金油”抗生素万古霉素相比,RDL系统在清除生物膜方面的表现堪称优秀。万古霉素对成熟生物膜的清除率通常在百分之七十左右波动,而这种新型纳米疗法则能在更短的时间内实现百分之八十以上的生物膜崩解。这种效率的提升不仅意味着更快的康复速度,更意味着能够有效防止细菌死灰复燃。
(三)从基因层面瓦解细菌的防御意志
这项研究最深入的发现源自转录组学测序分析。研究团队发现,这种疗法对细菌的打击是全方位且毁灭性的。通过对比处理前后的细菌基因表达,他们发现有超过两千六百个基因发生了显著变化。数据清晰地显示,细菌体内的ABC转运体系统被严重抑制,这就像是切断了细菌排泄毒素的“下水道”,使其无法将进入体内的活性氧排出。
同时,细菌之间进行沟通的 “群体感应系统(QS)” 和感知外部环境压力的 “两组分信号转导系统(TCS)” 也遭到了毁灭性打击。这相当于在战场上切断了敌人的无线电通讯并刺瞎了其侦察兵,使细菌无法通过协作来维持生物膜结构或产生耐药性反应。这种从物理结构到代谢通路,再到基因调控的全维度降维打击,解释了为什么即使是多重耐药的超级细菌也无法在这种疗法面前撑过第一轮进攻。
(四)小鼠体内实验的完美战绩
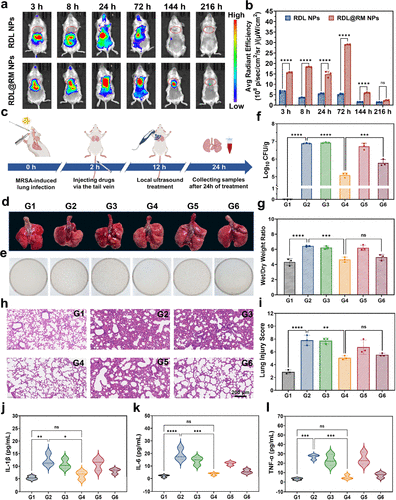
在最接近临床环境的小鼠肺炎模型实验中,RDL@RM NPs展现了非凡的医疗价值。通过荧光成像系统可以清晰地看到,纳米粒子在静脉注射后,会像受到磁石吸引一般迅速向受损的肺部聚集,并在三到七十二小时内维持极高的浓度。在超声干预后,受感染小鼠肺部的细菌负载量发生了数个数量级的下降。
切片分析显示,接受治疗后的小鼠肺组织结构完整,原本严重的肺水肿和炎症细胞浸润几乎消失,肺部损伤评分大幅降低。此外,通过酶联免疫吸附测定发现,血液中的炎症因子(如IL-1β、IL-6和TNF-α) 水平迅速回落至健康基线。这些硬核的数据不仅证明了疗法的有效性,更通过溶血实验和各器官切片证明了其极高的生物安全性,为未来的临床转化打下了坚实的信心基础。
四、应用展望、局限性与未来路线图:开启精准医疗的新纪元
虽然RDL@RM NPs在实验中表现出了教科书般的完美性能,但要真正将其推向医院的病房,依然有一段充满挑战的路要走。首先是生产工艺的规模化。这种超分子金属环的合成需要极其精密的化学环境控制,如何在工业化的大规模生产中保证每一批次产品都具有百分之九十七的能量转移效率,是工程师们需要攻克的首要难题。
其次是代谢路径的长期监测。虽然目前研究显示该系统在小鼠体内能被安全代谢,但在人体这种更为复杂的生理环境中,钌金属配合物的长期留存效应及其对人体微生物群落的影响,仍需要进行为期数年甚至更长时间的临床观察。
然而,这些挑战掩盖不了这项技术散发出的划时代光芒。这种基于超声波远程触发、并能由自身活性氧产物维持循环的杀菌理念,为人类对抗耐药细菌提供了一套全新的战术模板。除了治疗肺炎,这种技术还可以很容易地扩展到深层骨髓炎、慢性创面感染甚至深部实体瘤的治疗中。它可以被改装成一种“诊疗一体化”的平台,在探测到感染信号的同时自动开启杀菌模式。
在未来,我们或许可以期待这样一种医疗场景:当患者遭遇严重的深层感染时,医生不再需要尝试成百上千种抗生素,而只需静脉注射这种智能纳米粒子,再配合针对特定区域的超声扫描,就能在不伤害正常组织的情况下,精准、高效地定点清除体内的超级细菌。中国科学家的这项研究,无疑为这个充满希望的未来画下了第一笔浓墨重彩的草图。这不仅是化学和医学的胜利,更是人类智慧在应对生存挑战时展现出的非凡创造力。