【JACS】秒级标记、超强穿透:新型蛋白质标签如何将活体成像亮度提升3.6倍
显微镜下的革命,往往从最微小的化学结构改变开始
从“痛点”到“突破”
在生命科学领域,科学家们一直面临一个棘手难题:如何在活体生物中实现高效、快速、高对比度的荧光标记?传统荧光蛋白虽能精准定位,但亮度和光稳定性不足;合成染料虽亮度卓越,却因分子量大、穿透性差,在活体应用中日渐乏力。
以常用的HaloTag系统为例,其染料衍生物分子量超过500道尔顿,即使使用最高浓度的染料,在活体中的标记效率依然低下且缓慢。更令人沮丧的是,血脑屏障这一关,几乎阻断了大多数荧光探针进入大脑的可能性。
而今天,来自马克斯·普朗克研究所的团队在《美国化学会志》上发表的研究,带来了颠覆性解决方案:Rho-tag和SiR-tag。这两种新型蛋白质标签能够以纳摩尔级亲和力结合普通罗丹明染料,实现了秒级快速标记、卓越亮度和出色的活体穿透能力。
研究团队通过巧妙的蛋白质工程,将一个大肠杆菌多药耐药蛋白改造成了高效的染料结合工具。更令人振奋的是,这种新型标签在斑马鱼幼虫和线虫胚胎中的表现远超传统方法,标记效率提升数倍,为在体神经科学研究和发育生物学打开了全新窗口。
核心方法与技术细节
从“不可能”到“可能”的设计思路
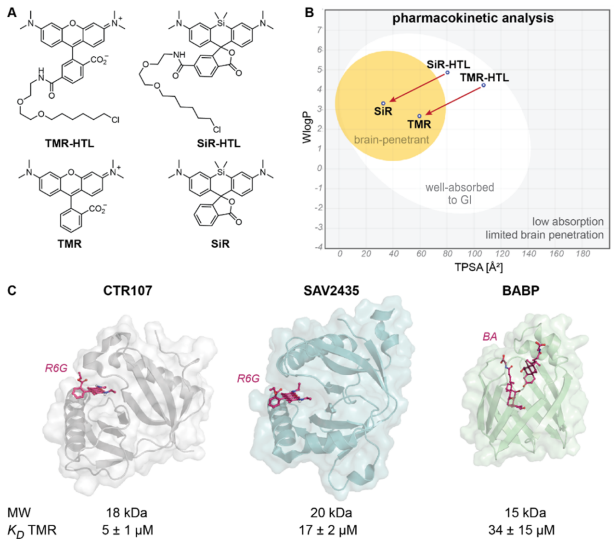
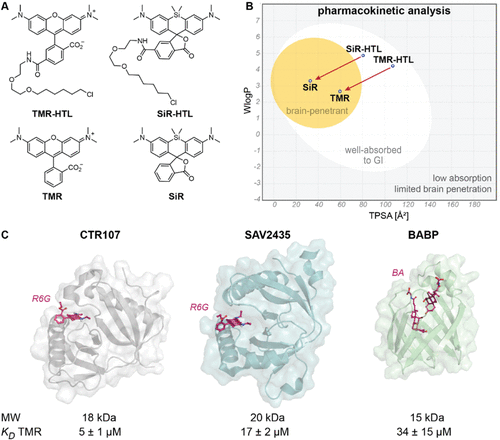
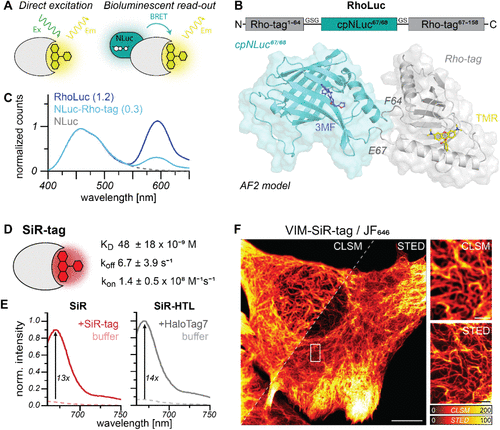
研究团队的突破始于一个关键洞察:未经修饰的罗丹明染料具有卓越的细胞膜穿透能力。通过瑞士ADME工具的模拟分析,他们发现未取代的四甲基罗丹明(TMR)和硅罗丹明(SiR)能够轻松穿越血脑屏障,而其HaloTag配体衍生物则被预测为脑部穿透性差。
这就引出了核心创新点:与其对染料进行化学修饰以适应现有标签,不如设计能够直接结合天然染料的蛋白质标签。这种“逆向思维”成为了整个研究的基石。
蛋白质工程的精妙之旅
研究团队从三种已知能够结合罗丹明的蛋白质开始筛选,最终选择了细菌多药耐药蛋白CTR107作为起点。这个选择颇具战略眼光:CTR107具有小巧的球状结构(18kDa)、单一结构域,且对TMR已有微摩尔级的结合能力。
通过结构引导的定点突变,团队首先获得了第一代Rho-tag0.1,其对TMR的结合亲和力提高了48倍。随后,他们采用了酵母表面展示技术结合荧光激活细胞分选,进行了多轮迭代优化。
深度突变扫描和蛋白质稳定性优化的双重策略,最终催生出了成熟的Rho-tag。这个优化过程涉及20多个关键位点的突变,将结合亲和力从微摩尔级提升至纳摩尔级,整整提高了约1000倍。
分子机制的精细解析
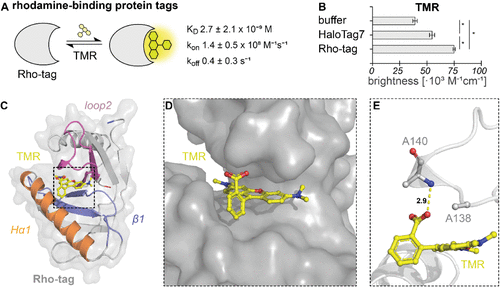
Rho-tag与TMR的结合机制通过2.1埃分辨率的晶体结构得到了阐明。研究发现,TMR的咕吨环深深插入蛋白质的结合口袋中,形成了一个紧密的相互作用网络。
特别值得注意的是,A140残基的α-氨基与TMR邻位羧基之间的氢键相互作用,这一结构特征可能对稳定染料的荧光开放形式至关重要。分子动力学模拟显示,结合后染料的构象高度稳定,这解释了为什么结合后荧光量子产率从0.44提高到0.73,亮度几乎翻倍。
从绿色到远红的色彩扩展
团队并未止步于TMR结合蛋白。基于Rho-tag的结构信息,他们通过定向进化策略开发了能够特异性结合硅罗丹明(SiR)的SiR-tag。这一扩展极具实用价值,因为SiR的远红发射波长更适合深层组织成像,且具有优异的荧光生成特性。
SiR-tag与SiR的结合引发了13倍的荧光增强,与共价标记的HaloTag7效果相当,表明蛋白质结合能够促使染料从非荧光的螺内酯形式向荧光的两性离子形式转变。
数据背后的创新与颠覆性
秒级标记:速度的量子跃迁
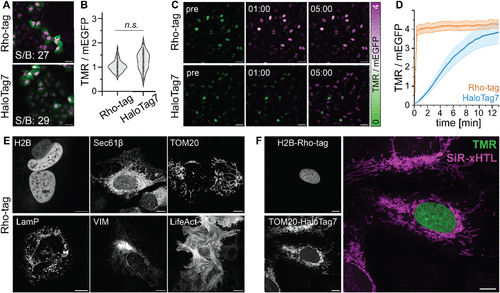
在活细胞标记实验中,Rho-tag表现出了令人惊叹的速度优势。核定位的Rho-tag在30秒内即可完成完全标记,而HaloTag7在相同条件下需要约10分钟(半标记时间为5.6分钟)。这意味着Rho-tag的标记速度比传统方法快10倍以上。
这种速度优势主要源于两个因素:Rho-tag更快的结合动力学(kon为1.4±0.5×10^8 M^-1s^-1,接近扩散控制极限)以及TMR染料更优异的细胞穿透性。
亮度优势:从体外到体内的持续领先
在体外实验中,Rho-tag结合的TMR比未结合染料亮2倍,比HaloTag7共价标记的TMR亮36%。这种亮度优势在细胞内同样明显:在U2OS细胞中,Rho-tag/TMR的信号背景比与HaloTag7相当,但在线虫胚胎中,Rho-tag标记的PGL-3蛋白信号比HaloTag7亮3.6倍(在稀释相中)。
更重要的是,Rho-tag能够在低至50纳米的染料浓度下实现有效标记,而HaloTag7通常需要微摩尔级的染料浓度。这种浓度优势在活体应用中尤为重要,因为它意味着更低的毒性和背景信号。
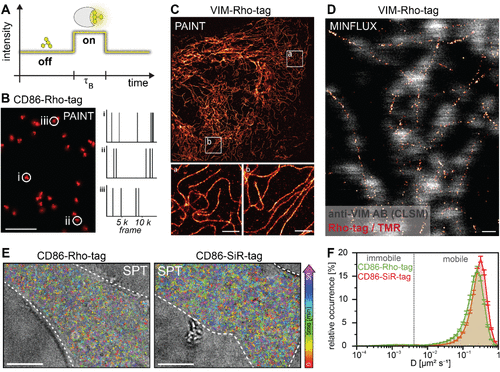
超分辨成像:突破衍射极限
Rho-tag和SiR-tag与多种超分辨显微镜技术兼容,包括STED、PAINT和MINFLUX。在PAINT成像中,TMR与Rho-tag的瞬时结合(结合时间约1秒)允许对单个CD86-Rho-tag簇进行定位,定位精度达到13.1纳米。
在活细胞单粒子追踪实验中,Rho-tag和SiR-tag能够记录大量单分子轨迹,其中超过95% 被分类为可移动轨迹。与共价标记相比,Rho-tag在30分钟成像过程中保持了显著更高的定位密度,非常适合长时程单粒子追踪研究。
活体成像的突破性表现
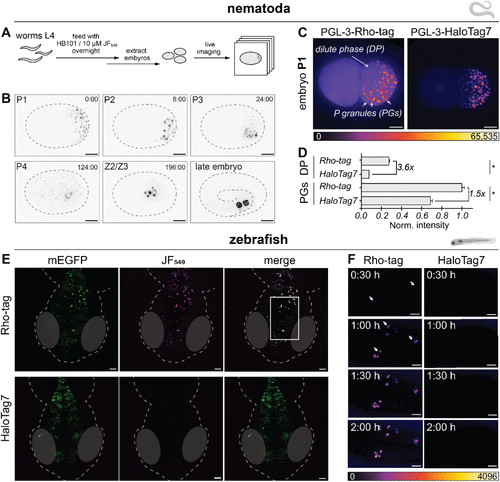
在最能体现技术实用价值的活体实验中,Rho-tag和SiR-tag表现出了绝对优势。在斑马鱼幼虫中,神经元表达的Rho-tag在250纳摩尔染料浓度下1小时内即可产生明亮特异信号,而HaloTag7在相同条件下无法有效标记,需要过夜孵育和10微摩尔的高染料浓度。
在线虫胚胎中,Rho-tag能够特异性标记PGL-3蛋白,并实时观察生殖系发育过程中PGL-3从稀释相分离形成P颗粒的动态过程。这一实验不仅展示了标记的特异性和亮度,还证明了染料在复杂生物体内的有效递送能力。
应用展望、局限性与未来路线图
技术优势与当前局限
Rho-tag和SiR-tag最显著的优势在于其卓越的穿透性、快速的标记动力学和出色的光谱性质。与可逆荧光标签(如FAST系统)、可交换HaloTag配体(xHTLs)或自更新标签(srTAG)相比,罗丹明结合标签在亮度和染料穿透性方面具有明显优势。
然而,这种非共价结合特性也是一把双刃剑。可逆性结合意味着大多数应用需要在未结合染料存在的情况下进行成像,这可能导致信背比低于可洗涤的共价标记方法。研究也发现,与共价标记相比,Rho-tag的可逆结合并未提高光稳定性,这可能是因为紧密的结合亲和力阻止了受损染料的有效交换。
未来发展方向
多色成像是显而易见的下一步。研究已经证明Rho-tag和SiR-tag可以同时在一个细胞中使用,因为它们对各自染料的亲和力有高度选择性(交叉亲和力差异达2400倍)。开发结合其他颜色染料的变体将极大扩展其应用范围。
生物传感器设计是另一个有前景的方向。研究团队已经展示了Rho-tag可以进行环状排列,并在特定位置插入其他蛋白质(如荧光素酶NanoLuc),创建能够产生生物发光读出的嵌合体。这种模块化设计为构建各种生物传感器提供了可能。
蛋白质工程优化仍有空间。虽然当前版本的Rho-tag和SiR-tag已经表现出色,但通过进一步优化,可能获得更高亲和力、更好稳定性或新功能的变体。
潜在的社会与科学影响
这项技术最直接的影响将体现在神经科学和发育生物学领域。能够高效穿透血脑屏障并在活体动物中实现快速标记的能力,将加速对大脑功能和神经回路的研究。
在药物研发中,这种技术可能用于更有效地监测药物在体内的分布和靶点结合情况。在临床诊断方面,高对比度的活体成像工具可能改善疾病模型的表征和药物疗效评估。
更为深远的是,Rho-tag和SiR-tag代表了一种新的蛋白质标记范式——利用天然染料的优异性质,而非对其进行化学修饰。这种思路可能启发更多针对其他类型染料的结合蛋白开发,进一步丰富分子生物学的工具库。
随着更多实验室采用和优化这一技术,我们有望在未来几年内看到更多基于罗丹明结合标签的创新应用,从而推动生命科学成像领域向更深、更清、更快的方向发展。
✨文章标题:Fast, Bright, and Reversible Fluorescent Labeling of Rhodamine-Binding Proteins ✉️作者:Kai Johnsson* 等 🔗链接:https://doi.org/10.1021/jacs.5c18083