【JACS】147 倍的荧光增强、无需洗涤的活细胞成像、16.6 倍的核质信号比
✨文章标题:Controlling Intramolecular Rotation with Five-Membered Heterocycles Facilitates the Design of Highly Cell-Permeable Xanthene-Based Fluorogenic Probes ✉️作者:Kazuya Kikuchi* 等 🔗链接:https://doi.org/10.1021/jacs.5c12696
在细胞生物学实验室里,有一个让研究者们头疼了几十年的 “老大难” 问题:想看清活细胞里的蛋白质动态,就像在雾霾天里找一只移动的蚂蚁。
传统荧光探针要么 “进不去” 细胞,要么进去了就 “关不掉”,背景荧光像一层浓雾掩盖了目标信号;更麻烦的是,每次观测前都要反复洗涤细胞,不仅耗时耗力,还可能破坏细胞的天然状态,导致观测结果失真。对于需要实时追踪的动态过程 —— 比如蛋白质运输、细胞器应激反应 —— 这种 “事后诸葛亮” 式的观测方法,往往会错过最关键的瞬间。
而今天要解读的这项发表在《美国化学会志》(JACS)上的研究,彻底打破了这个僵局。来自九州大学和大阪大学的团队,用一个看似简单的结构改造,让荧光探针实现了 “进门自动隐身,遇靶瞬间点亮” 的神奇效果:147 倍的荧光增强、无需洗涤的活细胞成像、16.6 倍的核质信号比,更重要的是,它能在不干扰细胞正常活动的情况下,实时捕捉从蛋白质互作到细胞器应激的完整过程。
这不仅是荧光探针技术的一次颠覆性突破,更给细胞生物学、癌症诊断、药物筛选等领域带来了革命性的工具 —— 未来,我们观察活细胞,可能就像看高清直播一样清晰、实时、无干扰。
一、从 “痛点” 到 “突破”:荧光探针的 40 年困境与破局之道
荧光成像技术被称为 “细胞生物学的显微镜之眼”,自上世纪 80 年代以来,一直是观测细胞内分子动态的核心工具。但这只 “眼睛” 长期存在三个难以解决的痛点,严重限制了它的应用。
第一个痛点是细胞渗透性难题。传统荧光探针比如罗丹明类染料,在中性 pH 环境下会呈现两性离子状态,就像穿着一件 “亲水外套”,很难穿过细胞的磷脂双分子膜 —— 要么进不去,要么进去后堆积在细胞膜上,形成强烈的背景干扰。
第二个痛点是荧光开关失控。大多数探针依赖螺内酯环的开合来控制荧光,这种机制对 pH 值非常敏感,在酸性环境下会自动 “点亮”,导致溶酶体、内体等酸性细胞器出现假阳性信号。更麻烦的是,当探针与疏水配体结合后,容易发生聚集,不仅会降低荧光效率,还可能产生细胞毒性。
第三个痛点是必须洗涤的枷锁。为了消除未结合探针的背景荧光,研究者需要在成像前进行 3-5 次洗涤操作,整个过程耗时超过 30 分钟。对于脆弱的活细胞来说,反复的离心、换液很可能破坏其正常的生理状态;而对于快速发生的动态过程 —— 比如蛋白质在 10 分钟内的运输、细胞器的应激反应 —— 等洗涤完成,关键的观测窗口早已关闭。
这些痛点让荧光成像技术陷入了 “想看清就必须干扰,想不干扰就看不清” 的两难境地。尽管科学家们进行了 40 多年的优化,但始终没有找到一种能同时解决 “高渗透性、高特异性、无洗涤成像” 的方案。
而这项研究的核心突破,恰恰是找到了一个全新的解决思路:既然控制螺内酯环的开合这条路走不通,不如换个角度 —— 从分子内旋转入手。
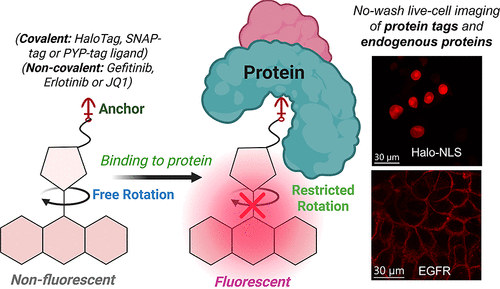
研究团队发现,荧光分子的发光效率,很大程度上取决于其_分子内旋转_的自由度。就像一个高速旋转的风扇,叶片转得越快,越难聚焦能量;如果能限制它的旋转,能量就会以荧光的形式释放出来。基于这个原理,他们设计了一种旋转控制型荧光探针:在未结合目标时,分子自由旋转,荧光被 “淬灭”(OFF 状态);一旦与目标蛋白结合,旋转被限制,荧光瞬间爆发(ON 状态)。
更巧妙的是,为了最大化旋转自由度,他们用呋喃或噻吩这两种五元杂环,替换了传统罗丹明探针中 9 位的苯基。这个看似微小的结构改变,不仅让探针的细胞渗透性提升了一个量级,还彻底摆脱了对 pH 值的依赖 —— 无论在中性还是酸性环境下,它都能保持稳定的 “OFF-ON” 切换。
这一设计,一次性解决了传统探针的三大痛点:五元杂环的疏水特性让它轻松穿过细胞膜;旋转控制机制让它实现 “遇靶点亮”,无需洗涤即可消除背景;不依赖螺内酯环,让它在全 pH 范围内保持稳定。一个看似简单的结构改造,实则是对荧光探针设计逻辑的重新定义。
二、核心方法与技术细节:五元杂环如何让荧光探针 “智能化”?
要理解这项技术的革命性,我们需要先搞懂一个核心概念:分子内旋转与荧光淬灭的关系。
我们可以把荧光分子想象成一个 “能量收集器”。当它吸收光子能量后,会处于激发态,就像一个充满电的电池。这个 “电池” 有两种释放能量的方式:一种是通过发光(荧光),另一种是通过分子内旋转—— 就像电池短路一样,能量会以热能的形式消散,不会产生荧光。
传统荧光探针的问题在于,它的分子结构相对刚性,旋转自由度低,即使没有结合目标,也会持续发光,导致背景信号过高。而这项研究的关键创新,就是通过结构设计,让探针在未结合目标时拥有极高的旋转自由度,从而实现 “彻底淬灭”;结合目标后,旋转被限制,荧光才能高效释放。
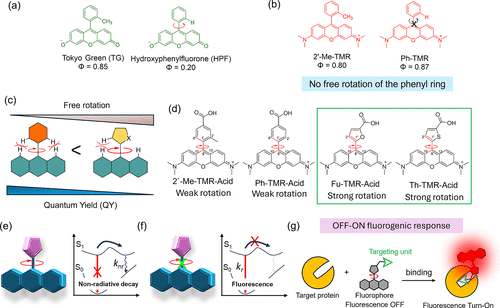
1. 结构改造的 “点睛之笔”:五元杂环替换苯基
研究团队选择了呫吨环作为荧光核心(这是罗丹明、荧光素等经典染料的共同骨架),并对其 9 位的取代基进行了关键改造。
传统罗丹明探针的 9 位是一个苯基,这个六元环结构体积较大,且与呫吨环之间存在一定的共轭作用,导致_分子内旋转_受到限制 —— 即使未结合目标,也会有一定的荧光强度,背景信号难以消除。
而研究团队用呋喃(含一个氧原子的五元杂环)或噻吩(含一个硫原子的五元杂环)替换了苯基。这个改造带来了两个关键变化:
首先,五元杂环的体积更小,且与呫吨环之间的空间位阻显著降低,就像把一个笨重的 “圆盘” 换成了灵活的 “小风扇”,让_分子内旋转_的自由度大幅提升。在未结合目标时,呋喃 / 噻吩环可以自由旋转,激发态能量通过旋转快速消散,荧光被彻底淬灭,此时探针处于 “隐身” 状态,几乎没有背景信号。
其次,五元杂环的电子结构与呫吨环形成了更优的共轭体系,当旋转被限制时,量子产率(QY) 会大幅提升。实验数据显示,噻吩修饰的探针(Th-TMR-Acid)在甘油(高粘度环境,限制旋转)中的量子产率达到 0.16,是甲醇(低粘度环境,自由旋转)中的 4 倍;而传统苯基探针的量子产率提升仅为 2 倍。
更重要的是,五元杂环的疏水特性让探针在中性 pH 环境下呈现疏水性,能够轻松穿过细胞膜 —— 这解决了传统罗丹明探针的渗透性难题。实验证明,即使在10 nM的低浓度下,该探针也能快速进入细胞,并精准结合目标蛋白,无需任何辅助试剂。
2. “OFF-ON” 机制:从自由旋转到旋转受限的完美切换
这个探针的工作原理可以用一个生动的比喻来解释:它就像一个 “智能手电筒”,平时处于待机状态(OFF),只有当它被目标蛋白 “握住” 时,才会自动点亮(ON)。
在未结合目标时,探针分子中的呋喃 / 噻吩环处于自由旋转状态,激发态能量通过非辐射跃迁(旋转)快速消散,此时荧光强度极低,量子产率小于 0.01,几乎不会产生背景干扰。
当探针与目标蛋白结合后,情况发生了根本性变化:蛋白的立体结构会像一个 “夹子” 一样,固定住呋喃 / 噻吩环,限制其旋转。此时,非辐射跃迁被抑制,激发态能量只能通过辐射跃迁(荧光)释放,探针瞬间被 “点亮”。
这种机制的优势在于,荧光开关完全由 “是否结合目标” 控制,与 pH 值、离子浓度等环境因素无关。实验数据显示,在 pH 5-8 的范围内,无论是自由状态还是结合状态,探针的荧光强度都保持稳定 —— 这意味着它可以在细胞内的不同细胞器中(从细胞质的中性环境到溶酶体的酸性环境)都能精准工作,不会产生假阳性信号。
3. 模块化设计:从蛋白标签到疾病靶点的全覆盖
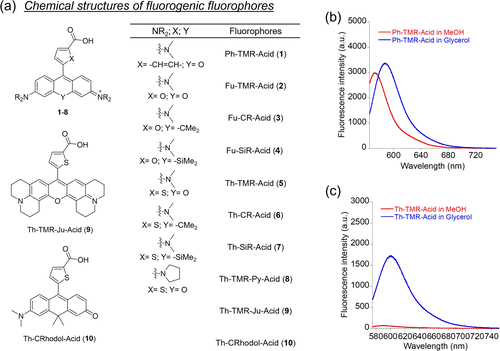
为了让这项技术具有广泛的适用性,研究团队采用了模块化设计思路:将 “荧光核心”(呫吨环 + 五元杂环)与不同的 “靶向模块” 结合,开发出了针对不同目标的探针系列。
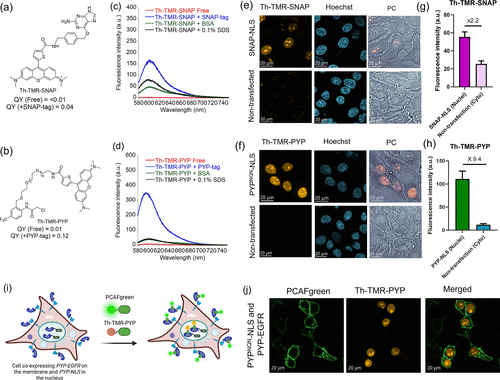
首先是针对自标记蛋白标签的探针,包括 HaloTag、SNAP-tag 和 PYP-tag—— 这些标签是细胞生物学中常用的 “分子抓手”,可以与目标蛋白融合表达,让探针精准定位。
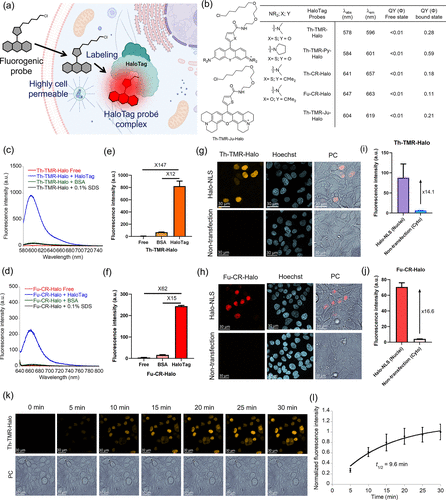
以 HaloTag 探针为例,研究团队开发的 Th-TMR-Halo 探针,在结合 HaloTag 蛋白后,荧光强度提升了147 倍,量子产率从小于 0.01 跃升至 0.28;而 Fu-CR-Halo 探针的核质信号比达到16.6 倍,意味着在细胞核内的目标蛋白信号,是细胞质背景信号的 16.6 倍 —— 这相当于在漆黑的房间里点亮一盏明灯,目标清晰可见。
更重要的是,这些探针实现了真正的无洗涤成像。传统 HaloTag 探针需要洗涤 3 次才能消除背景,而该探针在加入细胞后,无需任何处理,直接成像就能获得清晰的信号。时间 lapse 实验显示,探针加入细胞后 10 分钟内就能被快速吸收并结合目标,半衰期仅为9.6 分钟,完全满足实时追踪的需求。
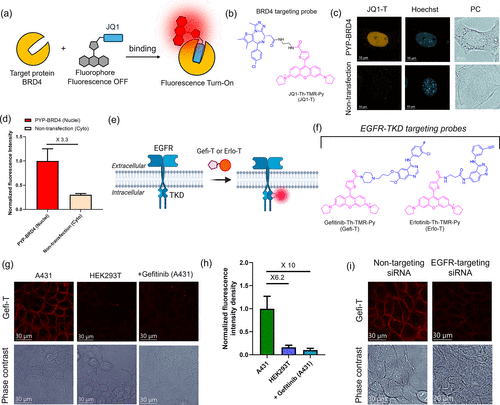
除了蛋白标签,研究团队还将这种荧光核心与疾病相关靶点的配体结合,开发出了针对BRD4和EGFR的特异性探针。BRD4 是癌症相关的转录调控蛋白,EGFR 则是多种癌症(如肺癌、乳腺癌)的关键靶点,过度表达往往意味着肿瘤恶性程度更高。
针对 EGFR 的探针 Gefi-T,通过将酪氨酸激酶抑制剂吉非替尼与噻吩修饰的荧光核心结合,实现了对 EGFR 过度表达细胞的特异性识别。实验显示,在 EGFR 高表达的 A431 细胞中,Gefi-T 的荧光强度是低表达 HEK293T 细胞的6.2 倍;当用吉非替尼竞争性结合 EGFR 后,荧光强度下降了10 倍—— 这证明探针能够精准识别并结合活性状态的 EGFR,为癌症诊断和药物筛选提供了全新的工具。
三、数据背后的创新与颠覆性:为什么说这是一次 “技术革命”?
一项技术是否具有颠覆性,最终要靠数据说话。这项研究的一系列实验数据,不仅证明了技术的可行性,更展现了它相对于传统技术的压倒性优势。
1. 荧光性能:147 倍增强,信号噪音比碾压传统探针
荧光探针的核心性能指标是 “荧光增强倍数” 和 “量子产率提升”,这直接决定了信号的清晰度。
研究团队开发的 HaloTag 探针中,Th-TMR-Halo 在结合目标后,荧光强度提升了147 倍,Th-TMR-Py-Halo 更是达到了149 倍—— 这是什么概念?相当于把一个音量为 1 的声音,放大到 147 倍,即使在嘈杂的环境中也能清晰听到。
相比之下,传统罗丹明类 HaloTag 探针的荧光增强倍数通常在 20-50 倍之间,背景信号难以完全消除。更重要的是,该探针的量子产率在结合状态下最高达到0.59(Th-TMR-Py-Halo),远超传统探针的 0.21,意味着它的发光效率更高,在低浓度下也能获得清晰的信号。
在活细胞成像实验中,这种优势表现得尤为明显。用 Th-TMR-Halo 探针标记细胞核内的 Halo-NLS 蛋白,细胞核的荧光强度是细胞质背景的14.1 倍;而 Fu-CR-Halo 的核质比更是达到16.6 倍—— 这意味着几乎没有背景干扰,成像效果堪比 “超高清”。
2. 细胞兼容性:无洗涤、低浓度、长时程,不干扰细胞正常活动
传统荧光成像的最大痛点之一,就是 “洗涤步骤” 对细胞的干扰。而这项技术的 “无洗涤” 特性,从根本上解决了这个问题。
实验显示,即使在500 nM的浓度下,探针加入细胞后无需任何洗涤,直接成像就能获得清晰的信号。更令人惊喜的是,该探针在低至5 nM的浓度下仍能检测到目标蛋白 —— 这比传统探针的工作浓度低了一个数量级,大大降低了潜在的细胞毒性。
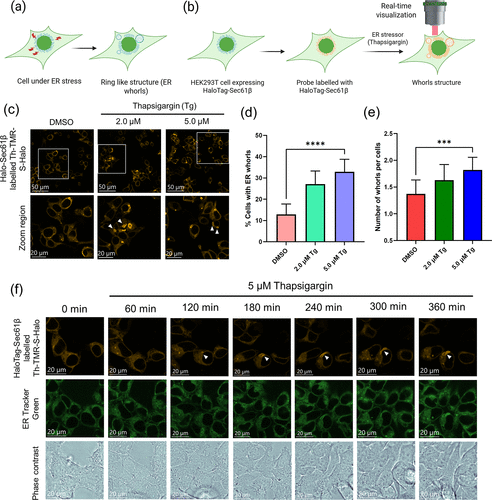
细胞毒性实验证明,即使在20 μM的高浓度下,探针处理细胞 24 小时后,细胞存活率仍保持在 90% 以上,远低于传统探针的毒性水平。这意味着它可以用于长时程追踪实验,比如持续 6 小时观察内质网应激反应 —— 而传统探针由于毒性和背景信号累积,往往无法超过 1 小时。
时间 lapse 成像数据显示,Th-TMR-Halo 探针加入细胞后,9.6 分钟就能达到最大荧光强度的一半,15 分钟后就能稳定成像。这对于追踪蛋白质运输、细胞器动态等快速过程来说,是至关重要的 —— 比如在观测内质网涡旋形成时,探针能够捕捉到从 0 到 360 分钟的完整动态,为理解内质网应激机制提供了全新的视角。
3. 应用范围:从基础研究到临床诊断的全场景覆盖
这项技术的模块化设计,让它具有极强的扩展性,几乎可以覆盖细胞生物学和医学研究的所有场景。
在基础研究领域,它可以用于实时追踪蛋白质的亚细胞定位、互作和动态变化。比如研究团队用它成功观测了内质网在应激状态下形成的 “涡旋结构”—— 这是一种与细胞凋亡相关的特殊结构,传统技术由于需要洗涤,无法捕捉到其形成的完整过程。而该探针通过无洗涤长时程成像,清晰展示了从应激开始到涡旋形成的 6 小时动态,为理解内质网应激机制提供了全新的视角。
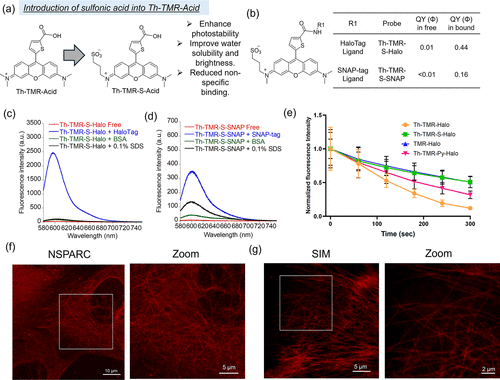
在超分辨成像领域,研究团队通过引入磺酸基团对探针进行优化(Th-TMR-S-Halo),大幅提升了光稳定性 —— 在连续激光照射下,其荧光衰减速度远慢于传统探针,能够满足超分辨显微镜(如 NSPARC、SIM)的成像需求。实验中,它成功在活细胞中实现了微管网络的超分辨成像,空间分辨率达到200 nm,这对于解析细胞骨架的精细结构具有重要意义。
在临床诊断和药物筛选领域,针对 BRD4 和 EGFR 的探针展现出了巨大的应用潜力。EGFR 探针 Gefi-T 能够特异性识别 EGFR 过度表达的癌细胞,不仅可以用于癌症的早期诊断,还能评估药物对 EGFR 的抑制效果 —— 比如在药物处理后,通过荧光强度的变化,就能快速判断药物是否有效,这将大幅缩短药物筛选的周期,降低研发成本。
更重要的是,该探针的无洗涤特性,让它有望应用于活体成像—— 未来,可能实现对小鼠等模式生物体内肿瘤的实时监测,而无需进行复杂的样品处理,这对于评估肿瘤进展和药物疗效具有革命性的意义。
四、应用展望、局限性与未来路线图
尽管这项技术取得了突破性进展,但它并非完美无缺,仍有一些局限性需要在未来的研究中解决。
首先,针对 SNAP-tag 的探针存在一定的非特异性结合问题。实验显示,Th-TMR-SNAP 探针在与 BSA(牛血清白蛋白)孵育时,会出现轻微的荧光增强,这意味着它可能与细胞内的其他蛋白发生非特异性结合,影响信号的准确性。研究团队通过引入磺酸基团优化后,这一问题得到了缓解,但仍未完全消除 —— 未来可能需要进一步优化靶向模块的结构,提升结合特异性。
其次,部分探针需要辅助试剂来提升信号质量。比如在检测 BRD4 和 EGFR 时,需要加入 MitoTracker Deep Red(线粒体探针)来区分非特异性信号,这增加了实验的复杂性。未来的优化方向可能是通过结构设计,让探针本身具有更强的靶向特异性,无需辅助试剂即可实现高信噪比成像。
此外,探针的细胞渗透性虽然大幅提升,但对于某些特殊细胞类型 —— 比如植物细胞、真菌细胞或具有多层细胞膜的细胞 —— 可能仍存在渗透困难的问题。未来可能需要针对不同细胞类型,优化探针的疏水特性和靶向模块,实现全细胞类型的覆盖。
尽管存在这些局限性,这项技术的应用前景依然非常广阔。在基础研究领域,它将成为细胞生物学、分子生物学研究的 “标配工具”,让研究者能够以更高的分辨率、更长的时程、更低的干扰,观察细胞内的分子动态;在医学研究领域,它将为癌症诊断、药物筛选、疾病机制研究提供全新的手段,加速新药研发和临床转化的进程。
未来的发展路线图可能包括三个方向:一是拓展探针的光谱范围,开发近红外甚至红外区域的探针,进一步降低生物组织的背景吸收,实现活体深层组织成像;二是提升探针的响应速度和光稳定性,满足更快动态过程的追踪和更长时程的观测需求;三是开发多靶点探针,实现对多个分子或细胞器的同时成像,为解析复杂的细胞网络提供工具。
从更长远的角度来看,这项技术的核心创新 ——“旋转控制型荧光开关”—— 可能会被应用到更多类型的荧光分子中,催生一系列具有高特异性、高渗透性、无洗涤特性的新一代荧光探针。届时,我们观察活细胞,可能就像看一场实时直播,细胞内的每一个分子动态、每一个细胞器变化,都能被清晰、准确、无干扰地捕捉到 —— 这不仅会推动生命科学研究的飞速发展,也可能为疾病的早期诊断和精准治疗带来革命性的突破。
结语:小结构,大变革
有时候,科学的突破往往源于一个简单的想法。用五元杂环替换苯基,这个看似微不足道的结构改造,却彻底解决了困扰荧光探针技术 40 年的核心难题。
这项研究的真正价值,不仅在于创造了一系列性能卓越的探针,更在于它重新定义了荧光探针的设计逻辑 —— 从 “控制化学结构的开合” 到 “控制_分子内旋转_”,这个思路的转变,为荧光成像技术打开了一扇全新的大门。
未来,当我们在实验室里用这项技术实时观察细胞内的分子动态,当医生用它来快速诊断癌症、评估药物疗效,当新药研发人员用它来大幅缩短筛选周期 —— 我们都会想起这个看似简单却极具智慧的设计。
科学的进步,往往就是这样:一个小小的结构改变,带来一场大大的技术革命。而这场革命的起点,只是研究者们对 “分子旋转” 的一次深入思考。