【JACS】160 倍荧光反差!南大学者破解花菁染料困局,近红外二区肾清除探针让急性肾损伤检测灵敏度飙升 3.6 倍
✨文章标题:An N-Alkylpyridinium-Substituted Cyanine Platform for Constructing Renal-Clearable Near-Infrared Fluorogenic Probes ✉️作者:Yuncong Chen* 等 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c19142
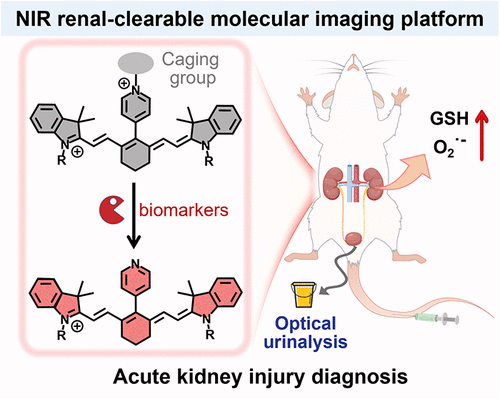
在分子影像和疾病诊断领域,花菁染料是当之无愧的 “明星材料”。凭借近红外光(NIR)的深层组织穿透能力和低自发荧光干扰,它被广泛用于传感器、手术导航和光热治疗,甚至已有叶酸 - 花菁偶联物被 FDA 批准用于卵巢癌术中识别。但一个致命短板长期制约其发展:慢肝清除特性导致的慢性毒性风险,让这类高效成像剂的临床应用始终受限。
与此同时,急性肾损伤(AKI) 正成为全球医疗难题 —— 药物、感染、创伤等都可能诱发,传统依赖血清肌酐(SCr)和血尿素氮(BUN)的检测方法,不仅灵敏度低,还存在 6-12 小时的诊断滞后,常常错失最佳治疗窗口。
南京大学生命科学与化学交叉团队的最新研究,一举破解了这两大痛点。他们在《美国化学会志》(JACS)发表的成果,开发出全球首个基于 N - 烷基吡啶𬭩修饰的肾清除近红外荧光探针平台,实现了 “快速肾清除 + 精准刺激响应 + 尿液无创检测” 的三重突破,让 AKI 诊断灵敏度比传统方法提升 3.6 倍,为生物成像和疾病诊断开辟了全新路径。
一、从 “痛点” 到 “突破”:为什么这场 “染料革命” 至关重要?
花菁染料的困境,本质是 “清除路径错配”。传统花菁染料进入体内后,90% 以上通过肝胆系统清除,代谢缓慢且在肝脏长期蓄积。由于花菁染料本身具有一定细胞毒性,这种蓄积会引发慢性肝损伤风险,这也是其临床转化的最大障碍。
为解决肾清除问题,此前科研界曾尝试引入亲水基团或两性离子修饰,但合成过程繁琐,且难以通过柱层析纯化,无法规模化应用。这就像给染料 “穿了件防水衣”,虽然增加了水溶性,却让生产和提纯变得异常复杂。
而 AKI 诊断的痛点同样尖锐。肾脏是人体 “过滤器”,对毒素极为敏感,但早期损伤时,SCr 和 BUN 的变化极其微弱,等到指标明显升高,肾脏往往已出现不可逆损伤。数据显示,传统方法对轻度 AKI 的漏诊率高达 40%,而延误治疗会让患者的重症风险增加 3 倍。
南大学者的研究,恰好击中了这两个核心痛点:通过分子结构的精准调控,让花菁染料从 “肝靶向蓄积” 变为 “肾快速清除”,同时赋予其 “病灶激活” 的智能响应能力,最终实现 “尿液荧光读数” 的无创检测。这一突破不仅解决了花菁染料的毒性难题,更让 AKI 诊断进入 “实时、灵敏、无创” 的新阶段。
二、核心方法与技术细节:给染料装 “智能导航 + 开关”
要理解这项技术的精妙,不妨把探针比作 “带着导航和智能开关的荧光探测器”—— 导航负责精准抵达肾脏并快速排出,开关则保证只在病灶处发光,两者结合实现高效检测。
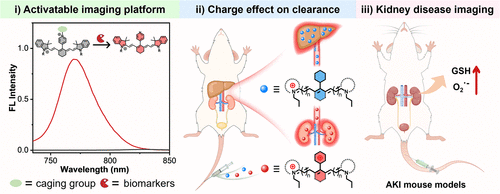
1. 荧光开关:160 倍反差的 “分子魔术”
团队的核心发现是:对花菁染料 meso 位的吡啶基团进行甲基化修饰(CyP-Me),能引发剧烈荧光淬灭。实验数据显示,未甲基化的 CyP 荧光量子产率为 0.15,而甲基化后的 CyP-Me 仅为 0.009,两者在 785nm 处的荧光强度相差高达 160 倍。
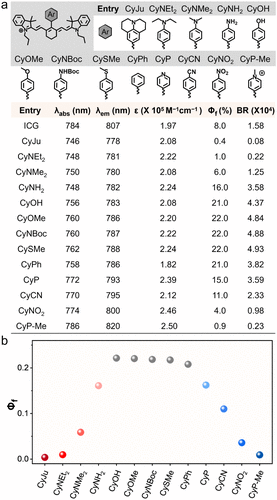
这种淬灭效应并非单一机制,而是PET(光诱导电子转移)和 TICT(扭曲分子内电荷转移)的协同作用。简单来说,甲基化后的吡啶𬭩基团像一个 “电子陷阱”,吸收了染料激发态的电子,同时分子结构发生扭曲,让荧光能量以热能形式散失,相当于给荧光 “关了灯”。
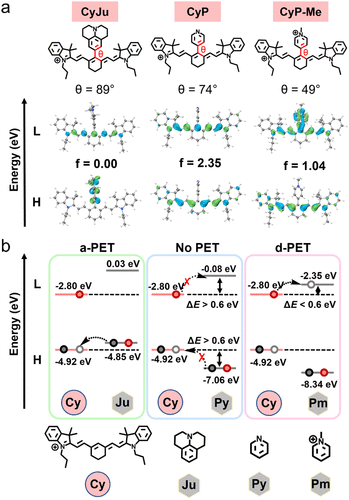
而当探针遇到 AKI 病灶处的特征生物标志物(如谷胱甘肽 GSH、超氧阴离子 O₂⁻)时,探针上的 “自焚基团” 会被特异性切割,释放出未甲基化的 CyP,荧光瞬间 “开灯”,形成强烈的信号反差。这种 “淬灭 - 激活” 的切换,让背景噪音降到最低,信号辨识度大幅提升。
2. 肾清除导航:正电荷介导的 “精准投递”
传统花菁染料难以肾清除,关键是缺乏与肾脏的 “亲和力”。肾脏的肾小球滤过膜表面,覆盖着大量带负电的硫酸乙酰肝素(HS)蛋白聚糖,就像一张 “负电过滤网”。
团队在染料中引入吡啶𬭩基团,相当于给染料带上了 “正电荷标签”。根据静电相互作用原理,带正电的探针会与带负电的 HS 蛋白聚糖快速结合,从而被肾小球优先捕获并排出,实现 “肾靶向清除”。实验证实,这类带正电的探针 24 小时肾清除率高达 74.9%,而肝脏蓄积量仅为传统花菁染料的 1/3。
更重要的是,这种设计无需复杂修饰,仅通过简单的甲基化反应即可实现,合成过程简便且易于纯化。这就像给染料装了个 “磁铁导航”,无需额外改造,就能精准对接肾脏的 “负电靶点”。
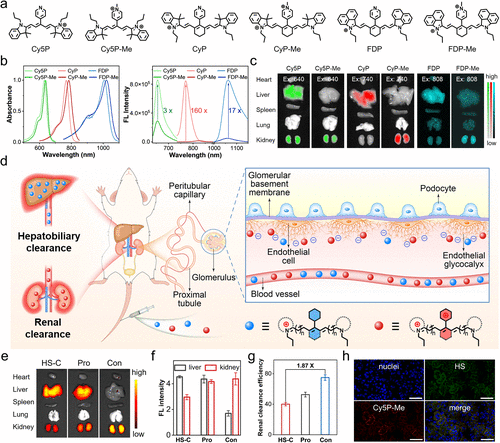
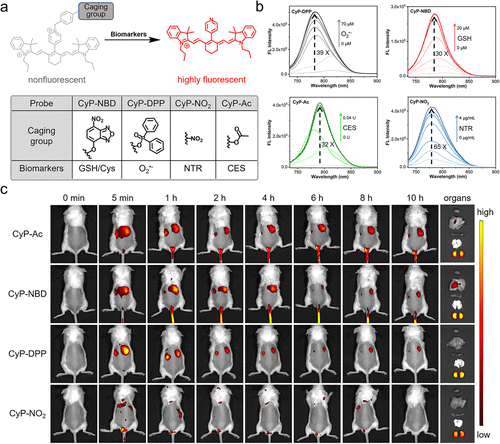
3. 通用平台:4 种探针适配多场景检测
基于这一设计,团队构建了通用型肾清除荧光探针平台,并合成了 4 种代表性探针:CyP-NBD(检测 GSH/Cys)、CyP-DPP(检测 O₂⁻)、CyP-NO₂(检测硝基还原酶 NTR)、CyP-Ac(检测羧酸酯酶 CES)。
这些探针都具备两大核心特性:一是近红外荧光响应(发射波长 825nm 左右),能穿透组织且避免自发荧光干扰;二是优先肾清除,肾脏荧光强度是肝脏的 3 倍以上。实验显示,探针在 Dulbecco 改良培养基(DMEM)中 24 小时稳定性良好,且对 HK2 肾细胞无明显细胞毒性(浓度≤5μM 时),为体内应用提供了安全保障。
三、数据背后的创新与颠覆性:用实验证明 “更优性能”
一项技术的价值,最终要靠数据说话。南大学者的研究通过大量体内外实验,证实了新探针平台的颠覆性优势,关键数据堪称 “碾压级”:
1. 清除效率:75% 以上通过肾脏排出
传统花菁染料如 ICG,24 小时肾清除率不足 10%,而新探针的肾清除率高达 74.9%。实验中,健康小鼠注射探针后,24 小时内肾脏信号降至 30 分钟时的 15%,而肝脏信号始终维持在低水平。这意味着探针能快速排出体外,大幅降低体内蓄积导致的毒性风险。
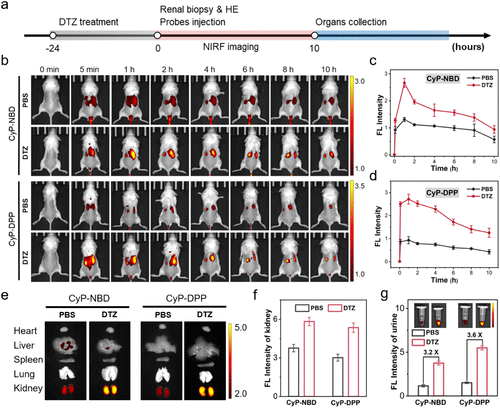
2. 检测灵敏度:比传统方法高 3.6 倍
在 DTZ(造影剂)诱导的 AKI 小鼠模型中,注射 CyP-NBD 和 CyP-DPP 探针后,AKI 小鼠的肾脏荧光信号分别是健康小鼠的 2.0 倍和 2.9 倍,而尿液荧光强度更是达到 3.2 倍和 3.6 倍。相比之下,传统 SCr 和 BUN 检测仅能检测到 1.35 倍和 1.5 倍的升高,灵敏度差距显著。
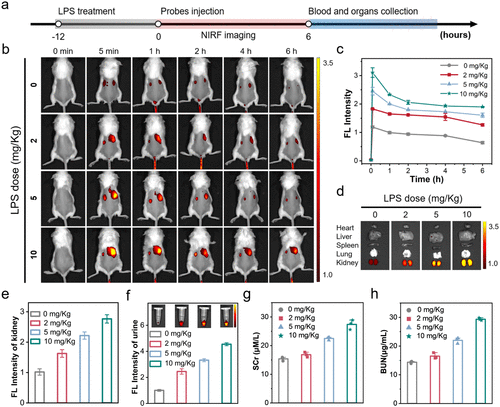
更令人惊喜的是,在 LPS(脓毒症)诱导的 AKI 模型中,即使是最低剂量(2mg/kg)的 LPS 处理,探针也能检测到 1.5 倍的荧光增强,而此时 SCr 和 BUN 的变化尚未达到临床诊断阈值。这意味着新探针能捕捉到 “亚临床阶段” 的肾损伤,为早期干预提供可能。
3. 普适性:三种 AKI 模型均有效
团队在 DTZ(造影剂诱导)、LPS(脓毒症诱导)、顺铂(药物诱导)三种不同机制的 AKI 小鼠模型中进行了验证,结果显示探针均能有效检测到损伤信号。其中,顺铂诱导模型中,探针的尿液荧光增强分别为 2.3 倍(CyP-NBD)和 2.9 倍(CyP-DPP),证实了平台的广泛适用性。
4. 特异性:只对病灶 “亮灯”
为排除非特异性激活,团队测试了 CyP-NO₂探针(检测 NTR),发现其在 AKI 小鼠和健康小鼠中的荧光信号无显著差异。这说明探针的荧光激活是 “生物标志物特异性” 的,而非炎症或血管渗漏导致,避免了假阳性结果。
四、应用展望、局限性与未来路线图
1. 应用场景:不止于肾损伤检测
这项技术的潜力远不止 AKI 诊断。由于其非侵入性尿液检测的特性,未来可拓展至:
- 药物肾毒性筛查:在药物临床试验中,实时监测药物对肾脏的损伤,降低研发风险;
- 慢性肾病进展监测:通过尿液荧光变化,动态评估肾病患者的肾功能状态;
- 其他疾病诊断:通过更换自焚基团的靶点,开发针对肝癌、糖尿病肾病等疾病的探针,实现 “一平台多用途”。
此外,肾清除探针还可用于脂肪肝、癌症靶向成像等领域,此前已有研究证实这类探针在肿瘤检测中的潜力。
2. 当前局限性:仍需跨越的 “三座大山”
尽管表现优异,这项技术仍存在需要完善的地方:
- 规模化制备:目前实验室合成规模为毫克级,要实现临床应用,需优化工艺实现公斤级生产;
- 成本控制:吡啶𬭩修饰的花菁前体合成成本较高,未来需开发更廉价的前体或简化合成步骤;
- 长期安全性:虽然短期实验未发现毒性,但长期反复使用的安全性仍需进一步验证。
3. 未来路线图:从实验室到病床
团队的下一步目标的是推进技术的临床转化,大致分为三个阶段:
第一阶段(1-2 年):优化探针的药代动力学特性,完成大动物(如猪、猴)的安全性和有效性验证;
第二阶段(2-3 年):开展临床试验,针对造影剂诱导和脓毒症诱导的 AKI 患者,验证探针的诊断性能;
第三阶段(3-5 年):开发多标志物联合检测试剂盒,实现对不同类型肾损伤的精准分型和预后评估。
这项研究的意义,不仅在于开发了一种高性能探针,更在于建立了 “结构 - 性质 - 功能” 的明确关联 —— 通过调控 meso 位取代基的电子结构和电荷特性,就能同时实现荧光响应和肾清除。这为功能导向的分子影像剂设计提供了全新范式,未来可能催生出一系列 “智能、安全、无创” 的诊断工具。