【JACS】1300纳米下的“生命闪烁”:科学家驯服远古嗜热菌,实现深层组织8毫米钙成像新突破
✨文章标题:In Vivo Calcium Imaging in the Near-Infrared II WindowClick to copy article link ✉️作者:Long-Jiang Yu* Hongjie Dai* Feifei Wang* 等 🔗链接:https://doi.org/10.1021/jacs.5c13641
在生命科学的世界里,如果说基因是生命的蓝图,那么钙信号(Calcium Signaling) 就是生命实时运行的“指挥号角”。从心脏的每一次跳动,到大脑中每一个灵感的迸发,本质上都是钙离子在细胞内外奔涌的结果。
然而,想要“看清”活体动物深层组织里的钙信号,一直是科学界的一块心病。传统的成像技术就像是隔着厚厚的毛玻璃看室内,只能看到模糊的光影,却看不清细节。
近日,一项发表在《美国化学会志》(JACS)上的重磅研究打破了这一僵局。来自香港大学、斯坦福大学等机构的联合研究团队,从一种生活在黄石公园热泉里的远古细菌身上获取灵感,开发出了一种全新的近红外二区(NIR-II)钙离子指示剂。
这种新工具不仅将成像深度提升到了惊人的8毫米,更在灵敏度上比前代技术提升了近10倍。今天,我们就来深度拆解这项足以改写深层组织成像规则的硬核研究。
一、 从“痛点”到“突破”:为什么我们急需看透深层的“钙”?
钙信号不仅关乎生理功能,更是癌症诊断与治疗的关键。在肿瘤的发生、发展乃至转移过程中,钙平衡的紊乱往往是恶性表型增强的信号。然而,现有的钙成像技术面临着一个尴尬的“浅尝辄止”困境。
目前主流的可见光(400-700 nm)钙指示剂,如著名的GCaMP系列,虽然在实验室培养皿里表现神勇,但一旦进入活体组织,就会遭遇三大杀手:光散射、组织背景荧光、以及极浅的穿透深度。
通常情况下,可见光单光子成像的穿透深度仅为100微米左右,甚至穿不透一张打印纸。虽然两光子或多光子显微镜能勉强达到1毫米,但其成像速度慢、视野小的缺陷,让实时监测深层器官或大体积肿瘤变得难如登天。
医学界急需一种能像X光一样“看穿”软组织,又能像荧光成像一样灵敏捕捉分子变化的工具。这正是本研究的核心意义所在:利用近红外二区(NIR-II,1000-3000 nm)这一窗口,实现真正的无创、深层、高分辨率活体钙成像。
二、 核心方法与技术细节:热泉细菌里的“天然传感器”
既然人造的分子暂时达不到要求,科学家们决定向大自然求助。他们将目光锁定在了一种名为Thermochromatium (Tch.) tepidum的嗜热紫色硫细菌身上。
1. 远古细菌的“深海雷达”
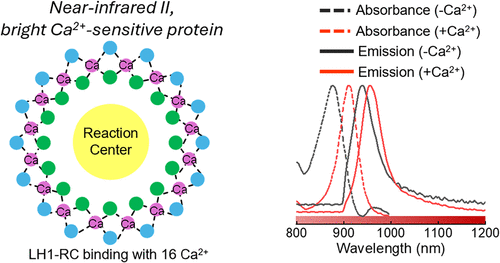
这种细菌生活在富含碳酸钙的极端环境(如黄石公园的马龙热泉)中,它的生存高度依赖钙离子。为了在这种环境中高效捕获光能,它进化出了一套极其特殊的“天线”系统——LH1-RC(光捕获1-反应中心)复合体。
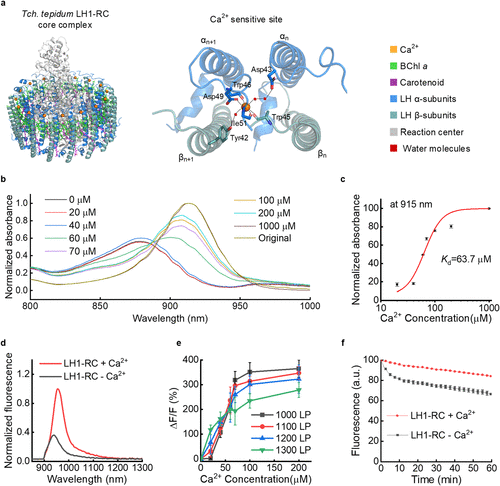
研究人员发现,这个复合体简直就是大自然精密设计的“钙传感器”。它呈现椭圆形,结构中包含16个钙离子结合位点和32个细菌叶绿素a(BChl a)分子。
2. 变色龙般的物理机制:激子耦合
如果把LH1-RC比作一台复杂的乐器,那么钙离子就是调节音准的旋钮。当钙离子缺失时,这个复合体的吸收峰位于879纳米;而一旦16个位点被钙离子填满,吸收峰会迅速红移至915纳米。
这种变化的本质是 “激子耦合” 。简单来说,钙离子的加入改变了蛋白质的构象,使得其中的叶绿素分子排布得更紧密、更规则。就像一群原本各唱各的歌手,在指挥(钙离子)的调度下,整齐划一地发出了频率更低、穿透力更强的“重低音”。
3. 脂质体“特洛伊木马”策略
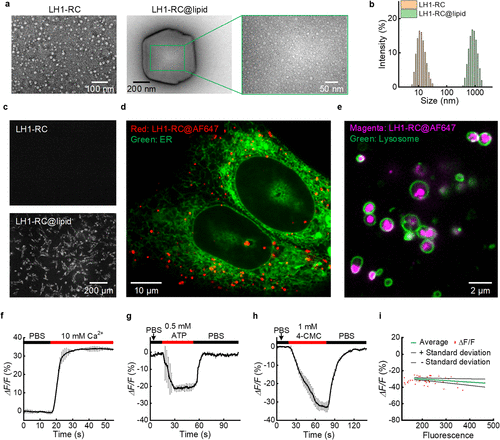
然而,天然蛋白质想要进入哺乳动物细胞并不容易。研究团队巧妙地采用了脂质体封装(LH1-RC@lipid)策略。
他们将这种蛋白质包裹在直径约900纳米左右的脂质小球里。这个小球就像一辆特洛伊木马,能轻松通过细胞的胞吞作用,将钙指示剂运送到细胞内部的“前哨站”——溶酶体。
4. 摆脱CaM的“另类路线”
值得注意的是,传统的基因编码钙指示剂(GECI)大多依赖钙调蛋白(CaM)的构象变化。但LH1-RC提供了一种完全不同的机制,它不需要复杂的基因工程改造就能直接表现出极高的热稳定性和化学稳定性,这为未来的临床转化打下了坚实基础。
三、 数据背后的创新与颠覆性:8毫米下的视觉震撼
科学研究最终要靠数据说话。在这篇论文中,LH1-RC展现出的性能数据足以令同行惊叹。
1. 穿透深度的降维打击:从3毫米到8毫米
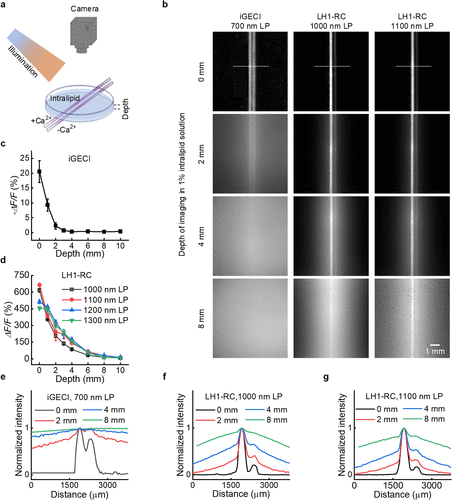
研究人员设计了一个“模拟肌肉”实验。他们将填充了指示剂的毛细管埋入1%浓度的脂肪乳剂(Intralipid)中,这种液体能精准模拟人体组织对光的散射。
对比结果令人震撼:
传统近红外一区指标(iGECI): 当深度超过3毫米时,信号就彻底消失在背景噪声中,信噪比几乎归零。
本研究的LH1-RC: 在8毫米的深度下,依然能清晰捕捉到钙信号的变化。
这意味着,LH1-RC的穿透能力是前代技术的近3倍。在生物成像领域,这几毫米的差距代表着从“皮肤表面”到“内脏器官”的跨越。
2. 灵敏度的飞跃:10倍于前代的波动捕捉
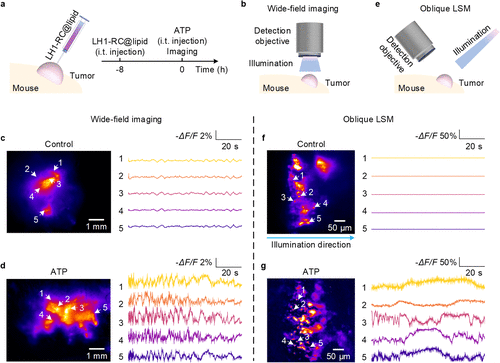
在活体HeLa肿瘤的ATP刺激实验中,研究团队利用宽场成像系统观察到了明显的钙波。数据显示,LH1-RC捕捉到的荧光强度变化率(-ΔF/F)是此前NIR-GECO1指示剂的10倍以上。
更令人兴奋的是,当配合光片显微镜(LSM) 使用时,由于背景噪声被极大地抑制,这种钙信号的变化率甚至达到了惊人的82.1%。这意味着我们不仅能看到肿瘤在“动”,还能以细胞级的精度看清它是怎么“跳动”的。
3. 极高的光稳定性:5瓦激光照射1小时不掉线
对于实时成像来说,光致褪色是致命伤。研究人员用功率高达5瓦的915纳米激光对LH1-RC进行了长达60分钟的连续轰击。
实验显示,在有钙离子存在的情况下,该指示剂的荧光强度仅下降了16%。相比之下,现有的近红外钙指示剂往往在几分钟内就变得黯淡无光。这种超强的“续航能力”让长时程、连续的治疗监测成为可能。
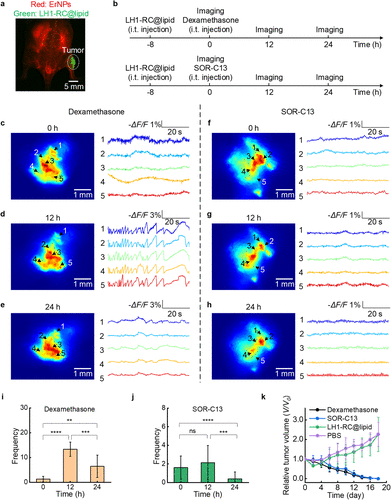
4. 两种抗癌药物的实时“阅卷”
研究团队将这一工具应用到了A549肺癌肿瘤的治疗评估中,对比了两种临床药物:
地塞米松(Dex): 这种药物能上调TRPV6钙通道,增加细胞内钙浓度。通过NIR-II成像,科学家们清晰地观察到了高频、高幅度的钙闪烁,证明了药物正在起效。
SOR-C13: 这是一个抗结剂,负责抑制钙通道。成像结果显示,在给药24小时后,肿瘤内部原本活跃的钙信号被显著抑制。
这一对比实验证明,LH1-RC不仅是一个成像工具,更是一面 “药效反光镜”。医生或研究员可以在不需要手术取样的情况下,直接在活体身上“看到”药物是否达到了预期的分子靶点。
四、 应用展望、局限性与未来路线图
尽管LH1-RC在深层成像上表现优异,但作为一项前沿研究,它仍有待完善之处。
目前的局限性
首先是遗传编码问题。目前LH1-RC仍属于外源性递送蛋白,无法像GCaMP那样通过基因转染让动物体自身表达。这限制了它在神经科学领域(如特定神经元回路长期追踪)的应用。
其次是细胞内定位。目前的脂质体递送主要将蛋白送往溶酶体。虽然这对于研究溶酶体与内质网的“钙交流”非常有意义,但如果想要监测细胞质中的全局信号,还需要开发更精准的靶向引导肽。
未来的应用场景
肿瘤切除术中导航: 凭借其高分辨率和深层穿透力,LH1-RC可以帮助外科医生在手术中精准识别肿瘤边界,甚至发现隐藏在深层组织中的微小转移灶。
脑部肿瘤研究: 无需像以前那样在小鼠头顶挖开一个“玻璃窗”(颅窗),直接实现穿颅骨的钙信号监测,这对神经肿瘤学是革命性的进步。
心脏与内脏代谢监测: 实时观察活体心脏跳动过程中的钙循环,或肝脏等深层器官在药物代谢时的细胞反应。
路线图:通往“完美指示剂”
未来的研究方向非常明确:
基因敲除优化: 移除LH1-RC中的反应中心(RC),只保留光捕获部分。这样可以彻底消除光合作用过程中产生的电子传递,进一步提升生物安全性。
分子量小型化: 通过结构生物学手段,精简蛋白序列,使其更易于表达和转运。
多色成像: 开发出不同波段的NIR-II钙指示剂,实现像“多色彩灯”一样同时监测多种离子的动态。
总结而言,这项研究不仅是从热泉细菌到哺乳动物跨越亿万年的生理联结,更是深层活体成像技术的一次“破障之战”。当钙信号在1300纳米的波段闪烁,生命的最深处细节,正首次清晰地呈现在人类眼前。