【JACS】突破衍射极限!14.6倍近红外荧光增强技术让活细胞RNA成像实现40纳米超清分辨率
✨文章标题:A Near-Infrared Aptamer:Dye System For Live-Cell Super-Resolution RNA Imaging ✉️作者:Murat Sunbul* , Andres Jäschke* 等 🔗链接:https://doi.org/10.1021/jacs.5c16419
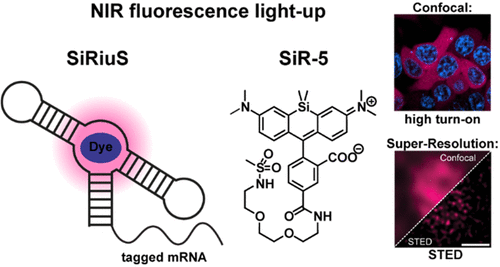
科学家们将RNA成像技术推向新高度,首次在哺乳动物活细胞中实现近红外超分辨成像
在细胞生物学领域,RNA成像技术一直面临着一个巨大挑战:如何在不干扰细胞正常功能的情况下,清晰观察RNA分子的动态变化。传统方法如同在黑夜中用手电筒寻找细微物体,要么分辨率不足,要么对细胞造成伤害。
现在,这一困境被彻底打破。德国海德堡大学的研究团队开发出了SiRiuS:SiR-5系统,这一突破性技术将RNA成像带入了一个全新纪元。
从“痛点”到“突破”:为什么RNA成像如此困难却又如此重要?
RNA是生命活动的关键执行者,从基因表达到细胞应激响应,无处不在。然而,RNA成像却长期面临三大技术瓶颈:
首先,细胞中不存在天然荧光RNA,研究人员必须借助“外援”进行标记。传统方法如荧光原位杂交(FISH)需要固定细胞,无法用于活体观察;而MS2-MCP系统虽然可用于活细胞,但庞大的蛋白质标签会严重干扰RNA的正常代谢和功能。
其次,可见光范围内的成像技术受到细胞自发荧光的严重干扰,信噪比低,就像在强光下观察星星,细节被完全淹没。
最重要的是,传统荧光显微镜的分辨率受限于光的衍射极限(约200纳米),而许多RNA聚集体的尺寸远小于这一极限,导致科学家们无法看清其精细结构。
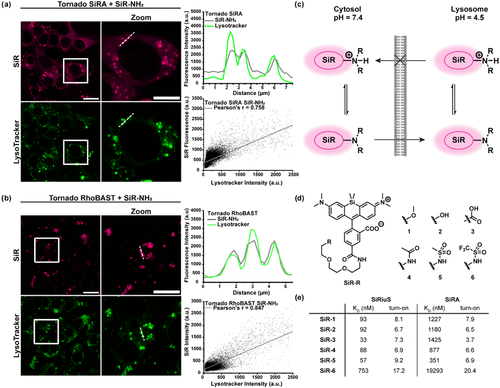
荧光点亮适配体(FLAPs)技术的出现曾带来一线希望。这些结构化RNA链能特异性结合荧光染料并激活其发光,无需固定细胞或共表达蛋白质。然而,在近红外区域的高性能FLAPs系统几乎为空白,而近红外成像恰恰具有最小化细胞自发荧光、减少光毒性和增强组织穿透性的独特优势。
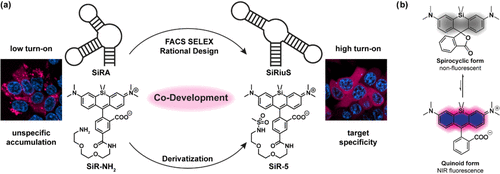
2019年,该团队曾开发出SiRA系统,它在细菌中表现优异,实现了超分辨成像。但当应用于哺乳动物细胞时,荧光增强效果微乎其微,且染料会在细胞内形成聚集,严重影响使用效果。
面对这一困境,研究人员决定从头开始,采用一种全新的策略:同步进化适配体和染料,打造真正适用于哺乳动物活细胞RNA成像的近红外超级工具。
核心方法与技术细节:如何打造完美的RNA“荧光标签”?
革命性的筛选策略:不以结合力论英雄
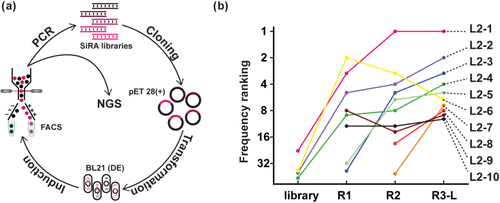
传统适配体筛选方法(SELEX)主要基于结合亲和力,但高亲和力并不保证高荧光增强。研究团队果断转向荧光激活细胞分选技术,直接在细胞中基于荧光强度进行筛选。
这一转变的关键在于:真正重要的是染料与适配体结合后能发出多强的光,而不仅仅是它们结合得多紧密。
研究人员将来自原始SiRA筛选第7轮和第14轮的DNA库克隆到表达载体中,转入大肠杆菌。通过诱导表达,固定细胞后与染料一起孵育,然后使用FACS分选高荧光细胞,回收其中的适配体序列进行下一轮筛选。
经过三轮迭代筛选,阳性细胞比例从最初的不足1.3%显著提升至4.5%,证明成功富集到了高效激活荧光的适配体序列。
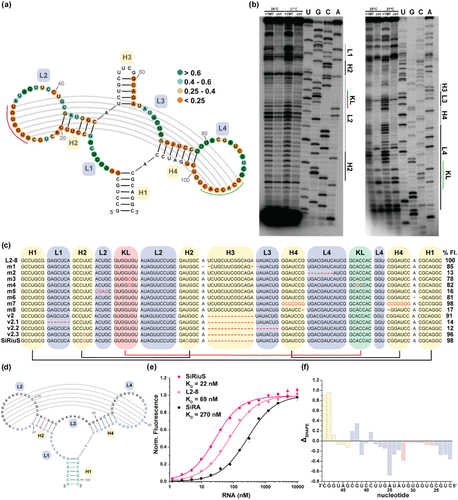
适配体结构的精准优化:从L2-8到SiRiuS的蜕变
从筛选出的候选适配体中,L2-8表现出最佳的细胞内信噪比,尽管其体外亲和力并非最高。这表明体外性能不能完全预测细胞内表现,细胞环境的复杂性远超试管条件。
通过SHAPE结构分析,研究人员揭示了L2-8的精细结构:一个四向连接结构,带有四个螺旋以及内部和顶端环。特别发现L2和L4环之间存在**“吻环相互作用”**——两个互补的7核苷酸序列相互识别,这对维持适配体功能结构至关重要。
基于这些发现,团队进行了系统性的突变和截断实验。令人惊讶的是,完全改变某些螺旋序列仍能保持荧光激活能力,证明适配体结构具有一定的容错性。然而,吻环相互作用的任何破坏都会导致功能丧失,凸显了其关键作用。
经过多轮优化,最终得到了SiRiuS适配体,其对SiR-NH2的解离常数(KD)达到22 nM,体外荧光增强8.4倍,相比SiRA和L2-8有显著提升。
染料工程的巧妙革新:解决细胞内聚集难题
原系统在哺乳动物细胞中的失败主要归因于染料的溶酶体积累。研究发现,SiR-NH2染料会聚集在酸性细胞器中,与适配体表达无关。
问题根源在于染料的末端氨基基团:中性的螺环形式可以自由穿过溶酶体膜,但在酸性环境中,氨基被质子化形成铵阳离子,无法再穿过膜,导致 “离子陷阱”效应。
研究团队合成了六种SiR衍生物,将末端氨基替换为非碱性基团,包括甲氧基、羟基、羧基、乙酰胺、甲磺酰胺和三氟甲磺酰胺基团。目标是保持高结合亲和力的同时,避免溶酶体积累。
通过系统评估,甲磺酰胺衍生物SiR-5脱颖而出,它在保持高亲和力(kD = 22 nM for SiRiuS)的同时,完全解决了聚集问题,在活细胞中表现出均匀的胞质分布。
数据背后的创新与颠覆性:为什么说这是一项里程碑式成就?
惊人的性能提升:从微不足道到卓越非凡
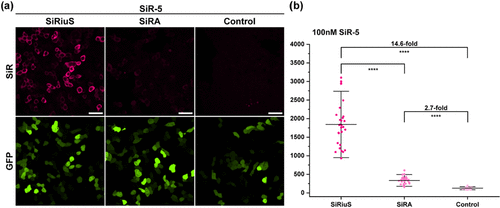
性能对比结果令人震撼:在优化后的显微镜设置下,SiRiuS:SiR-5系统实现了14.6倍的荧光增强,而SiRA仅达到2.7倍。这一近5倍的提升使得活细胞RNA成像从未如此清晰。
更令人印象深刻的是,这一卓越性能在低染料浓度(100 nM)下即可实现,极大降低了潜在细胞毒性。系统在HEK293T、HeLa和COS-7三种常用细胞系中均表现一致,证明其广泛适用性。
离子依赖性测试揭示了SiRiuS的另一优势:相比SiRA对镁离子的高度依赖,SiRiuS在生理镁离子浓度范围内(0.25-1 mM)保持95%以上荧光强度,甚至在1μM极低浓度下仍保持90%性能。这一特性使其更适合于体内应用,因为细胞内镁离子浓度可能存在波动。
光稳定性测试结果同样令人鼓舞:在连续照射25分钟后,共价标记的蛋白质荧光信号下降55%,而SiRiuS:SiR-5系统仍保持85%的初始强度。这种卓越的光稳定性对于长时间活细胞成像至关重要。
活细胞mRNA成像:从静态观察到动态追踪
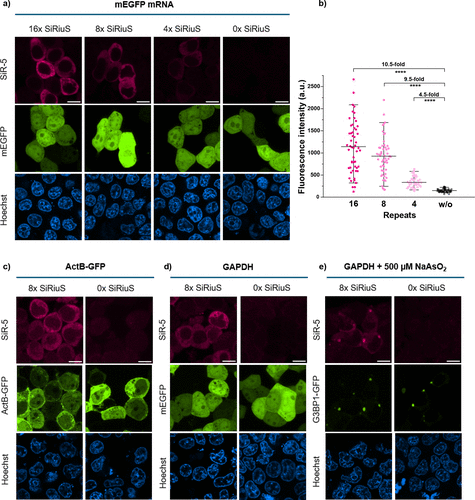
研究人员将8个SiRiuS适配体重复序列插入多种mRNA的3‘非翻译区,成功实现了活细胞mRNA成像。选择8重复是基于实验优化:虽然从4增加到8重复时荧光信号成比例增强,但从8到16重复时改善有限,表明8重复在信号强度和细胞负担间达到了最佳平衡。
团队成功对GAPDH和肌动蛋白β等内源性mRNA进行成像,这些mRNA在细胞质中均匀分布,与既往报告一致。Northern印迹分析确认,带标签的mRNA在降解过程中未产生可能造成假阳性信号的结构片段。
真正展示系统威力的是应激颗粒形成过程的动态观察。应激颗粒是细胞在应激条件下形成的相分离凝聚体,参与多种细胞过程。研究人员用砷酸钠处理细胞诱导氧化应激,成功观察到了GAPDH mRNA向应激颗粒的募集过程。
时间序列成像显示,较大的G3BP1-GFP颗粒在应激后10-15分钟开始形成,GAPDH SiRiuS信号在15分钟后可见在颗粒中积累。更重要的是,应激缓解后,团队还观察到了应激颗粒的分解过程,完整记录了这一动态细胞事件的始终。
超分辨成像的突破:打破衍射极限,看清纳米世界
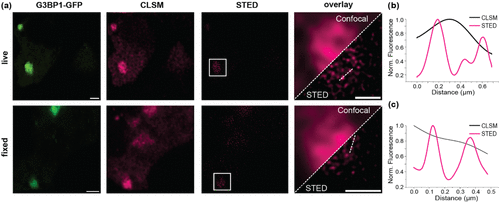
最令人振奋的成就是SiRiuS:SiR-5系统在STED超分辨显微镜中的应用。刺激发射损耗显微镜通过使用耗尽激光抑制焦点外围荧光,突破衍射极限,但此前近红外FLAPs系统未在哺乳动物细胞中实现这一技术。
研究人员对表达GAPDH mRNA的细胞进行成像,在活细胞中达到94纳米分辨率(相比共聚焦的419纳米),在固定细胞中更是达到了惊人的43纳米分辨率(共聚焦为311纳米)。这意味着科学家现在能够以前所未有的清晰度观察RNA在细胞内的纳米级组织。
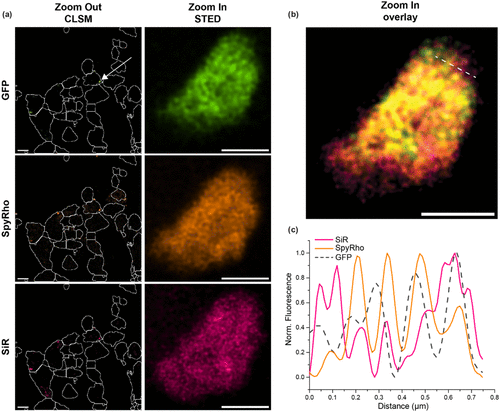
多色STED成像进一步展示了系统的实用性。研究人员将SiRiuS:SiR-5系统与之前开发的RhoBAST:SpyRho系统(工作波长较短)结合,同时观察两种不同mRNA在应激颗粒中的分布。有趣的是,GAPDH和mAzurite mRNA聚集并不完全共定位,暗示应激颗粒内可能存在更精细的RNA区室化。
应用展望、局限性与未来路线图
当前研究的局限性
尽管SiRiuS:SiR-5系统表现卓越,但仍存在一些局限性。首先,系统的激发波长(664 nm)与标准共聚焦显微镜的固定640 nm激光不完全匹配,未能充分利用其红移特性。使用全谱可调激光器可能进一步提升信噪比。
其次,虽然系统在多种细胞系中验证有效,但在更复杂体系(如组织、胚胎或活体动物)中的性能仍需进一步验证。近红外光虽然组织穿透性更好,但生物体内的散射和吸收可能影响成像效果。
此外,目前工作主要关注mRNA成像,对非编码RNA(如长非编码RNA)的应用潜力尚未充分探索。这些RNA分子通常表达量更低,定位更特异,对成像系统灵敏度要求更高。
广阔的应用前景
SiRiuS:SiR-5系统的成功开发为细胞生物学研究开辟了众多新途径:
在基础研究领域,这一技术将使科学家能够实时观察RNA的转录、运输、定位和降解全过程,揭示基因表达的精细调控机制。特别适用于研究相分离凝聚体中的RNA行为,这是当前生物学的热点领域。
在疾病研究方面,系统可用于追踪疾病相关RNA的异常定位和行为,如神经退行性疾病中应激颗粒的形成机制,或病毒感染过程中病毒RNA的复制和运输。
药物开发应用潜力巨大,该技术可用于筛选影响RNA定位和功能的化合物,为开发靶向RNA的药物提供强大工具。
未来发展方向
基于当前成就,该技术有几个明确的未来发展路径:
首先,进一步优化染料化学,开发亮度更高、光稳定性更好的衍生物,可能将活细胞STED成像的分辨率推向新高度。
其次,扩展多色成像能力,开发更多正交系统,实现同时追踪多种RNA物种的相互作用,揭示RNA网络的复杂性。
最后,推动技术向体内应用发展,探索在模式生物乃至临床前模型中应用的可能性,最终实现人类疾病诊断和治疗的转化应用。
SiRiuS:SiR-5系统代表了RNA成像技术的一个里程碑,它不仅是第一个在近红外光谱区工作的FLAP系统,也是第一个在哺乳动物细胞中实现STED超分辨成像的系统。随着技术的进一步优化和应用的拓展,我们有理由相信,这束照亮RNA世界的“近红外之光”将引领我们进入细胞生物学研究的新时代。