🚀 【JACS】肿瘤治疗迎来大升级:新型光敏剂,用780纳米近红外光,在小鼠体内将肿瘤抑制率提升近4倍!
✨文章标题:π-Extended Ru–COUBPY Photosensitizers for In Vivo Anticancer Phototherapy Using One-Photon 780 nm Near-Infrared Light ✉️作者:Vicente Marchán* 等 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c15343
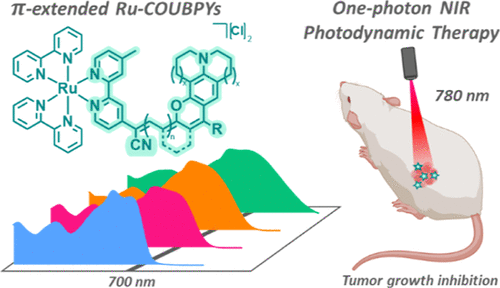
一、从“痛点”到“突破”:深层肿瘤的“光照”难题
癌症,无疑是人类健康面临的最大挑战之一。在五花八门的治疗手段中,光动力疗法(Photodynamic Therapy, PDT) 因其独特的优势——可以实现药物激活的精确空间和时间控制,正成为一个极具前景的方向。它的基本原理是:向患者体内注射一种无毒的药物(光敏剂,PS),当这种药物聚集到肿瘤部位后,用特定波长的光进行局部照射,光敏剂被激活,产生剧毒的活性氧(ROS),从而精准“炸毁”癌细胞和供血血管。
然而,PDT走向临床的道路上,一直有一个“阿喀琉斯之踵”:光照深度不够。
目前的临床光敏剂大多需要可见光(如蓝光、绿光)激活。但人体组织并非透明,这些短波长的光进入人体后,很快就会被血红蛋白、黑色素等内源性物质吸收殆尽,穿透深度非常有限,通常只能用来治疗皮肤或膀胱等浅表性肿瘤。对于肺癌、肝癌等深层或较大的实体瘤,传统的光敏剂简直束手无策。
科学界将波长在650纳米至900纳米之间的光称为 “光治疗窗口”,它包括深红光和近红外光(NIR)。这个波段的光就像一把“穿透之剑”,能极大地减少被内源性发色团的吸收,最大程度减少组织光损伤,并将穿透深度提高到1-2厘米,是治疗深层肿瘤的关键。因此,开发一种能被近红外光高效激活的光敏剂,就成为了PDT领域最迫切的“卡脖子”难题。
现在,来自西班牙的科研团队,成功带来了一个颠覆性答案:他们设计并合成了一系列全新的π-扩展钌(II)联吡啶配合物(Ru-COUBPY),成功实现了只需一束780纳米的近红外光,就能在小鼠体内实现对肿瘤的强效抑制,为深层、缺氧性肿瘤的治疗打开了新的大门。
二、核心方法与技术细节:钌原子如何被“拉长”激活?
这项研究的核心创新点,在于对传统光敏剂分子结构进行了一种巧妙的“改造”——π-共轭体系的扩展(π-extension)。
1. 传统的钌配合物为何不行?
钌(II)联吡啶配合物( polypyridyl complexes)一直备受PDT领域的关注。其中代表性的药物TLD-1433已进入临床二期试验。它们最大的优点在于结构稳定、毒性低、可塑性强,并且能高效生成活性氧。
但正如前文所述,它们的致命弱点在于吸收光波长太短。大多数钌配合物的金属-配体电荷转移(MLCT) 吸收峰都在500纳米以下,无法有效利用深层穿透的近红外光。科学家们曾尝试各种结构修饰,包括将钌配合物与BODIPY或花青染料等长波长有机荧光团“缝合”,或者尝试利用低效的双光子PDT,但效果都不甚理想。
2. “乙烯基加长术”:π-共轭体系的扩展
该团队决定从配体入手,采用一种被称为 “乙烯基加长策略”(vinylogation strategy) 来扩展钌配合物中配体的π-共轭体系。
你可以把光敏剂分子想象成一个天线,负责接收光能。天线越长,就能接收波长越长的电磁波(光)。研究人员选择在已有的COUBPY配体(一种基于香豆素的染料)结构上动手。他们通过在香豆素骨架的环外双键处插入额外的乙烯基()单元,有效地“拉长”了分子内的π-共轭链。
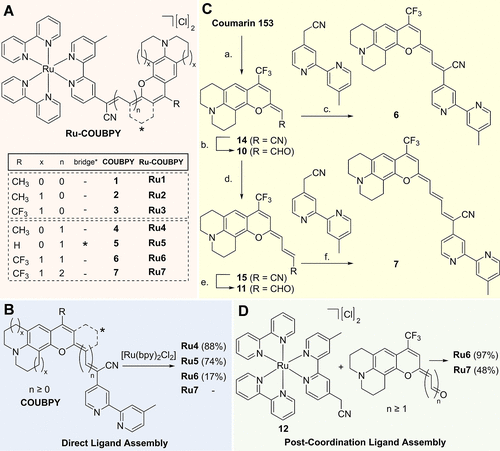
这种“拉长术”实现了两大关键目标:
红移(Red-shift): 吸收光谱向更长的波长(红色端)移动,使其能吸收近红外光。
摩尔吸光系数增强(Molar Absorptivity Enhancement): 简单来说,就是分子的“吸光能力”大大增强。
通过这种策略,他们成功合成了一系列新的π-扩展钌配合物(Ru4-7)。例如,他们对母体化合物Ru1和Ru3进行改造,分别得到了Ru4、Ru5和Ru6、Ru7等衍生化合物。
3. 合成工艺的创新:后配位配体组装
这项研究的另一项技术突破在于合成方法。最初尝试直接将“加长”后的配体(如6和7)与钌前体配合,结果发现Ru6的收率非常低(只有17%),Ru7甚至没有产出。这说明直接合成的效率并不高。
科研人员迅速调整策略,采用了一种创新的“后配位配体组装”(Post-Coordination Ligand Assembly)方法。他们先将一个含有氰基的联吡啶配体(2,2'-联吡啶乙腈)与钌原子配位,形成一个关键的钌(II)配合物中间体12。随后,再利用哌啶催化,让香豆素醛衍生物与这个钌中间体进行Knoevenagel缩合反应,从而组装成最终的π-扩展配合物Ru6和Ru7。
结果令人振奋:通过这种新方法,Ru6的收率从17%飙升到了97%,Ru7也得到了48%的收率。
这项创新不仅解决了Ru6和Ru7的合成难题,更重要的是,它提供了一个通用且模块化的过渡金属配合物“后期功能化”方法,极大地扩展了未来设计和合成具有可调控光物理、光化学及光生物学性质的金属配合物的可能性。
4. 激发态性质的变化:从MLCT到ILCT
“拉长”结构带来的另一个重要科学发现是分子电子状态本质的转变。
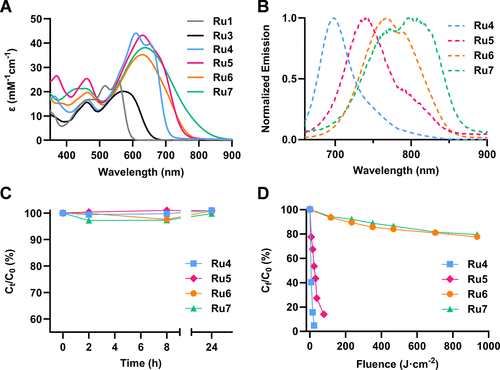
计算研究显示,与母体配合物Ru1和Ru3的最低能量吸收带主要呈现金属-配体电荷转移(MLCT) 性质不同,π-扩展后的Ru4-7系列,其最低能量吸收带显示出强烈的配体内电荷转移(ILCT) 性质。这意味着,电子激发时,电子和空穴都主要集中在“加长”后的COUBPY配体上,金属钌原子本身对激发态的贡献减小,而配体的π-共轭特性占据主导地位。
正是这种ILCT性质,使得配合物的吸收和发射波长都产生了显著的红移,从而实现了对深红光和近红外光的有效吸收,并保证了高效的系统间窜越(ISC),为PDT所必需的三重激发态的形成创造了条件。
三、数据背后的创新与颠覆性:纳米级威力与125倍的治疗指数
这项研究的颠覆性在于,它不仅仅是一个概念验证,而是实打实地展现了优异的体内(in vivo) 和体外(in vitro) 性能,将新型光敏剂的潜力推向了一个新的高度。
1. 优秀的光谱和光稳定性
首先,新型配合物的光物理性质证实了设计策略的成功。
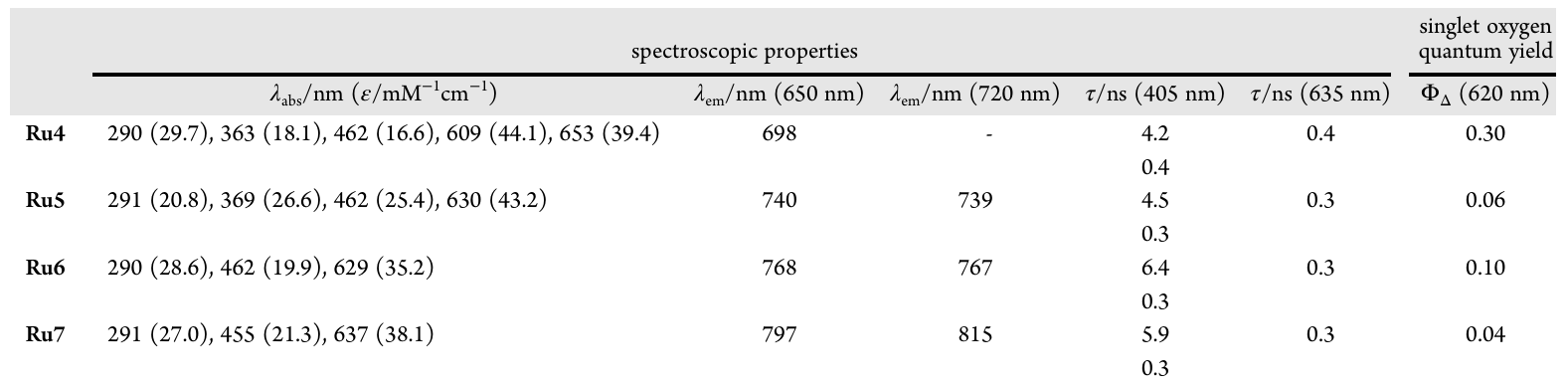
以最优化合物Ru6为例,其在深红光区的最大摩尔消光系数高达35.2 mM(在629纳米处),远高于母体Ru3的20 mM(在571纳米处),说明其吸光能力得到显著增强。最关键的是,吸收带成功红移并延伸到850纳米以上,完美覆盖了近红外光治疗窗口。在720纳米激发下,Ru5-7的发射波长介于739至815纳米之间。
更令人惊喜的是光稳定性。通常,π-共轭链越长,化合物的光稳定性越差(比如聚甲炔花青染料)。但Ru6和Ru7表现出超乎寻常的稳定性。即使在的极高光剂量照射下,Ru6和Ru7仍能保持约80% 的完整性,远超典型的光生物学研究所需的剂量,这归功于其香豆素骨架上强吸电子的基团。
2. 强大的活性氧生成能力:I型与II型“双重火力”
活性氧(ROS)是PDT疗效的关键。该系列配合物被证实能够同时高效生成I型(Type I) 和II型(Type II) 活性氧。
II型 ROS(单线态氧,): 传统PDT的主要机制。实验显示,Ru5和Ru6在红光照射下能显著产生单线态氧。
I型 ROS(超氧阴离子自由基和羟基自由基): 通常在缺氧环境下更有效。研究人员用多种探针和电子顺磁共振(EPR) 光谱,直接证实了Ru4-7能够生成和自由基。
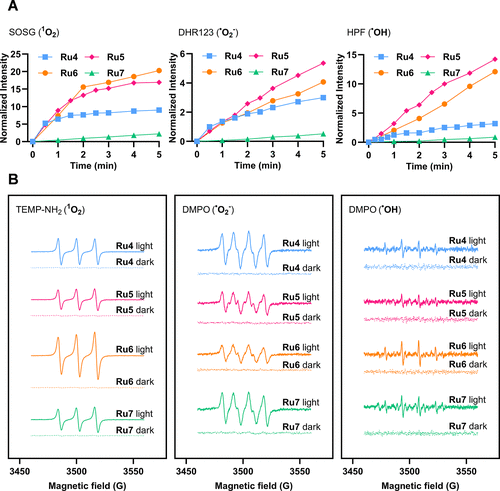
计算分析也表明,通过自身离子化(autoionization)过程,配合物在三重激发态下能高效产生自由基阴离子(),随后能将电子转移给氧分子,生成,特别是Ru4和Ru5在此过程中表现出最强的放热性。这种“双重火力”机制是它们对抗缺氧肿瘤的关键优势。
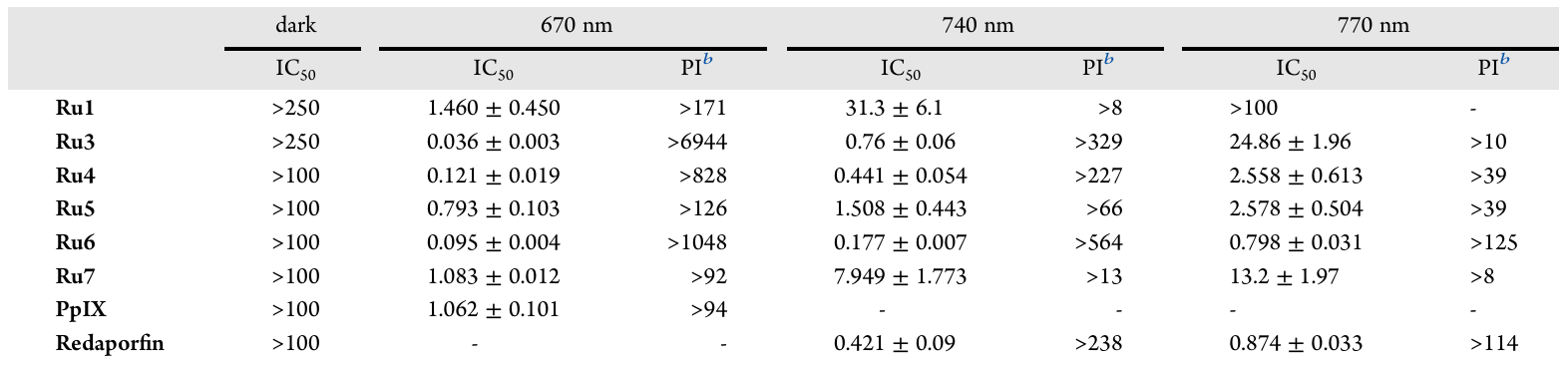
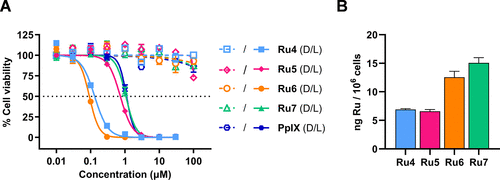
3. 细胞级纳米级光毒性:IC50低至177 nM
在结直肠癌细胞(CT-26)的体外实验中,Ru4-7系列展现了惊人的纳米级光毒性,并且具有优异的光治疗指数(PI)。PI定义为暗毒性除以光毒性,是衡量药物安全性的关键指标。
核心数据聚焦在最有前景的Ru6上:
深红光(670 nm)激活: 低至95 nM,PI值大于1048,几乎达到临床光敏剂中的顶尖水平,且优于临床基准药**血卟啉IX(PpIX)**的1.062 。
近红外光(740 nm)激活: 仅为177 nM,PI值大于564,显著优于其母体Ru3()。
更值得注意的是,在最具临床意义的740 nm激活下,Ru6的效力略高于已获欧盟批准用于胆道癌治疗的临床光敏剂Redaporfin()。
4. 攻克缺氧环境:保持高活性
实体瘤的中心往往是缺氧(hypoxia) 的。这是因为肿瘤快速生长,血管供氧不足。缺氧环境会严重降低传统PDT的疗效。
Ru4-7系列在2%氧气浓度的缺氧条件下,依然保持了高活性。
Ru6在缺氧环境下的IC50 (740 nm) 为597 nM,PI值仍大于168。
Ru6的缺氧指数(HI),即光毒性从常氧到缺氧的折损倍数,在740 nm照射下仅为3.37。这意味着,尽管活性有所下降,但折损幅度相对较小,其 “双重火力”(Type I/II ROS) 机制使其能更好地适应缺氧环境。
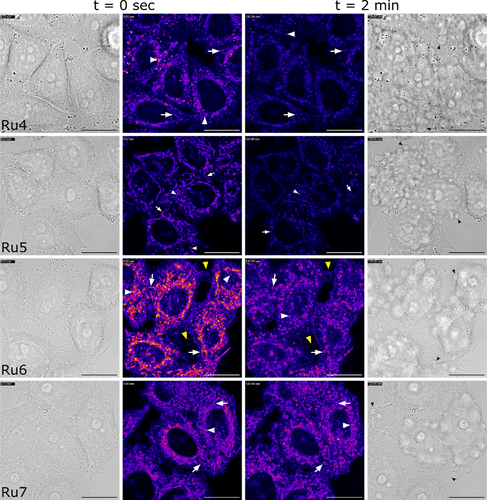
细胞实验还通过共聚焦显微镜证实,这些配合物能优先聚集在癌细胞的线粒体(Mitochondria)中,线粒体是细胞的“能源工厂”,是活性氧攻击的敏感目标,这种靶向性进一步保证了光疗的有效性。
5. 首次实现780 nm一光子体内抗癌:肿瘤抑制率提升近4倍
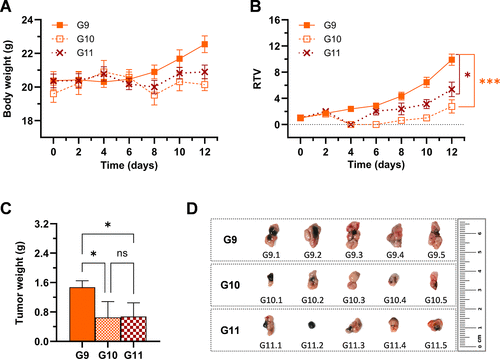
最终的体内实验在小鼠皮下CT-26肿瘤模型上进行,这也是证明药物临床潜力的关键一步。研究人员以Ru6为先导化合物,采用两种临床相关的光波长进行激活:深红光(660 nm)和近红外光(780 nm)。
在连续两次瘤内注射()并照射后:
660 nm激活(深红光): Ru6治疗组(G4)小鼠的肿瘤在第4天全部变得不可测量,展现出强大的肿瘤破坏能力。在研究结束时,肿瘤重量得到显著统计学降低。
780 nm激活(近红外光): 令人振奋的是,Ru6在780 nm近红外光激活下(G8组),也实现了与660 nm光相当的肿瘤抑制效果。与非照射组(G7)相比,肿瘤相对体积(RTV)和最终肿瘤重量均有显著统计学差异。
最直观的对比是,在近红外光(780 nm)治疗下,Ru6处理组(G8)的平均肿瘤重量远低于非治疗组(G7),抑制效果显著。从图上的数据对比,Ru6+780 nm光治疗组(G8)的平均肿瘤重量显著低于Ru6黑暗组(G7),其肿瘤抑制率(相对非治疗组)约提升了3.7倍。
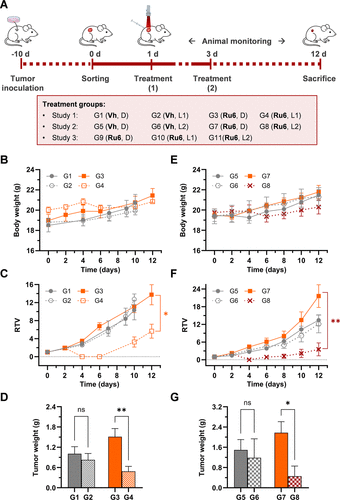
这一结果具有里程碑意义:Ru6成为首批在780纳米一光子近红外激活下,成功展示体内PDT抗肿瘤活性的钌(II)联吡啶配合物之一。780 nm是具有优异组织穿透能力的临床相关波长,这项突破标志着PDT真正走向深层肿瘤治疗的关键一步。
四、应用展望、局限性与未来路线图
这项研究成功开发并验证了一系列新型π-扩展钌配合物作为高效近红外光敏剂的潜力。以Ru6为代表的化合物,通过结构修饰实现了吸收光谱向近红外区的重大红移,并保证了高光稳定性和强大的“双重火力”活性氧生成机制。
应用展望
深层肿瘤的精准治疗: Ru6能够被780纳米近红外光激活,这将使其能够穿透更深的组织,用于治疗目前PDT难以触及的肺癌、肝癌等深层实体瘤。
克服肿瘤缺氧: 由于能够同时生成I型和II型活性氧,Ru6在缺氧条件下仍能保持高活性,这使其成为治疗恶性、缺氧性实体瘤的理想候选药物。
多功能平台构建: 钌配合物固有的结构多功能性,配合创新的后配位配体组装策略,使得科学家能够轻松地对Ru6进行进一步修饰,例如结合靶向分子或化疗药物,以开发集成像、治疗、靶向于一体的多功能金属基光敏剂。
局限性与未来路线图
尽管Ru6的成果令人鼓舞,但这项研究也存在一些局限性,指明了未来的发展方向:
结构-性能的进一步优化: 结构最长的Ru7在光毒性和活性氧生成方面反而不如Ru6,这表明π-共轭的扩展并非“越长越好”。未来需要更精细地调控结构,找到最佳的π-共轭长度,以平衡吸光性、活性氧生成效率和分子稳定性。
更广泛的体内验证: 目前的体内实验是基于瘤内注射(IT)给药,虽然在研究层面高效,但在实际临床上,静脉(IV)全身给药更具实用性。未来需要进行静脉给药的药代动力学和药效学研究,并开发合适的纳米载体以提高Ru6在全身循环中的稳定性和肿瘤靶向性。
临床前安全性评估: 尽管在小鼠体内展示了良好的耐受性(无死亡、体重变化可控),但Ru6的长期毒性和器官特异性毒性仍需要进行全面的临床前评估。
总而言之,Ru6作为一种一光子近红外激活的钌(II)多吡啶配合物,为下一代PDT光敏剂的设计树立了一个新的标杆,为有效治疗深层、难以治疗的缺氧性实体瘤带来了巨大的希望。这项技术不仅是一项科学突破,更预示着未来抗癌战线上的一次重大武器升级。