💊 【JACS】癌症治疗重磅突破!光敏剂效率暴增至72.1%,逆转**85%**肿瘤的药物抵抗,如何用“光”唤醒免疫战士?
✨文章标题:Responsive Photosensitizer Precursors Reverse Drug-Induced Secondary Immunosuppression ✉️作者: Lin Yuan* 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c15227
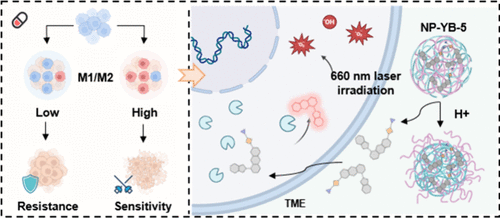
💥 从“痛点”到“突破”:化疗的隐形敌人与免疫的沉睡卫士
癌症的化疗,是人类与病魔抗争的一线武器,每年挽救了无数生命。然而,这把双刃剑在杀死癌细胞的同时,往往也会带来一个更隐蔽、更棘手的副作用——继发性免疫抑制(Secondary Immunosuppression)。
简单来说,当化疗药物(例如常用的5-氟尿嘧啶,5-Fu)进入肿瘤微环境(TME),它们不仅攻击癌细胞,还会悄悄地将免疫系统的“主力军”——巨噬细胞(Macrophages)——从“杀手”M1型转化为“帮凶”M2型。M2型巨噬细胞会分泌大量免疫抑制因子,反而保护癌细胞,导致肿瘤微环境(TIME)恶化,让癌症产生药物抵抗,治疗最终失败。
面对这个巨大的临床挑战,科学家们迫切需要一种方法,能够特异性地、高效地将这些“变节”的M2巨噬细胞重新编程回“抗癌战士”M1型。而光敏剂介导的光动力免疫疗法(Photoimmunotherapy)被认为是极具潜力的下一代解决方案。
然而,现有光敏剂的疗效受到两大瓶颈的限制:一是缺乏对M2巨噬细胞的特异性;二是光敏效率不够理想,无法高效地完成“拨乱反正”的免疫任务。
现在,由林远课题组等带来的这项重磅研究,通过 "临近驱动”策略(Proximity-Driven Strategy)和纳米工程技术,成功开发出了一种名为NP-YB-5的新型响应性光敏剂前体。它在体外实验中表现出惊人的**72.1%巨噬细胞极化效率,并在动物模型中实现了85%的统计学治愈率,以及100%**的无复发生存率,这项成就无疑是癌症治疗领域的一次颠覆性突破。
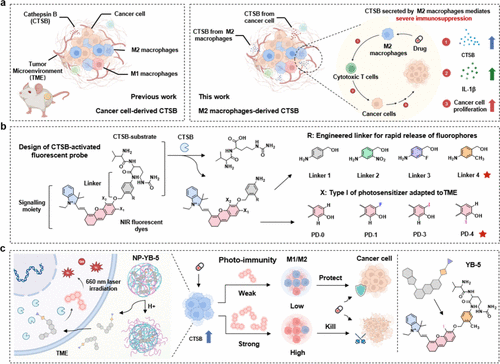
🛠️ 核心方法与技术细节解密:纳米载体的“靶向导航”与光敏剂的“超频加速”
NP-YB-5是如何实现“反败为胜”的?这背后凝结了一套精妙的 "三步走” 分子与纳米工程策略。
1. 找准“叛徒”的暗号:以Cathepsin B(CTSB)为靶标
要重新编程M2巨噬细胞,首先要知道它们的“秘密联络官”是谁。研究发现,在肿瘤微环境中,特别是当M2巨噬细胞暴露于化疗药物(如5-Fu)时,它们会大量分泌一种溶酶体半胱氨酸蛋白酶——组织蛋白酶B(CTSB)。
更关键的是,这种由巨噬细胞分泌的CTSB,与癌细胞分泌的CTSB不同,它被认为是药物抵抗和继发性免疫抑制的关键诱导者。因此,CTSB就成了研究人员锁定M2巨噬细胞、打破免疫抑制的关键靶标。
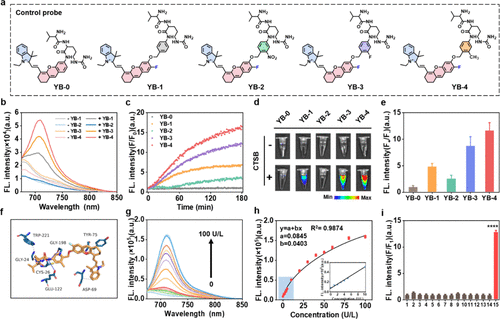
2. 优化“钥匙”与“锁”:近邻驱动的连接子工程
传统的CTSB响应型探针或光敏剂前体(PPs)往往激活效率低下。想象一下,CTSB就像一把“锁”,而光敏剂前体(PP)是等待被释放的“药物”,它们之间需要一个 "连接子”(Linker) 来桥接。然而,传统的连接子设计让“钥匙”和“锁孔”的相对位置不佳,导致切割反应缓慢,释放效率低。
这项研究的精妙之处在于采用了 "临近驱动”(Proximity-Driven)策略和连接子工程来解决这一问题。
"临近驱动”:研究团队系统性地优化了连接子(基于对氨基苄醇,p-aminobenzyl alcohol)的结构,引入了不同取代基(如甲基,Me)来 "调校”光敏剂前体(PPs)与CTSB活性中心之间的距离。
"超频加速”:通过结构优化,他们发现引入甲基取代基的连接子(例如,在YB-4和最终的PP:YB-5中)能锐化光敏剂前体与CTSB活性中心的距离,极大地增强了二者的亲和力,从而实现了超快、高效的激活和光敏剂释放。实验数据显示,经过甲基化修饰的探针YB-4表现出最快的荧光恢复速率和最高的活性中心亲和力。
3. 纳米载体:包裹“弹头”与实现“精准打击”
高活性的光敏剂前体YB-5虽然高效,但直接使用会因水溶性差、循环时间短而无法有效富集在肿瘤部位,并可能造成非特异性激活。
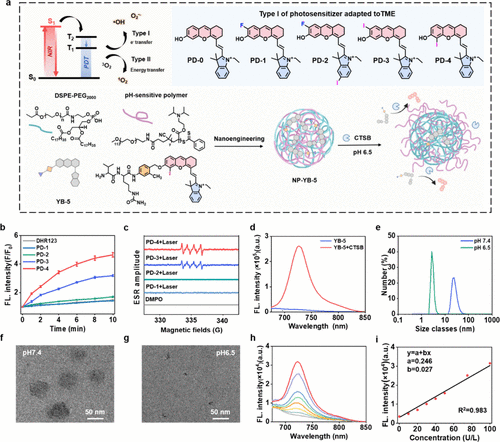
为解决这一问题,研究人员采用了纳米工程技术,将YB-5封装进了一个由DSPE-PEG2000和pH敏感聚合物构成的水溶性纳米颗粒中,形成了最终的纳米平台NP-YB-5。
这个纳米载体是“双重保险”:
长效巡航:DSPE-PEG2000赋予了NP-YB-5亲水性骨架,使其在血液循环中保持稳定(pH 7.4),避免非特异性激活。
环境触发:pH敏感聚合物使其能够在微酸性肿瘤微环境(TME,pH 6.5)中特异性地解聚,释放出YB-,确保药物在肿瘤部位的富集和选择性激活。
当NP-YB-5被M2巨噬细胞摄取后,在CTSB的“剪刀”作用下,高效释放出PD-4型光敏剂(一种I型光敏剂,擅长产生超氧自由基,这正是重编程M2为M1的关键力量)。随后,通过660 nm近红外激光照射,PD-4释放大量的活性氧物质(ROS),从而启动巨噬细胞从M2到M1的重编程,一举逆转免疫抑制。
🔬 数据背后的创新与颠覆性分析:**72.1%效率与85%**的治愈率奇迹
这项研究的真正颠覆性在于其令人振奋的疗效数据,它们不仅证明了技术的可行性,更超越了现有的大多数疗法。
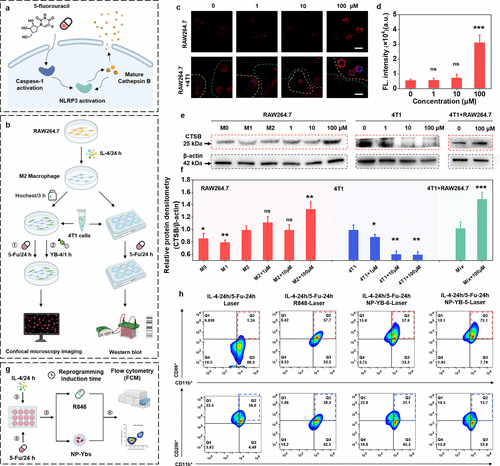
1. 巨噬细胞重编程效率:72.1%的里程碑
在最关键的体外细胞实验中,研究团队将NP-YB-5与目前常用的免疫佐剂R848和性能较差的对照PP(NP-YB-6)进行了对比。
传统免疫佐剂R848:诱导M1表型的比例约为57.7% 。
对照纳米探针NP-YB-6:诱导M1表型的比例约为57.9% 。
创新纳米探针NP-YB-5:诱导M1表型的比例高达72.1% 。
NP-YB-5将M1表型比例提升至72.1%,显著高于传统免疫佐剂和早期代响应性前体(均低于60%),这直接归功于其加速的释放速率和优异的I型光敏性能。这种效率的巨大飞跃,意味着在实际治疗中,NP-YB-5能够更迅速、更彻底地扭转肿瘤免疫微环境(TIME)。
2. 逆转耐药性:CTSB与P-gp的高度相关性
为了证明“免疫抑制”和“药物抵抗”之间的关联,研究人员构建了荷瘤小鼠模型,并给予不同周期的化疗(5-Fu)。他们发现,随着化疗周期的延长,肿瘤生长速度加快,肿瘤对药物的敏感性降低(耐药性增强)。
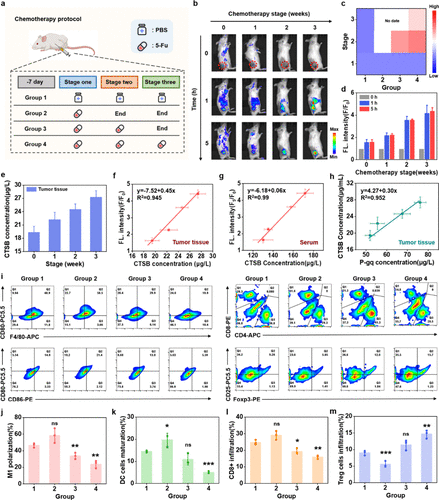
关键发现是:肿瘤组织内的CTSB水平与耐药性指标P-gp水平呈高度线性正相关()。这意味着,CTSB的表达量可以作为衡量肿瘤耐药性的一个指标。同时,化疗时间越长,肿瘤内M1巨噬细胞比例越低, Treg细胞(免疫抑制细胞)比例越高,进一步证实了继发性免疫抑制的恶化。
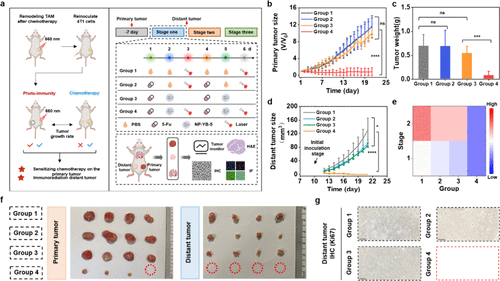
3. 组合疗效:85%的统计学治愈率和全身免疫激活
在最激动人心的多周期联合治疗实验中,研究团队将NP-YB-5光免疫干预与5-Fu化疗多次循环组合。他们将这种组合疗法与其他免疫干预策略(如巨噬细胞清除剂氯磷酸脂质体CL、免疫佐剂R848)进行了对比。
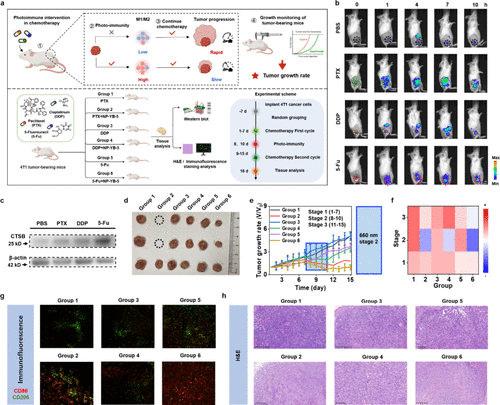
结果显示,5-Fu + NP-YB-5(光免疫重编程)组的小鼠:
原发肿瘤几乎完全消失。
实现了约85%的统计学治愈率。
治愈小鼠在治疗结束后60天内,无肿瘤复发或转移。
所有转移迹象(肺部、肝脏)完全消失。
更令人惊喜的是,研究人员发现,仅对原发肿瘤进行局部光照激活NP-YB-,就能同时抑制远端(转移)肿瘤的生长和定植。远端肿瘤的生长曲线显著低于所有其他对照组。
这表明,NP-YB-5介导的局部光疗触发了全身性的抗肿瘤免疫激活,这种效应足以阻止远处微转移灶的定植和发展,有力地证明了该策略在治疗恶性转移癌方面的巨大潜力。
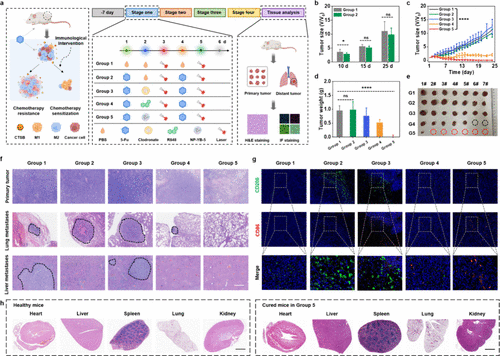
🚀 应用展望、局限性与未来路线图
NP-YB-5的成功不仅是光动力免疫疗法领域的一大步,更为癌症治疗提供了一个全新的 "免疫-化疗增敏” 范式。
应用前景:
化疗增效剂: NP-YB-5可以作为一种普适性的化疗增效剂,与现有的多种一线化疗药物(如PTX、DDP、5-Fu)联用,缓解其导致的继发性免疫抑制和耐药性。
转移瘤和复发预防: 通过局部干预实现全身免疫激活,使其在抑制远处转移和预防术后复发方面具有独特的临床价值。
非侵入式诊断辅助: 作为一种CTSB定量探针,NP-YB-4与肿瘤耐药性指标P-gp高度相关,未来有望用于实时监测肿瘤的耐药性状态,指导临床用药。
存在的局限性:
尽管效果惊人,但这项研究仍处于实验室阶段,存在一些局限性需要克服。
纳米载体的体内稳定性: 尽管NP-YB-5在体外表现稳定,但其在复杂的体内环境下,尤其是长期多周期治疗中,其长期的生物分布、代谢和潜在毒性仍需更深入的评估。
广谱化疗药物适用性: 实验数据显示,NP-YB-5对DDP(顺铂)的耐药逆转效果不如PTX(紫杉醇)和5-Fu,这表明不同化疗药物的复杂作用机制可能限制了巨噬细胞介导的免疫干预效果。未来需要针对不同药物的特性,设计更具针对性的免疫干预方案。
未来路线图:
未来的研究将集中于:
临床前放大与安全性评估: 在更大动物模型中验证NP-YB-5的长期安全性、药代动力学和疗效,并推动其向临床转化。
智能化升级: 探索将NP-YB-5与其他免疫疗法(如检查点抑制剂)结合,以实现更强大的协同抗癌效果。
可穿戴光照设备: 结合可穿戴的近红外光照技术,实现更便捷、更精确、更安全的肿瘤部位光照激活。
这项突破性的工作,不仅提供了一种高效率、高选择性的分子工具来调控肿瘤微环境中的关键免疫细胞——巨噬细胞,更点亮了通过“光”的力量来逆转药物抵抗、实现癌症长期控制乃至治愈的希望之光。我们有理由相信,在不远的未来,这项技术将为饱受癌症困扰的患者带来全新的治疗选择。