🤯 【JACS】颠覆性突破!活细胞成像灵敏度暴增240倍,中国科学家如何“点亮”阿尔茨海默病关键靶点ALDH2?
✨文章标题:Precision Design of Fluorogenic Probes via Orthogonal Tuning of Binding and Photophysics for Isoform-Selective ALDH2 Imaging ✉️作者: Xiaogang Liu* Xin Li* 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c13638
🔬 从“痛点”到“突破”:为什么我们需要一双“超级眼睛”?
想象一下,你正在尝试用一盏昏暗的手电筒,去观察一场在高速运转的微型工厂内部发生的,极其微小的“生化反应”——这就是当前生物医学研究,特别是针对特定酶类活性成像时所面临的巨大挑战 。
我们今天的主角,醛脱氢酶2(ALDH2),就是这样一位“难搞”的家伙 。作为线粒体中的“解毒卫士” ,ALDH2负责清除体内产生的各种有害醛类物质,维持细胞的氧化还原平衡 。它的功能障碍,与心血管疾病、神经退行性疾病,特别是阿尔茨海默病等多种病理过程紧密相关 。
然而,要实时、准确地“看见”ALDH2在活细胞甚至活体脑组织中的活性,简直难如登天 。原因有二:
“挑食”的基质: ALDH2的活性位点只能容纳极小的醛类物质,这意味着你不能随便挂一个大块头的“荧光灯”上去,否则酶就不认得了,活性会丧失 。
微弱的信号: ALDH2催化的反应,只是将醛基(-CHO)氧化成羧酸(),这个结构变化太小,传统方法激发的荧光信号“开/关”变化非常微弱,不足以在复杂的生物背景中被可靠检测 。
简而言之,以往的荧光探针要么是非选择性(把ALDH家族其他成员也一起“点亮”了),要么是信号太弱(荧光增强倍数仅有约20倍),根本无法在复杂血液或组织样本中可靠应用 。
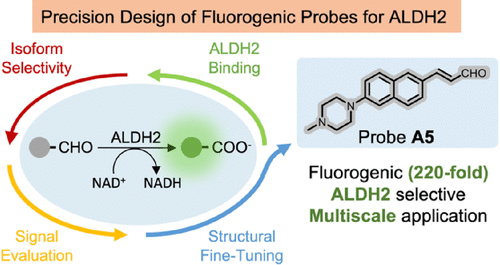
面对这种“选择性”与“灵敏度”相互掣肘的 “核心困境” ,这篇发表在《美国化学会志》(JACS)上的重磅研究,提出了一种颠覆性的解决方案——“正交设计框架”(Orthogonal Design Framework) 。这不仅开发出了性能卓越的ALDH2探针A,更重要的是,它建立了一套通用、模块化的策略,为所有“难搞”的酶靶标成像,开启了全新的时代 。
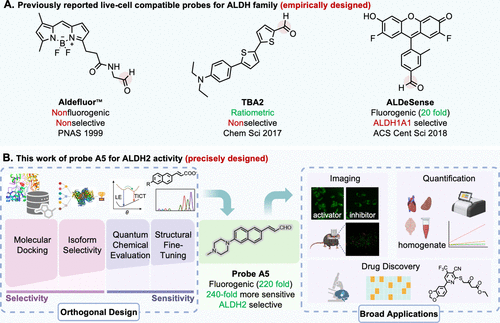
🛠️ 核心方法与技术细节解密:拆解“正交设计”的三步棋
这个“正交设计框架”的核心思想,是将传统探针设计中不得不面对的 “选择性” 和 “灵敏度” 的矛盾,彻底解耦,进行独立优化 。
研究团队走了巧妙的 “三步棋”:
1. 第一步:分子对接(Docking)——实现“精准选择”的钥匙
目标: 解决选择性问题,确保探针只被ALDH2识别,而对其他ALDH家族成员“视而不见” 。
技术拆解:
研究人员首先构建了一个庞大的虚拟醛-荧光团缀合物数据库 。他们采用分子对接技术,就像是把数以百计的钥匙(探针候选分子)扔进一把锁(ALDH2的活性位点)里,并用优化过的评分函数来评估哪把钥匙插得最合适、最稳固 。
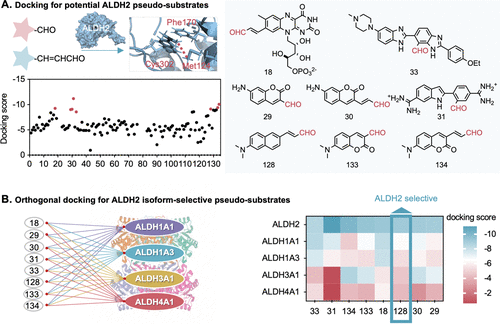
关键在于 “正交交叉筛选” :他们不仅筛选出与ALDH2亲和力高的化合物(如化合物128) ,还会将其与ALDH1A1、ALDH3A1等其他相关的醛脱氢酶亚型进行交叉对接 。那些与多个亚型都“亲近”的化合物会被立刻放弃 。
最终,他们锁定了一个有前景的骨架——化合物128 。通过这种方法,探针在设计之初就获得了极高的亚型选择性,解决了传统经验设计无法避免的“广泛非特异性”问题 。
2. 第二步:量子化学计算(Quantum Chemical Modeling)——预测“荧光开关”的潜力
目标: 解决灵敏度问题,预测探针发生反应前后,荧光信号能增强多少倍 。
核心机制:“扭曲分子内电荷转移”(TICT)
要实现巨大的荧光增强,就需要设计一个“完美”的荧光开关。研究团队将目光投向了TICT机制 。
TICT机制通俗解读:
想象一个“荧光灯泡”由两部分组成:给电子体(Donor) 和吸电子体(Acceptor) 。
在激发态下,给电子体想把电子推向吸电子体,产生电荷分离 。
如果吸电子体(比如未反应的醛基-CHO)的吸电子能力很强,这种电荷转移会变得非常强烈,导致分子的两个部分发生扭曲(Twisted),接近垂直 。
这个扭曲的构象被称为TICT态,它是一个非辐射淬灭通道,直白地说,就是 “荧光灯”自己把自己拧断了,导致荧光几乎为零 。
研究人员利用量子化学计算,模拟了候选探针在ALDH2催化反应前(-CHO) 和后() 的电荷状态变化和分子扭曲趋势 。他们发现,醛基(-CHO)的电子亲和性(吸电子能力)远大于反应后的羧酸根() 。
这个发现是关键:-CHO基团让探针处于“荧光灯被拧断”的TICT态(非发光) ,而 基团(产物)吸电子能力减弱,TICT被抑制,分子倾向于平面发光构象(高发光) 。
这种“扭曲”到“平面”的巨大变化,完美预测了探针的 “开/关”能力,锁定了化合物128等少数几个具有高荧光增益潜力的结构 。
3. 第三步:结构微调(Structural Fine-Tuning)——达到“最佳平衡点”
目标: 在确定骨架和机制后,通过微调探针的非核心部分(给电子体D端),达到最高的催化效率和最好的荧光亮度的平衡 。
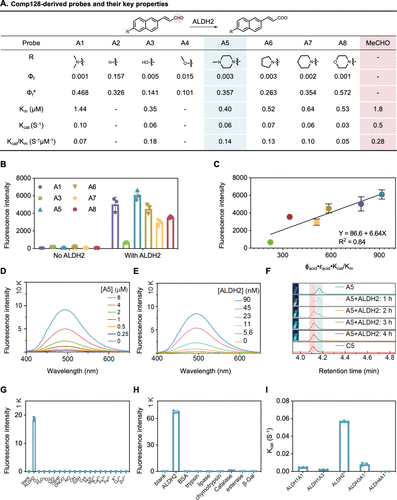
研究人员在化合物128的基础上,系统地修改了给电子体(D)部分,合成了A1-A8等一系列探针 。他们发现,不同的修饰会影响探针的催化效率() 和反应后产物的荧光量子产率() 。
最终,带有特定哌啶环的探针A5脱颖而出 。虽然探针A5的荧光团部分不如其他探针的给电子能力强,但其催化效率() 却是最高的,达到了,几乎是最初选择的A1探针的两倍 () 。
这表明,A5找到了一个 “黄金平衡点”:它在最大限度保证酶能高效工作的同时,依然维持了足够高的荧光增益。研究团队总结出一个通用公式:探针灵敏度 酶催化效率 产物荧光亮度 。A5正是根据这个法则优化出的“最优解” 。
📈 数据背后的创新与颠覆性分析:240倍灵敏度意味着什么?
A5探针的实际性能数据,有力地证明了“正交设计”的颠覆性。
1. 240倍的信号震撼:传统 assays 的终结者
最引人注目的数据,是A5与传统的NADH分光光度法(这是检测ALDH活性的经典金标准)的对比 。
| 评估指标 | A5 荧光法 (探针A5) | NADH 分光光度法 | A5 相比 NADH 的提升 |
|---|---|---|---|
| 检测限 (LOD) | () | 低了 2150 倍 | |
| 实用灵敏度 (LOD/) | 提高了约 240 倍 |
传统NADH方法的检测限(LOD)高达 。而A5方法仅为,低了三个数量级以上 。
更具实际意义的是,当考虑到酶的周转率()时,A5的实用灵敏度比NADH法提升了整整240倍 。这意味着A5能够在酶活性极低、样本量极少的情况下,依然给出清晰可靠的信号。这个巨大的灵敏度飞跃,正是通过**“高荧光增益弥补低周转率”**(即TICT机制的强大“荧光开关”)实现的 。
2. “看不见”到“看得清”:在复杂生物样本中的应用
由于传统NADH方法的灵敏度低下,它在检测血液样本中的ALDH2活性时,几乎完全失败,无法产生可测量的信号 。
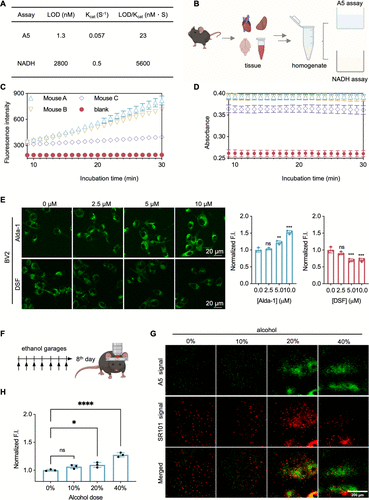
A5探针则成功地在血液、肝脏、大脑和心脏等多种小鼠组织匀浆中,实现了ALDH2活性的定量、动力学测量 。特别是在血样中,A5是唯一能够检测到ALDH2活性的方法 。这不仅验证了A5的生物学可靠性,更凸显了它在临床诊断和药物监测中的巨大潜力 。
3. 跨越尺度:从试管到活体大脑的实时成像
A5探针的成功之处在于它实现了真正的多尺度应用 。
细胞水平: 在小胶质细胞(BV2 cells)中,A5的荧光信号能够清晰地被激活剂Alda-1增强,并被抑制剂DSF(双硫仑)抑制 。这证明A5在活细胞内是特异性报告ALDH2活性的 。
活体大脑成像: 研究人员首次利用A5探针,结合双光子显微镜,实现了活体小鼠大脑皮层中ALDH2活性的细胞分辨率成像 。他们观察到,长期饮酒小鼠的ALDH2活性随着酒精剂量的增加而代偿性上调 。
这一成就打破了传统方法的限制,为在活体上动态、实时地研究ALDH2在神经退行性疾病(如AD)中的功能提供了前所未有的工具 。
4. 助力新药发现:找到治疗阿尔茨海默病的潜在药物
A5的超高灵敏度和活细胞兼容性,使其成为筛选ALDH2激活剂的理想平台 。
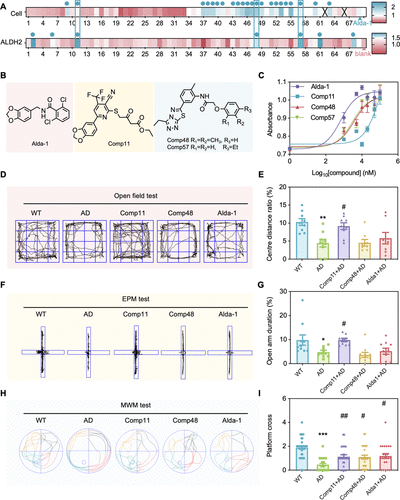
研究团队利用A5进行高通量筛选,成功发现了包括Comp11和Comp48在内的多个新型ALDH2激活剂 。随后,在**APP/PS1阿尔茨海默病小鼠模型(AD model)**中进行的行为学测试证明:
Comp11显著改善了AD小鼠的焦虑行为(开放场和高架十字迷宫测试) 。
Comp11、Comp48和Alda-1都能提高AD小鼠的空间记忆能力(Morris水迷宫测试) 。
AS测定显示,AD小鼠大脑皮层中ALDH2活性降低,而这三种化合物都能有效恢复其活性 。
这些数据表明,A5不仅是一个成像工具,更是一个高效的药物发现平台,为阿尔茨海默病等神经系统疾病的治疗提供了新的候选分子 。
🌍 应用展望、局限性与未来路线图
A5探针及其背后的 “正交设计框架”,绝不仅仅局限于ALDH2这一个酶。这项工作为所有具有 “低周转率、高专一性要求” 的挑战性酶靶标,提供了一个通用的、可复制的设计蓝图 。
应用展望:
药物筛选加速器: 可将该框架应用于其他药理学重要的酶类(如氧化还原酶、蛋白酶),极大地加速高活性、高选择性药物先导化合物的筛选过程 。
疾病诊断生物标志物: 由于A5能在血液等低丰度样本中可靠工作,未来有望开发出基于荧光探针的快速、高灵敏度的ALDH2活性体外诊断(IVD)试剂盒,用于心血管疾病、酒精中毒和神经退行性疾病的早期风险评估和疗效监测 。
体内生化机制解析: 实时、细胞分辨率的活体成像能力,将帮助科学家更深入地理解ALDH2等酶在生理和病理过程中,如炎症、衰老和神经损伤中的动态调控机制 。
局限性与未来路线图:
尽管A5探针性能卓越,但该研究也客观存在一些局限性,指明了未来的研究方向:
周转率的权衡: 尽管A5的灵敏度极高,但为了适应荧光团,其酶促周转数()仍比天然底物(乙醛)低了5-20倍 。未来的工作需要继续优化结构,以最大限度地减少对天然酶活性的干扰。
新激活剂的药代动力学: 发现的Comp11和Comp48虽然在动物模型中表现出行为学疗效,但它们的体内药代动力学(吸收、分布、代谢、排泄)和对关键生化终点(如A负担、炎症标志物)的影响尚未得到充分表征 。这需要进行进一步的详细药理学和机制研究。
拓展至更深层组织: 虽然已实现活体脑皮层成像,但对于ALDH2活性更高的肝脏等深层组织,仍需结合更先进的深层成像技术(如三光子显微镜),以实现更高分辨率的检测。
总而言之,这项工作提供了一个理性、通用、可推广的探针设计新范式 。通过将生物学挑战转化为可独立攻克的工程学问题,该团队成功地将对ALDH2的体外定量,带入了活细胞和活体大脑的动态实时成像时代,为精准化学生物学和新药发现奠定了坚实的基础 。