🤯 【JACS】颠覆性突破!癌症术后复发转移暴降88.6%,生存期延长2.6倍!纳米“核弹”如何终结癌症隐患?
✨文章标题:Constructing 177Lu-Labeled Lanthanide Nano-Radiopharmaceuticals for Efficient Postoperative Tumor Radionuclide Therapy and Prognosis Monitoring ✉️作者: Hao Chen* Yongsheng Liu* Maochun Hong* 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c14832
一、从“痛点”到“突破”:为什么手术后癌症还会卷土重来?
癌症,无疑是人类健康面临的头号公敌,而外科手术至今仍是治疗实体瘤的首要手段 。然而,高达80%以上的癌症患者在接受手术后,仍然面临一个残酷的现实:肿瘤残留、复发和转移 。这就像是拆除一颗定时炸弹,尽管主引信被剪断,但周围可能还散落着微小的、肉眼难见的残骸,随时可能重新引爆。
以胃癌为例,传统的术后辅助化疗(如铂类、氟尿嘧啶类)虽然能将五年生存率从单纯手术的23%提升到36%,但其毒副作用巨大,且很容易产生耐药性 。更要命的是,那些亚毫米级的微小病灶或转移灶,常规的影像学手段(如PET-CT、SPECT、MRI)往往难以准确、实时地监控 。
我们需要的,是一种能够精准定位、彻底清除残留癌细胞,同时还能实时、无辐射监测预后的“超级武器”。这个痛点,正是科学家们致力攻克的“癌症手术后遗症” 。
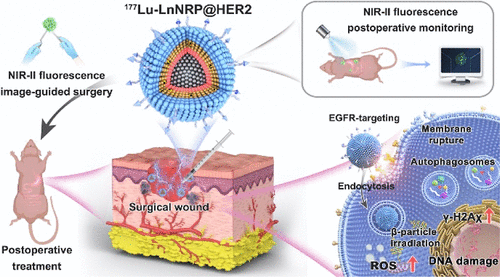
这篇发表在《美国化学会志》(JACS)上的重磅研究,正是带来了这样的革命性解决方案 。研究团队巧妙地设计了一种靶向肿瘤的镥-177()纳米放射药物,代号为 。它不仅能像“精确制导导弹”一样攻击残余癌细胞,还能像“隐形雷达”一样实时追踪复发情况,在胃癌模型中,取得了令人震撼的成果:术后复发抑制率高达84.0%,转移抑制率更是达到88.6%,中位生存期延长了2.6倍 。
这不再是单纯的治疗或单纯的监测,而是一种治疗与诊断同步进行的“诊疗一体化”全新范式 。
二、核心方法与技术细节解密:纳米“洋葱”的五重机关
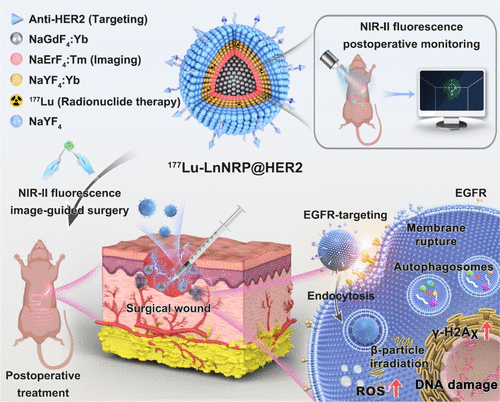
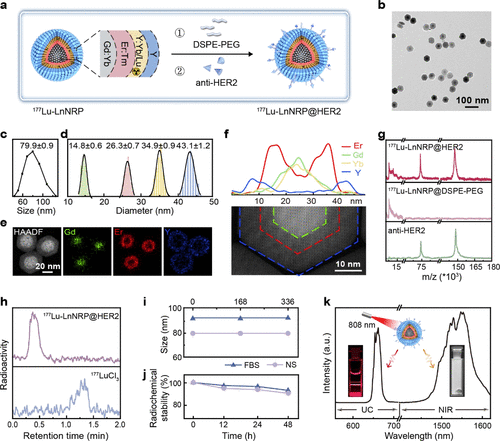
要理解为何如此强大,我们必须剥开它复杂的多层纳米结构。这枚纳米“核弹”是一个直径约79.9纳米的六方晶形小球 ,其核心设计思想是:将治疗和监测功能集成在同一个微小的平台上 。
1. 结构大揭秘:由内而外的“四层洋葱”
想象一下一个由四层不同材料组成的纳米洋葱,每一层都肩负着独特的使命 :
内芯(Core): 钆-镱()层 。钆()元素是核磁共振(MRI)的常用造影剂,但在这里,它与镱()一起构成了整个纳米粒子的能量供能站和骨架 。
第一壳层(Shell 1): 铒-铥()层 。这一层至关重要,它负责成像和监测。其中(铒离子)在被808纳米近红外光激发时,能够发出上转换(UC)荧光和第二近红外(NIR-II)荧光 。这是实现“无辐射、实时监测”的关键 。
第二壳层(Shell 2): 钇-镱/镥-177()层 。这是治疗的核心。放射性核素镥-177()被稳定地集成在这层晶格中 。是一种粒子发射体,它发射出的粒子能量适中,能够进行局部、精准的近距离放射治疗 。
最外层(Shell 3): 钇()钝化层 。这一层就像是给核弹穿上了一件防护服,它的作用是屏蔽内部的能量损失,并保护核心活性成分 。
2. “制导系统”:精准打击HER2靶点
光有核弹结构还不够,如何让它只攻击癌细胞而不伤害健康组织?这就需要“制导系统” 。
科学家在纳米洋葱的最外表面包覆了一层(一种聚合物),并进一步在其上共轭连接了“抗-HER2单克隆抗体” 。HER2(人表皮生长因子受体2)是胃癌等多种恶性肿瘤细胞表面高表达的靶点 。
这个抗体就像是GPS导航系统,赋予了纳米粒子主动靶向能力 。它能主动识别并结合癌细胞表面的受体,促使纳米粒子通过内吞作用(Endocytosis)被癌细胞“吃”进去 。这种主动靶向的效率远高于仅依赖肿瘤血管渗漏的被动靶向(EPR效应) 。
实验数据证实,这种主动靶向的在肿瘤组织的累积量,比仅依赖被动靶向的对照组高出近一倍(仅为,而靶向组达到了) 。
3. “双保险”功能:成像与治疗同步
这种多层设计带来了无与伦比的“双功能”:
治疗(): 一旦纳米粒子被癌细胞内吞,内置的就开始发射粒子,对癌细胞进行“近距离轰炸” [cite: 69, 70, 313][cite_start]。由于粒子在组织内的射程很短,这种“贴近式”的辐照能最大限度地保护周围健康组织 。
监测(): 产生的NIR-II荧光(波长在1000-1700纳米范围)具有组织穿透深、背景信号低的优点 。它能够在术前、术中甚至术后,提供辐射-自由、高分辨率的实时动态监测,精准勾勒出亚毫米级肿瘤边缘,就像是给外科医生装上了一双“透视眼” 。
正是这种“靶向内吞+近距离辐照+NIR-II监测”的完美结合,构成了的核心技术逻辑。
三、数据背后的创新与颠覆性分析:四重打击与生存奇迹
这枚纳米“核弹”的威力,最终要用实验数据说话。研究团队在体外细胞模型和体内胃癌动物模型中进行了严格的对比和验证,其结果无疑是颠覆性的。
1. 威力倍增:体外细胞毒性暴增4倍
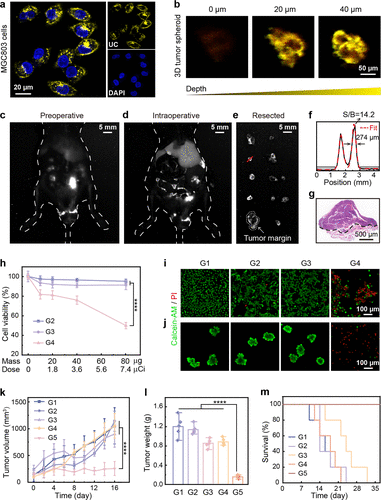
在体外细胞实验中,科研人员对比了等效辐射剂量下,游离的(未封装的放射性物质)与对胃癌细胞(MGC-803)的杀伤效果 。
结果显示,展现出4倍于游离的细胞毒性 。为什么会有如此巨大的差异?
核心在于靶向和内吞 。游离的会很快在体内扩散,甚至在骨组织中大量累积,造成脱靶毒性 。而通过靶向,被癌细胞主动、高效地“吃”进去,并在细胞内长时间滞留。这意味着癌细胞接收到的 粒子的累积有效剂量大幅提升,从而实现了更高的杀伤效率 。
在3D肿瘤球体模型中,以的剂量,彻底抑制了100%的肿瘤球体形成 。这表明它的抗肿瘤效果是多层级、全方位的,远超所有对照组 。
2. “四重奏”杀伤机制:DNA损伤与ROS的协同效应
仅仅“杀伤力强”还不足以说明其颠覆性,更重要的是杀伤机制的创新。科研团队通过高分辨率显微镜和mRNA转录组学分析,揭示了的四重细胞杀伤机制 。
发射的粒子,像是一颗颗微型的子弹,在癌细胞内部进行两大致命打击:
DNA直接损伤(-H2Ax染色证实):粒子直接攻击细胞核,造成DNA双链断裂,导致期细胞周期停滞,抑制DNA修复和细胞增殖,最终诱导细胞死亡 。
活性氧(ROS)暴增:粒子击中线粒体,引发线粒体功能障碍,导致细胞内活性氧(ROS)水平显著升高 。实验显示,处理组的ROS水平高达26.7%,远高于对照组(G1组仅为6.91%) 。
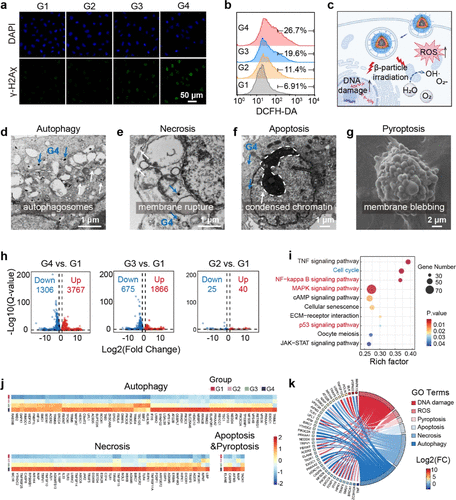
这两种打击是协同作用的 。DNA损伤和ROS升高联手,共同激活了癌细胞的四种程序性细胞死亡通路 :
细胞凋亡(Apoptosis):细胞程序化自杀。
细胞坏死(Necrosis):细胞膜破裂,内容物释放。
细胞自噬(Autophagy):细胞自我吞噬,但在这里被诱导至死亡。
细胞焦亡(Pyroptosis):一种伴随炎症的细胞死亡,特征是细胞膜出泡 。
通过转录组学分析发现,DNA损伤主要触发了自噬和焦亡,而ROS生成主要诱导了坏死和凋亡 。这种多通路、协同式的四重打击,极大地提升了治疗的彻底性和抗药性 。
3. 生存奇迹:术后复发转移抑制率达88.6%
最具临床意义的突破,体现在术后辅助治疗的动物模型上 。研究人员在切除原位胃癌病灶后,沿着手术边缘注射不同药物(模拟术后辅助治疗) 。
在随后的28天监测期内,所有对照组(包括单纯手术、非靶向纳米粒子、游离)的小鼠都出现了广泛的肿瘤复发和转移,并在第28天前全部死亡 。
然而,接受辅助治疗的G5组,展现了惊人的效果:
复发抑制率: 原发肿瘤质量减少了84.0% 。
转移抑制率: 腹腔转移灶数量减少了88.6% 。
中位生存期: 相比于单纯手术组(G1),G5组的中位生存期延长了259%(即延长了约2.6倍),远高于其他所有对照组 。
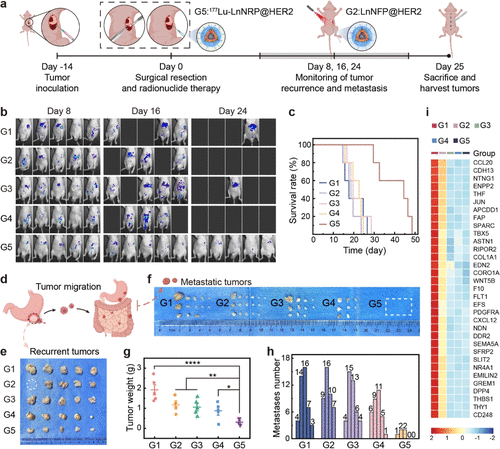
这是对“癌症手术后遗症”的有力回击。在手术清除大部分病灶后,像一支“清道夫部队”,精准清除手术边缘和腹腔中残存的、微小的癌细胞集群,从源头上遏制了复发和转移 。
这种效果是主动靶向带来的压倒性优势,它甚至可以与FDA批准的(用于前列腺癌)相媲美,且用药剂量更低,预示着其巨大的临床转化潜力 。
四、应用展望、局限性与未来路线图:从实验室到临床的“最后一公里”
系统无疑为精准肿瘤学开启了一个全新的篇章,但从实验室走向临床,我们仍需客观地看待其挑战与潜力。
1. 广阔的应用前景:诊疗一体化的先锋
这项技术最直接的应用场景在于实体瘤的术后管理,特别是那些HER2表达量高、容易发生腹腔转移的恶性肿瘤,如胃癌、乳腺癌、卵巢癌等 。
精准手术: 利用其NIR-II荧光成像功能,外科医生可以在术中实时、高分辨率地描绘出肿瘤边界和亚毫米级的微小转移灶 。这能显著提高手术切除的彻底性,降低手术残留的风险 。
根治术后: 作为辅助放疗,它能精准作用于手术切缘,清除残余癌细胞,将复发和转移的风险降至最低 。
长期监测: 术后通过NIR-II荧光成像,可以对患者进行长期、无辐射、动态的预后监测,及时发现并处理早期复发和转移迹象 。
简而言之,它代表着从“经验性干预”向“影像引导下的完全整合式精准治疗”的模式转变 。
2. 必须正视的局限性
尽管数据亮眼,但作为一项前沿的纳米技术,也存在挑战:
生物安全性与体内代谢: 尽管在急性毒性研究中显示出良好的生物相容性(如体重无明显下降、主要器官无病理损伤) ,但这种复杂的稀土纳米材料(镧系元素)在人体内的长期代谢和降解路径仍需深入研究。纳米粒子能否被高效、无害地排出体外,是临床转化的关键瓶颈。
脱靶累积: 实验显示,纳米粒子在肝脏和脾脏等非靶向器官仍有一定累积 。虽然这种累积没有表现出明显的短期毒性,但其在这些器官中的长期放射性影响,需要更长时间和更严格的临床前研究来评估。
临床转化复杂性: 这种多层、多功能纳米粒子的大规模、标准化生产,以及其放射化学稳定性在临床条件下的长期维持,都是需要克服的工程和质控挑战 。
3. 未来路线图
未来的研究方向应聚焦于三个方面:
靶点普适性: 开发针对其他高发肿瘤靶点的纳米放射药物,以扩大诊疗平台的适用肿瘤范围 。
安全性优化: 通过表面修饰或结构调整,进一步降低肝脾等非靶向器官的滞留率,并加速纳米粒子的体内清除 。
联用策略: 探索将这种纳米“核弹”与免疫检查点抑制剂等免疫疗法结合的可能性 。 粒子辐照导致的DNA损伤和细胞死亡,可能产生免疫刺激效应,从而激活全身性抗肿瘤免疫反应,实现的治疗效果 。
总而言之,这项研究提供了一个前所未有的癌症诊疗一体化平台,它以其88.6% 的转移抑制率和2.6倍的中位生存期延长,向我们宣告:清除癌症的隐患,可能不再是遥不可及的梦想。