【JACS】炸裂!斯坦福团队发布RNA“荧光炸弹”,特异性高达970倍,活细胞中实现“无痕”追踪!
✨文章标题:Fluorogenic Covalent Probes for RNA ✉️作者: Eric T. Kool* 等 🔗链接:https://pubs.acs.org/doi/10.1021/jacs.5c14938
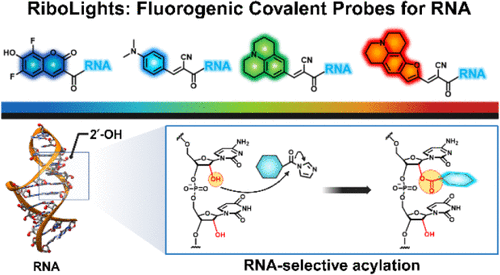
🔬 从“痛点”到“突破”:我们为什么需要更强大的RNA显微镜?
在生命科学领域,如果说DNA是记录家族历史的“典籍”,那么RNA就是负责执行日常任务、传递实时信息的“信使”和“工人”。从指导蛋白质合成到调节基因表达,RNA的角色至关重要且复杂多变。因此,“看清”细胞内所有RNA的动态和分布,成为了我们理解生命活动、解析疾病机制的核心挑战。
然而,要给这些“信使”贴上荧光标签,一直是个老大难的问题。目前主流的RNA染料,通常采用的是非共价结合的方式,想象它们像“静电吸附”或“插卡”一样依附在RNA链上。但问题是,DNA也是带负电的,所以这些染料往往 “色盲” ,无法区分RNA和DNA,甚至会非特异性地结合到细胞内的其他结构上,比如线粒体。这就好比你想要拍摄一群工人在工厂里忙碌的场景,结果整个工厂里所有物体都被染上了颜色,背景噪音巨大,根本分不清谁是谁。
更糟糕的是,这些非共价结合是不稳定的、短暂的,就像蜻蜓点水,如果想在活细胞里清晰、长时间地追踪RNA,就必须进行 “洗涤”步骤来去除多余的背景染料。而洗涤不仅繁琐,还会破坏细胞的天然状态。
有没有一种方法,能够精准锁定RNA独有的特征,像安装了一个高精度的“GPS”和“隐形开关”,只在找到RNA时才发光,而且一旦结合就牢不可破,实现“洗涤自由”的活细胞追踪?
斯坦福大学Eric T. Kool教授团队带来的这项名为 “RiboLights”(RL荧光团)的突破性技术,正是奔着解决这个世纪难题而来的。它放弃了传统染料的非特异性策略,首次利用RNA独特的化学特征,开创了荧光增强共价标记的新时代。
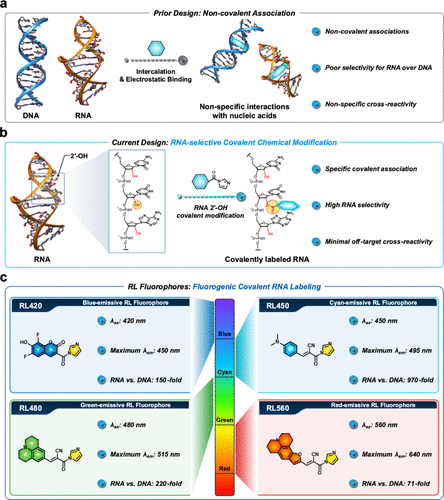
💡 核心方法与技术细节:RNA的“身份证”——2'-羟基
RiboLights(RL)之所以能实现史无前例的特异性,关键在于找到了RNA独有的“化学身份证”——2'-羟基(2'-OH)基团。
我们知道,核酸骨架是由糖、磷酸和碱基构成的。RNA的糖是核糖,它在第2位碳原子上带有一个特殊的羟基(-OH)。而DNA的糖是脱氧核糖,顾名思义,它在相同位置缺少了这个羟基。这个微小的化学差异,就是RL荧光团实现“指纹识别”的基础。
第一步:瞄准高反应性的“化学靶心”
2'-OH基团可不是一个普通的羟基。在水溶液这种温和的条件下,它的反应活性异常高,对亲电试剂表现出独特的亲和力,其酸性()甚至比普通的乙醇还要高得多。RL荧光团正是利用了这种特性,将其设计为带有 “酰基咪唑” 功能团的亲电试剂。
你可以把RL荧光团想象成一个 “高压电工的工具包”,里面装了一个随时准备通电发光的“灯泡”(荧光团主体)和一个超级敏锐的“专用插头”(酰基咪唑)。这个“专用插头”只认RNA上的2'-OH这个“专用插座”,并且一旦接触,就能迅速、高效地形成一个共价酯键,将整个“工具包”永久性地钉在RNA骨架上。而DNA因为没有这个“插座”(2'-OH),所以完全不会被标记。
第二步:独特的“荧光开关”机制
仅仅是共价结合还不够,要实现“无背景”的活细胞成像,染料本身必须是 “荧光沉默”的,只有结合到靶标上才能被“唤醒”发光。RL荧光团巧妙地采用了TICT(Twisted Intramolecular Charge Transfer,扭曲分子内电荷转移) 机制来实现这个“隐形开关”。
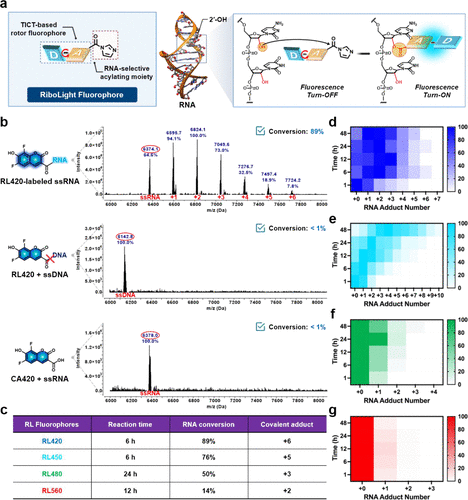
在游离状态下(未反应时),RL荧光团的结构就像一个带有可旋转连接的“分子马达”。当它吸收光能时,内部的键会快速旋转,将光能通过非辐射性去激发的方式(即热能或运动)消耗掉,所以看起来是 “暗的”(Turn-OFF)。
但一旦RL荧光团的“插头”成功插入RNA的2'-OH“插座”并形成共价键,它就被 “锁定” 在了庞大的RNA分子骨架上。这个共价连接,就像给“分子马达”加了一个“物理刹车”,限制了其内部键的旋转。旋转受限,非辐射性消耗能量的途径被切断,吸收的光能就只能通过辐射性去激发 ——也就是发光(Turn-ON)的方式释放出来。
此外,那些在水溶液中没有反应的RL荧光团,会迅速发生水解,变成无活性的、黑暗的羧酸副产物。
总结一下: RL荧光团实现了 “三位一体” 的突破:
化学选择性:通过2'-OH确保只标记RNA。
共价稳定:一旦标记就无法脱落,确保信号稳定。
荧光沉默:游离染料(背景)和水解产物(副产物)都是“黑”的,只有成功结合的RNA才“亮”,从而实现免洗(Wash-free) 的高信噪比成像。
📊 数据背后的创新与颠覆性:970倍的震撼与多色成像自由
RL荧光团的设计思路固然巧妙,但其在实验数据上的表现,才真正称得上“颠覆性”。
前所未有的RNA:DNA选择性——最高970倍增强
文章记录了四种不同发光颜色的RL荧光团(RL420、RL450、RL480、RL560)。其中,RL450的数据堪称惊人。
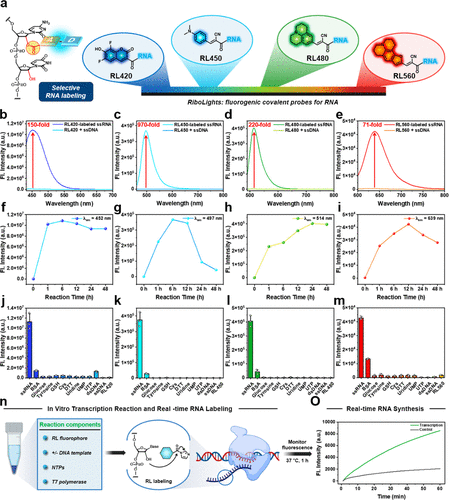
在与相同序列的单链RNA(ssRNA)和单链DNA(ssDNA)进行反应后,RL450与RNA反应后的荧光信号,相比于其与DNA共存时的信号,竟然实现了970倍的荧光增强。即使是表现最低的RL,也达到了71倍的RNA对DNA选择性。
这一数字在RNA成像领域具有里程碑意义。要知道,传统的商业RNA染料,例如SYTO RNASelect,据报道对RNA的选择性仅有约1.6倍。而RL荧光团轻松突破了这一障碍,最高的970倍选择性是史无前例的,远远超越了所有已知的商业或已发表的RNA染料。在实验中,当使用SYBR Gold这种传统染料时,它会同时且几乎等量地标记RNA和DNA,无法区分。但RL荧光团则能清晰地在电泳凝胶上只点亮RNA条带,对DNA完全“视而不见”。
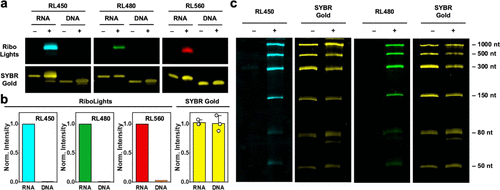
这种极高的特异性,从根本上解决了传统非共价染料所面临的背景噪声和脱靶问题。
多色成像与快速实时追踪的潜力
RL平台并非只有一种颜色。研究团队合成了四种荧光团,它们的发射光谱清晰分离,涵盖了蓝色(RL,发射峰452 nm)、青色(RL,发射峰497 nm)、绿色(RL,发射峰514 nm)和红色(RL,发射峰639 nm)。这意味着,科学家们首次可以利用共价、高特异性的探针,进行多色或多重检测,例如同时追踪细胞内不同类型的RNA或进行脉冲-追踪实验(Pulse-Chase experiments)。
此外,RL荧光团展现出极强的实时追踪能力。在体外RNA转录实验中,当T7 RNA聚合酶开始合成新的RNA链时,RL480荧光团能实时、同步地结合到新生的RNA上,并在很短的时间内(如60分钟)迅速提升荧光信号。这证明RL荧光团不仅能标记已有的RNA,还能实时监测细胞内的转录活性和RNA合成速率,这是传统染料难以企及的。
超越小分子干扰:化学选择性的稳健性
在细胞这个复杂的“化学工厂”中,存在着大量的天然小分子亲核试剂,比如常见的还原剂谷胱甘肽(GSH) 和各种氨基酸(如半胱氨酸、酪氨酸)。这些分子都带有高活性的亲核基团,理论上可能会与RL荧光团的酰基咪唑“插头”发生非特异性反应,产生背景信号。
然而,实验结果表明,RL荧光团对这些小分子亲核试剂的荧光响应微不足道。即便是与浓度高出RNA 10倍的牛血清白蛋白(BSA,一种常见的蛋白质)共孵育,RL荧光团也只产生了温和的信号。这种稳健的特异性被归因于:只有当染料结合到一个足够“庞大”的分子骨架上,才能有效地“刹住”TICT旋转,从而发光。小分子即使反应,形成的产物也太小,无法有效限制旋转,因此仍然保持“黑暗”状态。
这极大地增强了RL荧光团在真实生物环境中的应用价值,最大限度地避免了小分子脱靶反应带来的假阳性信号。
活细胞成像与低毒性
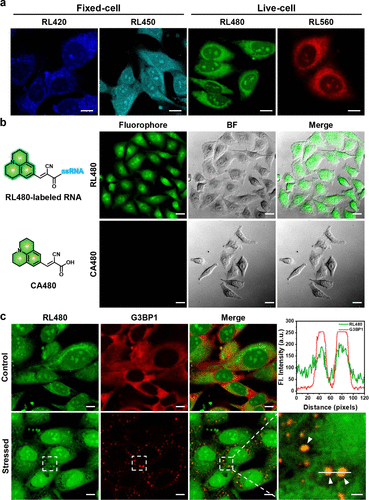
在活细胞成像实验中,RL480和RL560两种荧光团展现出良好的细胞膜通透性,可以在不经过细胞固定和透化处理的情况下,在活细胞中实现免洗的强荧光标记。它们清晰地富集在核仁(核糖体RNA富集的区域),有力地证明了其在细胞内的RNA选择性。此外,RL480还成功标记了细胞在应激状态下形成的应激颗粒(Stress Granules) 中的RNA,证明了其追踪动态、复杂细胞结构的能力。
更令人惊喜的是,即使在高达的浓度下长时间孵育,RL荧光团也表现出极低的细胞毒性。这归功于未反应的染料会快速水解成无毒的羧酸副产物,有效地限制了其与细胞内其他必需成分发生非特异性共价反应的时间。
🛣️ 应用展望、局限性与未来路线图
这项基于2'-OH化学的RiboLights技术,为RNA研究带来了巨大的想象空间。
潜在应用场景
实时转录监测: 实时跟踪RNA聚合酶的活性,精确测定基因的转录速率,实现动态生物学的突破。
高信噪比活细胞成像: 由于高达970倍的特异性,它可以成为在活细胞中长期、无损追踪特定RNA分子移动、定位和降解的理想工具。
疾病诊断与药物筛选: 特异性标记病原体(如病毒)的RNA或细胞内疾病相关RNA,用于高通量药物筛选和早期诊断。
多重分析: 利用四种不同的颜色,可以同时对多种RNA分子或RNA与蛋白质的相互作用进行多通道成像和分析。
客观局限性与未来改进方向
尽管RiboLights带来了革命性突破,但研究也客观指出了现有版本的局限性。
细胞膜渗透性: 并非所有颜色的染料都具有良好的细胞渗透性。蓝色和青色染料(RL420和RL450)需要细胞固定和透化后才能使用,这限制了它们在活细胞成像中的应用。未来的结构优化将着重于提升所有颜色染料的细胞膜渗透能力。
共价修饰的潜在影响: 尽管RL荧光团的标记密度较低,但共价修饰仍可能影响后续某些生化分析,例如逆转录(Reverse Transcription),甚至可能轻微改变短RNA在凝胶电泳中的迁移速度。不过,研究团队巧妙地发现,可以使用DMAP(N,N-二甲基氨基吡啶) 作为温和的亲核试剂,将已标记的染料从RNA上完全去除,恢复原始、未修饰的RNA,为后续分析留下了退路。
蛋白质脱靶: 虽然对小分子亲核试剂有很强的抗性,但蛋白质上的亲核侧链(如赖氨酸的胺基)仍有可能被少量标记。未来的研究将探索更有效的化学 “掩蔽” 策略来进一步降低这种非特异性干扰。
路线图展望
RL荧光团的设计原理具有极高的通用性。未来,研究团队计划扩展RL荧光团的光谱多样性,尤其是开发发射深红光和近红外光的探针,这将对组织成像和体内应用至关重要。通过将更多基于TICT机制的“推拉”型生色团的羧酸基团转化为酰基咪唑,可以轻松创建更多颜色的RL荧光团。
总之,RiboLights技术是化学生物学领域的一次重大飞跃。它以其970倍的超高特异性、共价稳定性和荧光激活的“隐形开关”机制,为生命科学界提供了一把前所未有的高精度“分子手术刀”和“光学显微镜”。我们有理由相信,这项技术将极大地加速我们对RNA生物学的理解,并在未来的疾病诊断、药物开发,以及活体成像等多个前沿领域中发挥核心作用。