【Angew.Chem.】RNA实时成像新突破:TriPPPPro策略实现高效标记,荧光增强率最高达45倍
文章标题:Live‐Cell RNA Imaging via Clickable TriPPPro Nucleotide Reporters
通讯作者:Prof. Dr. Jens B. Bosse, Prof. Dr. Hans-Achim Wagenknecht, Prof. Dr. Chris Meier
文章链接:https://doi.org/10.1002/anie.202516613
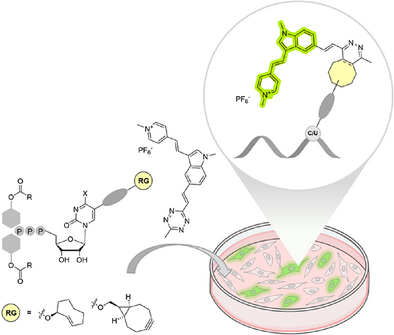
文章概要
引言
RNA在细胞内的合成与动态过程是理解生命活动的关键。然而,传统的RNA标记与成像方法,如FISH或铜催化的点击化学,往往需要固定细胞,无法实现实时观察。近年来,基于MS2系统、分子信标或CRISPR-Cas13的成像方法虽能标记特定RNA序列,但难以全面追踪整体RNA合成。本文提出了一种全新的化学策略——TriPPPPro(三磷酸前药)方法,结合逆电子需求Diels–Alder(IEDDA)反应与双荧光激活染料,实现了活细胞内RNA的高效、特异、低背景成像。
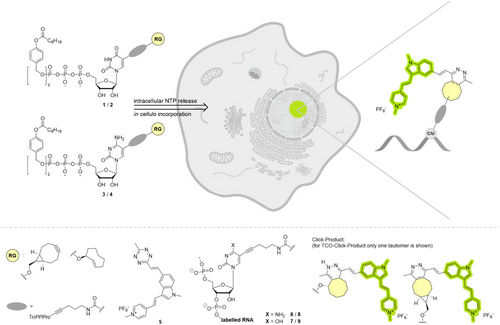
TriPPPPro策略的核心原理
TriPPPPro通过在核苷三磷酸上引入可水解的脂溶性保护基团,使其具备细胞膜通透性。进入细胞后,内源性酯酶水解保护基团,释放出活性核苷三磷酸(NTP),随后被RNA聚合酶整合进新生RNA链。此时,带有反应基团的核苷与荧光四嗪染料发生IEDDA点击反应,产生强烈的荧光信号。该方法无需额外转运蛋白,避免了传统方法的毒性与复杂性。
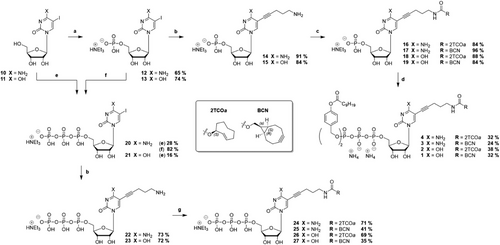
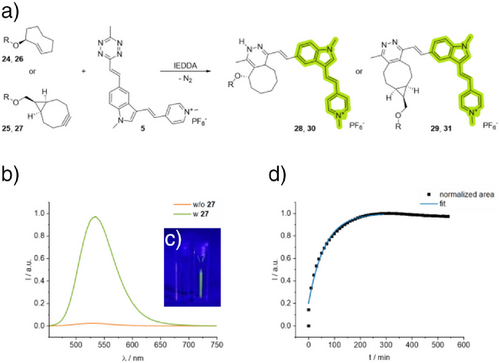
化学修饰与反应动力学
研究团队设计了两类修饰:
- 2TCOa(轴式反式环辛烯):反应速率常数高达 (10^4 M^{-1}s^{-1}),但可能出现荧光暂时降低的双步动力学过程。
- BCN(双环[6.1.0]壬炔):反应直接生成芳香吡嗪,避免了荧光淬灭,但反应速率略低。
实验显示,荧光增强倍数在31至45之间,证明两类修饰均能实现高效标记。
与传统方法的比较
研究者将TriPPPPro与SNTT转运系统进行对比。结果表明:
- TriPPPPro在细胞内的RNA整合效率更高,荧光信号更强。
- SNTT方法虽能实现一定程度的标记,但信号明显较弱,且存在毒性风险。
- TriPPPPro方法在不同哺乳动物细胞系中均表现出良好的适用性。
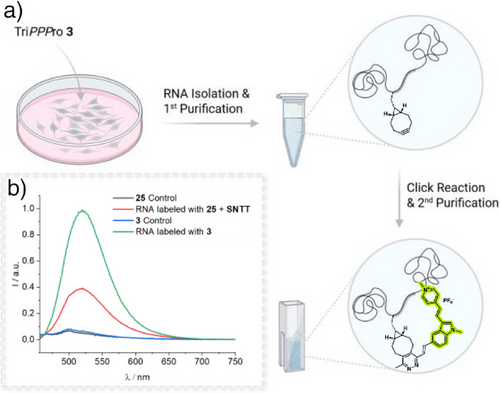
实验验证与成像结果
在Vero细胞中,TriPPPPro标记的RNA荧光信号集中于细胞核仁,与rRNA高度共定位,证明其特异性。进一步实验显示:
- 使用转录抑制剂Actinomycin D后,荧光信号消失,确认标记来源于新生RNA。
- 细胞质信号与线粒体探针共定位,表明该方法也能追踪线粒体RNA。
- 标记的RNA可在48小时内持续追踪,显示其稳定性与低毒性。
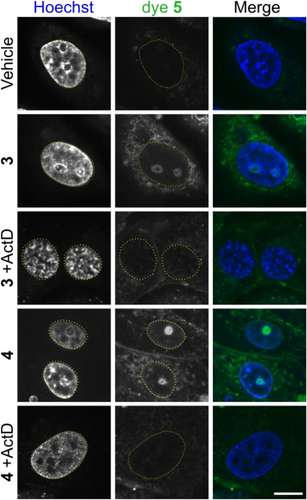
技术优势
- 高效递送:无需转运蛋白,避免毒性与复杂操作。
- 双荧光激活:染料在点击反应与核酸结合后双重增强信号,背景极低。
- 实时成像:可在活细胞中直接观察RNA合成与动态。
- 广泛适用性:适用于不同细胞类型,且可扩展至其他核苷修饰。
结论与展望
TriPPPPro策略成功解决了RNA实时成像中的三大难题:递送效率、标记特异性与信噪比。其模块化设计使得不同核苷与反应基团可灵活组合,未来有望应用于腺苷、鸟苷等修饰,甚至拓展至病毒RNA研究。该方法不仅为RNA生物学提供了强有力的工具,也为抗病毒药物研发开辟了新方向。
综上,本文展示了一种突破性的RNA成像技术,荧光增强率最高可达45倍,标记效率显著优于传统方法。TriPPPPro策略为实时、全面、低背景的RNA动态研究提供了新的可能性,具有广阔的应用前景。