【JACS】基因编码氟化物触发蛋白激活:92倍荧光差异与23%重组效率的突破
文章标题:Fluoride-Triggered Protein Activation via a Genetically Encoded Tyrosine Analogue
通讯作者:Minseob Koh
文章链接:https://doi.org/10.1021/jacs.5c13604
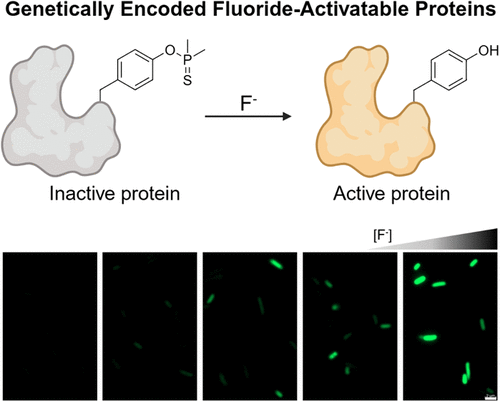
文章概要
引言与研究背景
在现代生命科学中,如何精准调控蛋白质活性是一个极具挑战性且意义重大的课题。传统的光控蛋白策略虽然发展成熟,但存在光毒性、组织穿透力有限以及依赖昂贵设备等问题。相比之下,化学诱导方法具有更好的组织渗透性和操作简便性,但相关研究仍相对不足。氟离子因其小分子特性、低成本和高水溶性,逐渐被视为一种理想的化学触发因子。然而,现有的氟化物响应系统主要局限于转录和翻译水平,缺乏直接作用于蛋白质功能的策略。
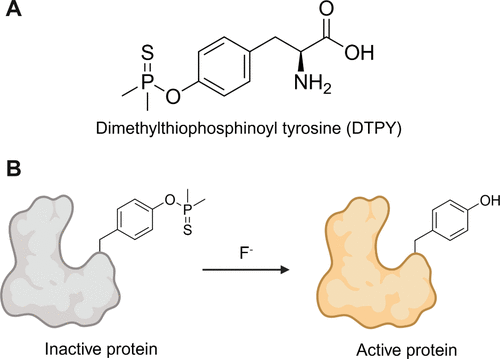
创新点:DTPY的设计与合成
研究团队设计了一种新型非天然氨基酸——二甲基硫代膦酰基酪氨酸(DTPY),其酚羟基被DTP保护基封闭,可在氟离子作用下选择性脱保护,恢复天然酪氨酸功能。合成实验显示,DTPY在氟化物存在下能高效去保护,动力学常数为 (2.4 \times 10^{-4} , M^{-1} \cdot s^{-1}),证明其在水相环境中具备良好的反应性。
蛋白质水平的应用与验证
研究团队通过基因编码技术将DTPY引入关键位点:
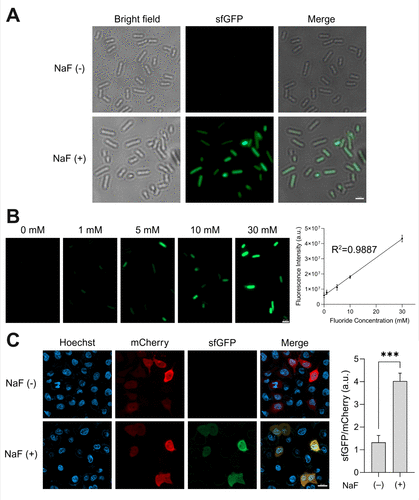
- 荧光蛋白sfGFP:在色团形成位点Tyr66引入DTPY后,荧光强度下降92倍,表明色团成熟被阻断。经氟化物处理后,荧光完全恢复,且光谱与天然sfGFP一致,验证了氟化物依赖的激活机制。检测下限约为468 μM,显示其在高浓度氟化物下具有良好响应。
- Cre重组酶:在催化位点Tyr324引入DTPY后,酶活性完全丧失。氟化物处理后,重组效率提升至23%,并在延长时间下进一步提高,证明该策略可用于精确调控DNA重组。
细胞水平的实验结果
在大肠杆菌和人源A549细胞中,研究团队成功实现了氟化物依赖的蛋白激活:
- 大肠杆菌:在30 mM NaF处理下,sfGFP荧光显著增强,且细胞在60 mM以内仍保持良好生长,显示该系统的生物相容性。
- A549细胞:在短时处理(100分钟)下,细胞在50 mM NaF条件下仍有73%存活率;但长时间处理(12小时)时,IC50约为11 mM,提示在哺乳动物系统中需优化以降低氟化物浓度。
特异性与选择性
实验表明,DTPY对氟离子具有高度选择性。在测试的多种阴离子(如Br⁻、I⁻、SO₄²⁻等)中,仅氟离子能触发荧光恢复。这种选择性源于氟离子与膦酰基之间的强相互作用,确保了体系的正交性和可靠性。
应用前景与意义
该研究首次实现了氟化物在蛋白质水平的直接激活,为合成生物学和细胞工程提供了全新的工具。其潜在应用包括:
- 活细胞氟化物检测与成像:通过荧光蛋白实现实时监测。
- 基因调控与合成线路设计:利用Cre重组酶等关键酶的可控激活,构建复杂的遗传电路。
- 药物开发与代谢工程:在需要延迟或渐进激活的场景中,适度的动力学特性反而成为优势。
结论
本文展示了一种基于DTPY的氟化物触发蛋白激活平台,成功实现了从荧光蛋白到重组酶的功能调控。尽管目前检测灵敏度和激活阈值仍需优化,但该策略为未来的蛋白质功能控制提供了新的思路。其在合成生物学、药物研发和细胞工程中的应用前景广阔,标志着化学诱导蛋白激活领域的重要突破。