【JMC】不要仅聚焦于PDT, 三种金属配合物对三阴性乳腺癌的作用机制详解
文章标题:Turning the Spotlight Away from PDT: Chemodynamic Dominance of 2-(2-Bromopyridin-4-yl)-1H-imidazo[4,5-f][1,10]phenanthroline Based Ru(II)/Ir(III)/Re(I) Complexes against MDA-MB-231
通讯作者:Samya Banerjee_, Debajit Chaudhury_, Bipasha Bose_, Priyankar Paira_
文章链接:https://doi.org/10.1021/acs.jmedchem.5c02400
文章概要
研究背景
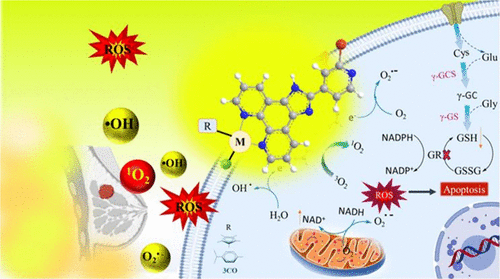
乳腺癌是全球女性死亡率最高的癌症之一,其中三阴性乳腺癌(TNBC)因缺乏雌激素受体(ER)、孕激素受体(PR)和HER2受体而成为最具侵袭性的亚型。现有治疗手段如化疗、放疗和手术虽有一定疗效,但副作用大且易耐药。金属配合物因其独特的化学性质逐渐成为抗癌研究的新方向。本文系统研究了三类金属配合物——Ru(II)、Ir(III)、Re(I),并探讨其在TNBC细胞(MDA-MB-231)中的作用机制。
合成与表征
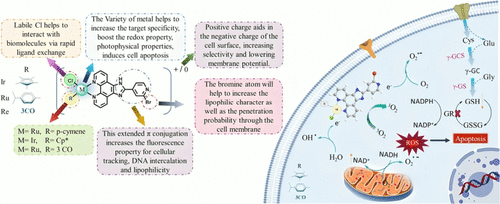
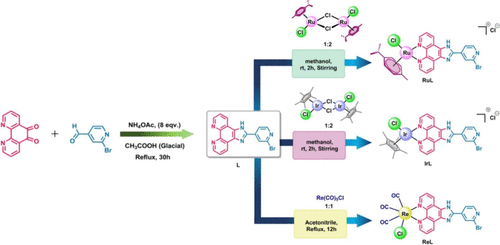
研究团队合成了含有2-(2-溴吡啶-4-基)-1H-咪唑[4,5-f][1,10]菲咯啉配体的三种金属配合物:[RuL]、[IrL]、[ReL]。通过核磁共振(¹H、¹³C NMR)、高分辨质谱(HRMS)、红外光谱(FT-IR)及超高效液相色谱(UPLC)确认了其结构与纯度。结果显示这些配合物均具有较高的稳定性和良好的光物理特性。
光物理与光动力学评估
初步的TD-DFT计算和激发态寿命分析表明这些配合物具备光敏化潜力。然而在光动力治疗(PDT)实验中,它们的光毒性指数(PI)均较低,仅在光照下表现出轻微增强的细胞毒性,远不及对照药物Photofrin。这意味着它们并不适合作为单纯的PDT药物。
化学动力学治疗(CDT)潜力
在黑暗条件下,[RuL]表现出显著的细胞毒性(IC₅₀约30 μM),远优于[IrL]和[ReL]。进一步研究发现,[RuL]能在无光条件下诱导强烈的活性氧(ROS)生成,导致线粒体膜电位下降、细胞周期阻滞(G0/G1期)以及凋亡相关基因的调控(↑TP53、↑BAX、↓BCL-2)。这些结果表明其主要作用机制是通过线粒体靶向的化学动力学治疗(CDT)。
生物分子相互作用
- 与谷胱甘肽(GSH)和N-乙酰半胱氨酸(NAC)作用:实验显示这些配合物能氧化GSH生成GSSG,削弱肿瘤细胞的抗氧化防御。
- DNA结合实验:紫外吸收和荧光竞争实验表明三种配合物均能通过嵌插作用与DNA结合,其中[RuL]和[ReL]的结合常数较高。
- 蛋白质结合实验:与牛血清白蛋白(BSA)的结合实验显示三者均能通过氢键和疏水作用结合蛋白质,有助于在体内运输。
细胞水平实验
- 线粒体定位:荧光显微镜显示[RuL]主要定位于线粒体,Pearson相关系数高达0.855。
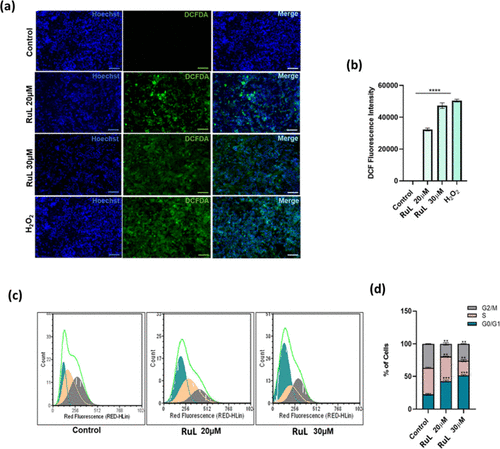
- ROS生成:DCFDA染色实验表明[RuL]能显著提升细胞内ROS水平,诱导氧化应激。
- 细胞周期阻滞:处理后细胞在G0/G1期显著积累,抑制了DNA复制与细胞增殖。
- 凋亡检测:Annexin V-FITC/PI双染实验显示在30 μM浓度下约27%的细胞进入早期或晚期凋亡。
- 基因表达分析:qRT-PCR结果显示TP53和BAX上调,BCL-2下调,进一步验证了其通过线粒体途径诱导凋亡。
分子对接研究
分子对接结果显示,[RuL]与p53蛋白、caspase-9及波形蛋白(vimentin)均有较强结合能力,提示其可能通过多靶点机制抑制肿瘤细胞的增殖与侵袭。
结论与意义
本文系统研究了Ru(II)、Ir(III)、Re(I)三种金属配合物在TNBC细胞中的作用机制。结果表明它们在光动力治疗中的效果有限,但在化学动力学治疗方面展现出巨大潜力,尤其是Ru(II)配合物[RuL],其通过线粒体靶向、ROS生成、细胞周期阻滞和凋亡诱导等多重机制发挥抗癌作用。这一发现为开发新型金属基抗癌药物提供了重要思路,也为三阴性乳腺癌的治疗开辟了新的方向。
总结来看,这项研究不仅揭示了金属配合物在肿瘤治疗中的新机制,还强调了从光动力到化学动力学治疗的研究转向,具有重要的临床应用前景。