【Angew.Chem.】突破多药耐药癌症的新路径:Ir(III)免疫性坏死诱导剂实现1.7倍更强杀伤力
文章标题:Boosting Cancer Chemoimmunotherapy with Mitochondria‐Targeting Iridium(III)‐Based Immunogenic Oncosis Inducers
通讯作者:Prof. Dr. Hui Chao
文章链接:https://doi.org/10.1002/anie.202521242
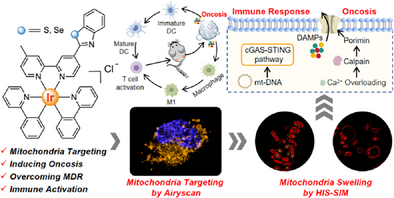
文章概要
癌症治疗的困境与新思路
癌症仍是全球主要死亡原因之一,2020年约有1000万人死于癌症,预计到2040年新发病例将达到2950万,死亡人数超过1640万。传统化疗药物如顺铂、紫杉醇和阿霉素主要通过诱导细胞凋亡发挥作用,但疗效有限,且常因多药耐药(MDR)而失效。耐药机制包括药物摄取减少、外排增强、解毒能力提升以及凋亡途径受阻。研究者们亟需探索新的细胞死亡方式来突破这一瓶颈。
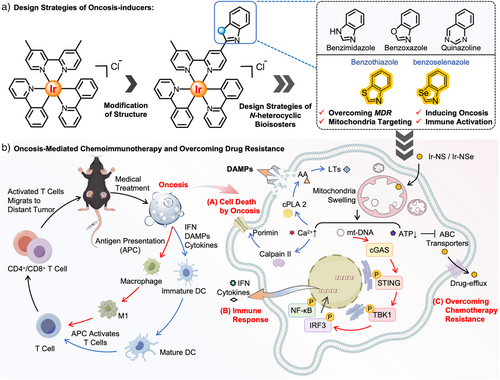
坏死性细胞死亡(Oncosis)的独特优势
与依赖ATP和半胱天冬酶的凋亡不同,坏死性细胞死亡(Oncosis)是一种炎症性死亡形式,特征包括线粒体肿胀、细胞膜破裂和炎症反应。其优势在于:
- ATP耗竭可抑制ABC转运蛋白,阻止药物外排;
- 不依赖凋亡途径,绕过凋亡相关耐药机制;
- 能有效激活免疫反应,促进抗肿瘤免疫。
Ir(III)免疫性坏死诱导剂的设计与验证
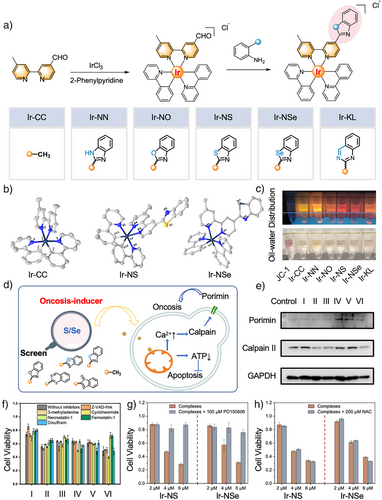
研究团队首次设计了线粒体靶向的Ir(III)金属配合物,利用生物等排体策略引入苯并噻唑和苯并硒唑基团,成功诱导坏死性死亡并激活cGAS–STING通路。
- 结构与稳定性:通过简洁的两步合成获得高纯度配合物,单晶结构显示其呈畸变八面体构型,稳定性良好。
- 细胞毒性:在耐药肺腺癌细胞A549R中,顺铂的IC50为98.4 µM,而Ir-NS和Ir-NSe仅为1.1 µM,毒性提升约1.7倍。
- 机制验证:Western blot显示Porimin和Calpain II显著上调,证明坏死途径被激活;Ca²⁺过载而非ROS积累是主要驱动因素。
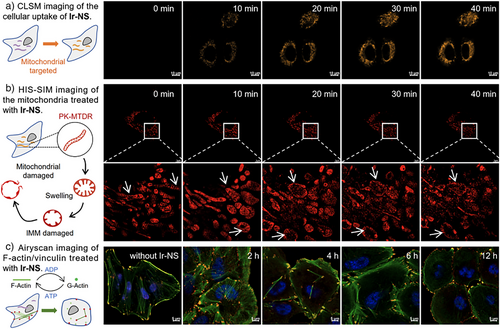
多层次机制解析
- 线粒体破坏:Ir-NS在40分钟内进入线粒体,引发肿胀和膜电位下降,ATP产量显著减少。
- 细胞骨架重塑:β-肌动蛋白水平下降,F-actin逐渐解聚,细胞形态出现水肿和膜泡。
- 转录组学分析:约6000个基因差异表达,涉及糖酵解、ABC转运蛋白、细胞骨架调控等通路。尤其是耐药相关基因MRP1显著下调。
- 免疫激活:线粒体DNA损伤导致cGAS–STING通路活化,促进干扰素和炎症因子释放;同时诱导免疫原性细胞死亡(ICD),释放CRT、HMGB1、ATP和HSP70等信号分子。
动物实验与纳米递送
由于Ir-NS和Ir-NSe对正常细胞也有一定毒性,研究者将其封装于PEG化纳米颗粒中,实现肿瘤靶向递送。
- 安全性:在小鼠中表现出良好血液相容性和器官安全性。
- 疗效:在CMT167肺癌模型中,肿瘤重量降至PBS组的三分之一;肿瘤组织出现大面积坏死。
- 免疫效应:树突状细胞成熟率提升至约50%,M1型巨噬细胞比例增加20%,效应记忆T细胞比例提升至24%,而调节性T细胞比例减半。
- 长期保护:在远端肿瘤和脾脏中,细胞毒性T细胞和记忆T细胞显著增加,显示出持久的免疫记忆和抗复发能力。
研究意义与前景
该研究首次证明了坏死性细胞死亡与cGAS–STING通路之间的直接联系,并展示了Ir(III)配合物在突破耐药癌症中的潜力。其双重机制——通过坏死性死亡直接杀伤肿瘤细胞,同时激活免疫系统——为化疗与免疫治疗的融合提供了新思路。凭借结构简洁、可修饰性强的特点,这类金属药物有望成为未来抗癌治疗的重要候选。
这项工作不仅为多药耐药癌症提供了新的解决方案,也为金属药物的理性设计开辟了新方向,展示了化疗与免疫疗法结合的广阔前景。