【J. Med. Chem.】3种钌(II)复合物实现光动力诱导焦亡、双光子成像与疗效自评:一体化抗癌新策略
文章标题: Three in One: Viscosity-Sensitive Ruthenium(II) Complexes for Photodynamic Anticancer by Activating Pyroptosis with Self-Evaluation Therapeutic Efficacy and Two-Photon Imaging 通讯作者:LiYan Zheng 文章链接:https://doi.org/10.1021/acs.jmedchem.5c02006
文章概要
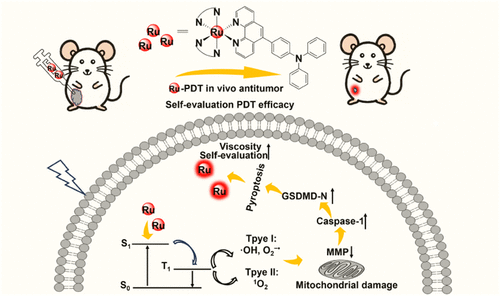
在精准光动力治疗(PDT)领域,如何实现治疗过程的实时监测一直是关键挑战。本文由LiYan Zheng团队发表于《Journal of Medicinal Chemistry》,提出了一种“三合一”策略,设计并合成了三种粘度响应型钌(II)-三苯胺复合物(Ru1–3),不仅具备光动力抗癌能力,还能诱导肿瘤细胞焦亡,并通过粘度变化实现治疗效果的自我评估,同时具备双光子成像能力,展示了多功能光敏剂在肿瘤治疗中的巨大潜力。
研究首先合成了三种钌(II)复合物Ru1、Ru2和Ru3,其通式为Ru(N∧N)₂L₂,其中L为含三苯胺基团的1,10-菲咯啉配体,N∧N分别为2,2'-联吡啶(Ru1)、1,10-菲咯啉(Ru2)和4,7-二苯基-1,10-菲咯啉(Ru3)。通过核磁共振、质谱和单晶X射线衍射等手段对其结构进行了全面表征。
光物理研究显示,Ru1–3在PBS中激发波长为450 nm时,分别在602、606和590 nm处出现发射峰,具有长寿命的三重态磷光特性。在不同粘度环境下,三者的发光强度显著增强,且与粘度呈良好的线性关系,Ru3的粘度响应性最强,归因于其分子结构中旋转苯基数量较多以及较大的HOMO-LUMO能隙,限制了分子内电荷转移过程,从而增强了荧光。
在光照条件下,Ru1–3可高效产生活性氧(ROS),包括单重态氧(¹O₂)、羟基自由基(•OH)和超氧阴离子(O₂•–),兼具I型和II型光敏剂特性。其中Ru3在产生活性氧方面表现最优,具有良好的光稳定性和选择性,对肿瘤细胞(如HepG2)具有显著的光毒性而对正常细胞毒性较低。
机制研究表明,Ru1和Ru3可诱导肿瘤细胞焦亡(pyroptosis),这一新型程序性细胞死亡方式依赖于炎症半胱天冬酶(caspase-1)激活和GSDMD裂解,导致细胞膜膨胀破裂并释放炎症因子。实验中观察到细胞膜膨胀、泡状突起形成以及线粒体膜电位(MMP)去极化,进一步验证了焦亡过程。此外,Ru1和Ru3还能诱导免疫原性细胞死亡(ICD),促进CRT和HMGB1的释放,激发抗肿瘤免疫反应。
在治疗过程中,Ru1和Ru3的粘度响应性使其能够通过荧光强度变化实时反馈治疗效果。细胞焦亡过程中细胞内粘度升高,导致分子旋转受限,荧光增强,从而实现治疗与疗效评估的同步。相比传统需双分子探针的策略,该单分子系统避免了相分离带来的误判,提升了成像准确性。
在三维多细胞肿瘤球(3D MCTSs)模型中,Ru1和Ru3展现出良好的双光子吸收(TPA)特性,Ru3的穿透深度达174.72 μm,TPA截面为407 GM,远优于Ru1。在810 nm双光子激发下,Ru3可有效诱导肿瘤球死亡,并通过荧光增强反馈治疗进程,进一步验证了其在复杂肿瘤微环境中的应用潜力。
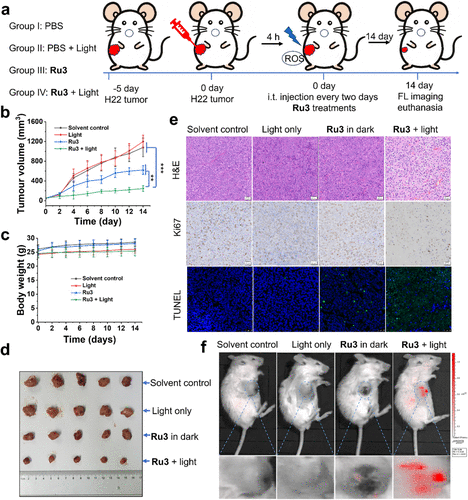
动物实验方面,Ru3在H22小鼠肿瘤模型中表现出显著的光动力抗肿瘤效果,肿瘤抑制率达79.5%,且无明显毒副作用。治疗后,通过体内荧光成像观察到Ru3在光照组中发光强度显著增强,与肿瘤体积减小相对应,验证了其自我评估治疗效果的能力。
综上所述,本文提出的Ru1–3复合物,尤其是Ru3,集光动力治疗、焦亡诱导、粘度响应成像与双光子成像于一体,构建了一个多功能、精准、高效的抗癌平台。该研究不仅拓展了钌配合物在生物医学领域的应用,也为未来开发具备治疗与反馈功能的智能光敏剂提供了新思路。