【JACS】3 大功能合一!这款稀土诊疗螯合剂平台,实现诊断、手术、放疗一体化突破
文章标题:A Trifunctional, Rare-Earth Theranostic Chelator Platform to Enable Diagnostic Nuclear Imaging, Surgical Resection, and Radiotherapy 通讯作者:Eszter Boros 文章链接:https://doi.org/10.1021/jacs.5c15147
文章概要
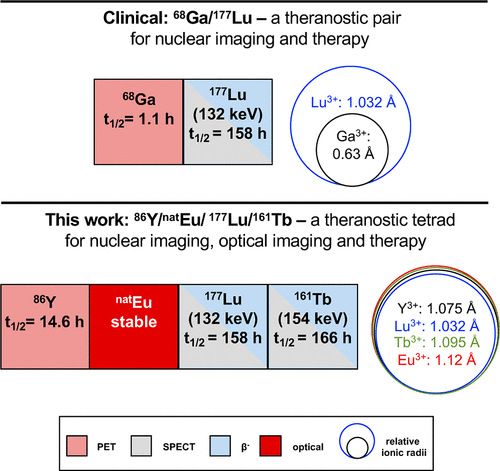
在疾病诊疗领域,治疗诊断学(Theranostics)一直追求实现疾病诊断、分层与匹配治疗的一体化,而单分子平台因能整合诊断与治疗功能,对疾病检测、治疗及疗效实时监测具有重要意义。然而,现有核医学诊疗面临诸多局限,临床常用的 68Ga³⁺/¹⁷⁷Lu³⁺对中,68Ga 半衰期仅 1.1h,且 Ga³⁺(6 配位)与 Lu³⁺(8 配位)配位特性不同,导致药代动力学差异,影响剂量测定;核 / 光学双模态探针虽在临床前研究有潜力,但药代动力学、亲脂性改变及监管障碍阻碍了其临床转化。不过,稀土元素 Y、Eu、Tb、Lu 化学同源性高,Eu 具备生物相容性发光特性,Y、Tb、Lu 拥有适用于核成像和放疗的放射性核素,这为研发单一螯合平台适配多模态与多元素提供了可能。基于此,美国威斯康星大学麦迪逊分校化学系、医学物理系、放射科等团队的 M. Andrey Joaqui-Joaqui 等人,在 2025 年 12 月 1 日于《Journal of the American Chemical Society》(J. Am. Chem. Soc.)在线发表研究,成功开发出一款稀土诊疗螯合剂平台,该研究获美国国家科学基金会(NSF Career 19942434)等资金支持,且文章以开放获取(CC-BY 4.0 协议)形式供读者访问。
这款研究的核心是构建单分子三功能平台,以兼容诊断性正电子发射断层扫描(PET)、光学成像辅助术中切除、放射性治疗稀土核素螯合。在平台设计与构建上,团队围绕配体与复合物展开深入研究。基于吡啶炔基芳基(PEPA)天线支架,制备了含 PEPA 或甲氧基取代 MEPA 发色团的单天线和双天线类似物,以此评估天线数量、聚乙二醇(PEG)取代对光物理和生物性能的影响。同时,通过三氮杂环壬烷(tacn)支架逐步烷基化等方法,成功合成了 mepa-pic₂、mepa₂-pic、pepa-pic₂、pepa₂-pic 等配体,后续这些配体在水介质(pH5.5)中与 Y³⁺、Eu³⁺等形成了复合物。
在光物理特性表征方面,所有螯合平台在 318nm 处均有基于吡啶炔基芳基天线分子内电荷转移(ILCT)跃迁的吸收带,与 Eu³⁺配位后,吸收峰红移至 330-336nm,且 Eu³⁺复合物呈现出特征 5D₀-⁷FJ(J=0-6)光致发光谱。值得注意的是,单天线复合物(如 Eu-pepa-pic₂量子产率 42%)与双天线复合物(如 Eu-pepa₂-pic 量子产率 32%)量子产率相近,且均无内球结合水(q=0),这一特性有效避免了 OH 振荡器导致的非辐射发光猝灭。此外,体外幻影成像显示,1nmol Eu 复合物与 68Ga³⁺(10μCi)或⁹⁰Y³⁺共孵育时,可产生能区分于背景的 CRET 介导发光,且单天线与双天线复合物检测限无显著差异。
药代动力学优化是该平台实用化的关键环节。团队采用 86Y³⁺(t₁/₂=14.7h)标记四种配体,其中 [86Y] Y-pepa-pic₂摩尔比活度达 12.8mCi/μmol,放射化学纯度高,无需额外纯化。通过 logD₇.₄值分析发现,[86Y] Y-pepa-pic₂最亲水(logD₇.₄=-1.95)。生物分布研究进一步证实,其在血液(0.78±0.19% ID/g)、肺(1.75±0.50% ID/g)、肝脏(1.48±0.39% ID/g)中滞留量最低,且能经肾脏快速清除,体内稳定性极高(>98% 注射示踪剂保持完整)。
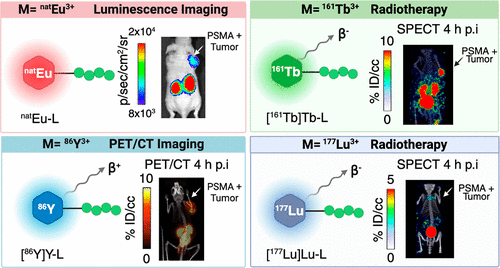
为验证平台的靶向结合能力,研究人员将 pepa-pic₂与靶向前列腺特异性膜抗原(PSMA)的 C-Hex-KuE 肽结合,合成了 Eu-pepa-pic₂-C-Hex-KuE 等共轭物。免疫组化实验结果显示,Eu-pepa-pic₂-C-Hex-KuE 可与 PSMA 阳性(PC3-PIP)肿瘤组织特异性结合,而在 PSMA 阴性(PC3-flu)组织中无显著信号,这与 PSMA 抗体染色结果一致,充分证明了该平台的靶向准确性。
在诊断模态验证(PET 成像)中,[86Y] Y-pepa-pic₂-C-Hex-KuE 放射化学产率高,摩尔活度 96mCi/μmol,放射化学纯度 > 98%。在裸鼠双侧 PSMA± 肿瘤模型的 PET/CT 成像中,0.5h 时 PSMA + 肿瘤就有示踪剂富集,PSMA - 肿瘤无显著积累;25h 时 PSMA + 肿瘤摄取量达 3.3±1.0% ID/cc,且示踪剂主要经肾脏清除,非靶器官(肝、血、心等)滞留量,展现出优异的诊断成像效果。
光学成像模态验证从不同注射方式展开。向 PSMA + 肿瘤注射 20nmol Eu-pepa-pic₂-C-Hex-KuE,同时全身注射 290μCi [68Ga] Ga-PSMA-617(CRET 光源),肿瘤区域光学信号显著增强,且在 68Ga 两个半衰期后仍可区分;而 100nmol Eu-pepa-pic₂-C-Hex-KuE 与 295μCi [68Ga] Ga-PSMA-617 全身共注射时,因受体竞争结合,肿瘤区域信号无显著增强,但肾脏区域信号增强(两者在肾脏共定位),为术中切除提供了重要参考。
放疗核素兼容性验证同样取得良好成果。在 80℃、pH5.5 条件下,成功制备了 [177Lu] Lu-pepa-pic₂-C-Hex-KuE(摩尔活度 38.7mCi/μmol)和 [161Tb] Tb-pepa-pic₂-C-Hex-KuE(摩尔活度 29.4mCi/μmol)。SPECT 成像与生物分布显示,两种治疗探针在 PSMA + 肿瘤中持续摄取,主要经肾脏清除,非靶器官无沉积,且与 [86Y] Y-pepa-pic₂-C-Hex-KuE 药代动力学特性一致,确保了放疗的安全性和有效性。
综上所述,该研究成功开发的基于稀土元素的三功能螯合剂平台,通过优化天线结构,在保持良好光物理特性的同时,显著提升了水溶性与药代动力学性能。该平台实现了 PET 诊断成像、CRET 介导光学成像、β⁻放疗(¹⁷⁷Lu、¹⁶¹Tb)功能的整合,且各模态间化学与生物同源性高,有利于剂量测定与个性化治疗,为前列腺癌等疾病的诊断、手术切除与放射治疗提供了一体化解决方案,同时符合监管机构对化学同源分子药物的转化加速要求。