🚀【Nat. Biomed. Eng】突破固体肿瘤治疗瓶颈:一种融合蛋白CAR-T细胞策略实现100%治愈率
文章信息
📚文章标题:Solid tumour CAR-T cells engineered with fusion proteins targeting PD-L1 for localized IL-12 delivery 作者:Saul J. Priceman 等 期刊:Nature Biomedical Engineering 链接:https://doi.org/10.1038/s41551-025-01509-2
近年来,嵌合抗原受体T细胞(CAR-T)疗法在血液肿瘤领域取得了显著进展,但在治疗固体肿瘤方面仍面临诸多挑战。最新发表于《Nature Biomedical Engineering》的研究提出了一种创新策略:通过工程化CAR-T细胞,使其分泌融合蛋白αPD-L1–IL-12,在肿瘤局部实现免疫调节,从而显著提升疗效与安全性 1。
🔬背景:为何固体肿瘤难治?
固体肿瘤的治疗难点主要源于其免疫抑制性微环境(TME),这导致:
- T细胞难以有效进入肿瘤组织;
- T细胞易疲劳,持续性差;
- 内源性免疫反应受限。
尽管免疫检查点抑制剂(如αPD-1、αCTLA-4、αPD-L1)在某些癌症(如黑色素瘤、非小细胞肺癌)中表现良好,但对“免疫冷”型肿瘤(如前列腺癌、卵巢癌)疗效有限。此外,细胞因子如IL-12虽能增强免疫反应,但其系统性毒性(如细胞因子释放综合征)限制了临床应用。
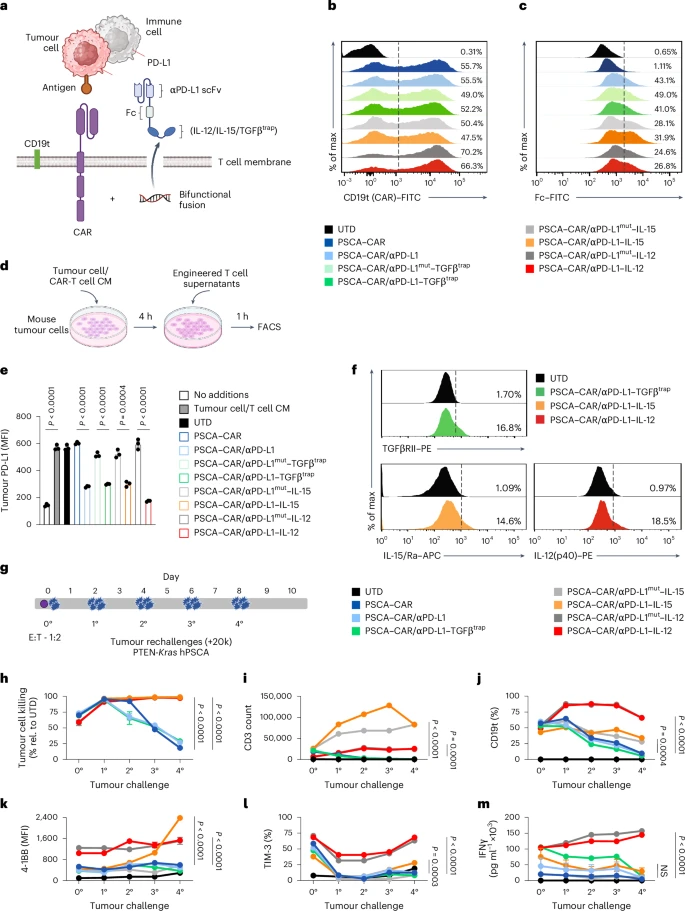
🧪研究设计:CAR-T细胞+融合蛋白的组合策略
研究团队设计了三种融合蛋白:
- αPD-L1–TGFβ trap
- αPD-L1–IL-15
- αPD-L1–IL-12
这些融合蛋白由CAR-T细胞分泌,旨在:
- 局部阻断PD-L1,解除免疫抑制;
- 同时释放细胞因子,激活免疫反应;
- 降低系统毒性,提升治疗指数。
在体外实验中,αPD-L1–IL-12融合蛋白表现出最强的PD-L1结合能力和IFNγ诱导能力,显著增强CAR-T细胞的杀伤力和激活状态。
🐭动物实验:前列腺癌模型实现100%治愈
在小鼠前列腺癌模型中,研究者比较了不同CAR-T细胞治疗组的疗效:
- αPD-L1–IL-12组实现100%肿瘤清除;
- αPD-L1 mut–IL-12组仅50%;
- αPD-L1–IL-15和αPD-L1–TGFβ trap组无显著疗效。
此外,αPD-L1–IL-12组未出现明显体重下降,表明系统毒性显著降低。血清IFNγ水平也低于其他组,进一步验证了局部免疫调节的优势。
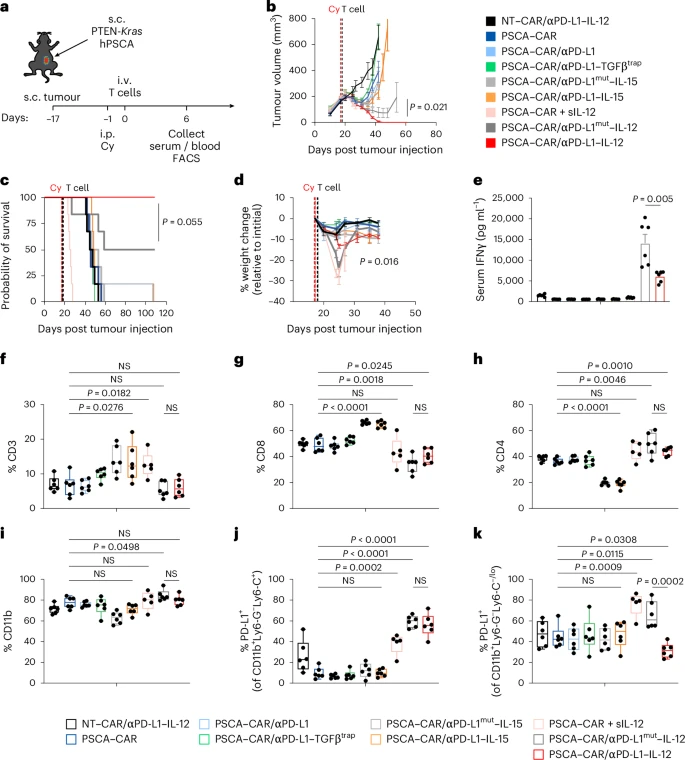
🧬卵巢癌模型:生存期延长至150天以上
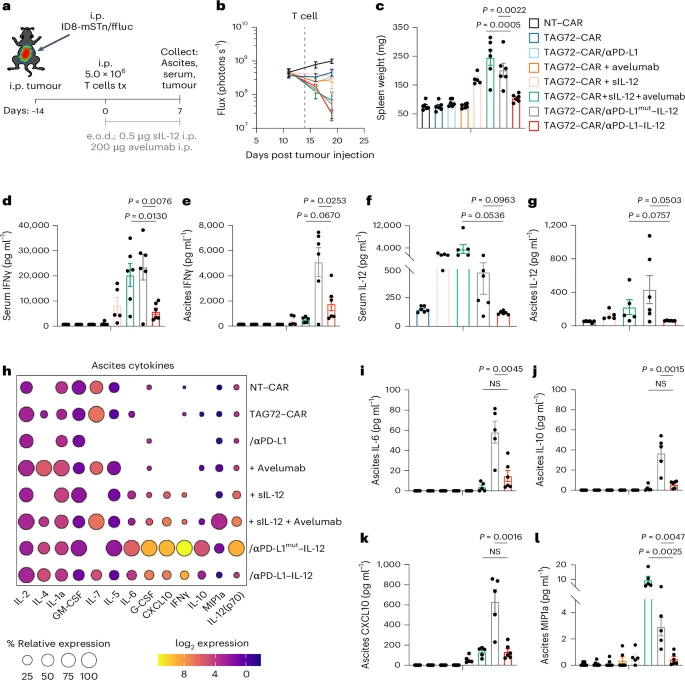
在卵巢癌腹膜转移模型中,TAG72–CAR-T细胞工程化表达αPD-L1–IL-12后:
- 显著抑制肿瘤生长;
- 实现100%小鼠长期生存(超过150天);
- 局部IFNγ水平显著升高,系统炎症反应减弱。
相比之下,αPD-L1 mut–IL-12组虽有一定疗效,但生存率和安全性均不及αPD-L1–IL-12组。
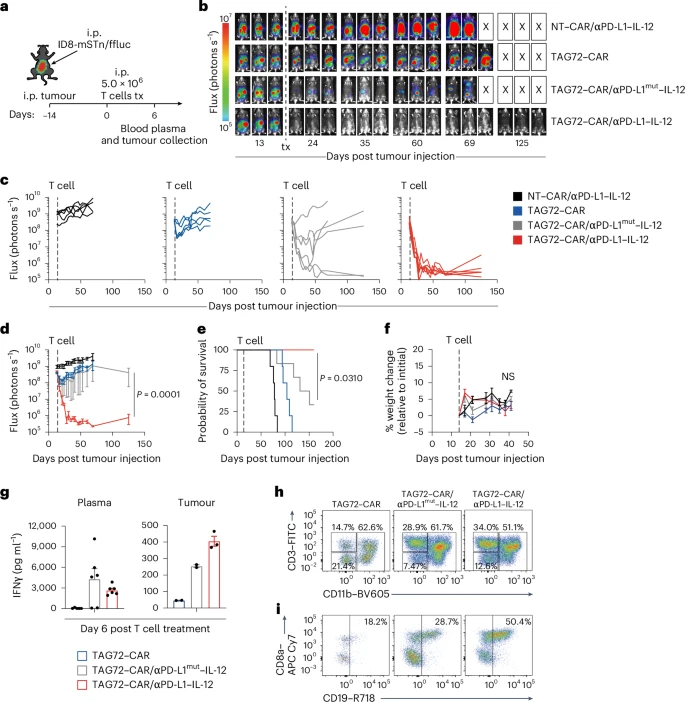
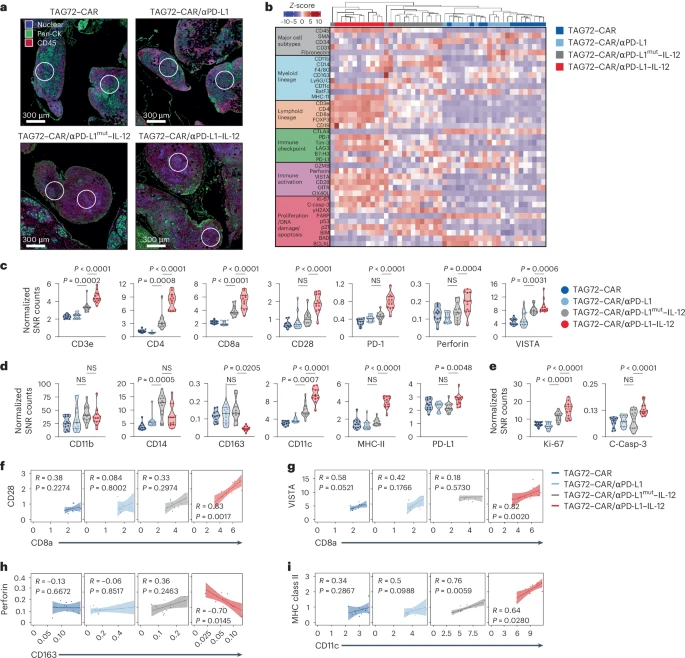
🧠肿瘤微环境重塑:免疫细胞全面激活
通过空间蛋白组学分析,研究发现αPD-L1–IL-12组在肿瘤组织中诱导:
- CD3、CD4、CD8 T细胞显著富集;
- 激活标志物(CD28、PD-1、Perforin)表达升高;
- 抑制性M2型巨噬细胞(CD163)减少;
- 抗原呈递细胞(MHC II+、CD11c+)增加;
- 细胞增殖(Ki-67)和凋亡(Caspase-3)水平提升。
这些变化表明CAR-T细胞不仅直接杀伤肿瘤,还能通过局部免疫调节重塑TME,激活内源性免疫系统。
💉对比传统治疗:融合蛋白策略更安全高效
研究进一步比较了三种治疗方式:
- 工程化CAR-T细胞分泌αPD-L1–IL-12;
- CAR-T细胞联合注射αPD-L1抗体和IL-12;
- CAR-T细胞分泌αPD-L1 mut–IL-12。
结果显示:
- αPD-L1–IL-12组肿瘤抑制最强,系统炎症最低;
- 其他组出现脾脏肿大、IFNγ升高、IL-6/IL-10等炎症因子显著上升;
- 多重炎症指标提示潜在细胞因子释放综合征风险。
这表明融合蛋白策略在疗效与安全性之间实现了理想平衡。
👨🔬临床转化潜力:人源CAR-T细胞验证成功
研究团队还构建了人源αPD-L1–Fc–hIL-12融合蛋白,并在体外验证其功能:
- 成功结合PD-L1;
- 显著提升CAR-T细胞杀伤力、激活状态和IFNγ分泌;
- 减少肿瘤细胞和T细胞表面PD-L1表达。
这为未来临床应用奠定了坚实基础。 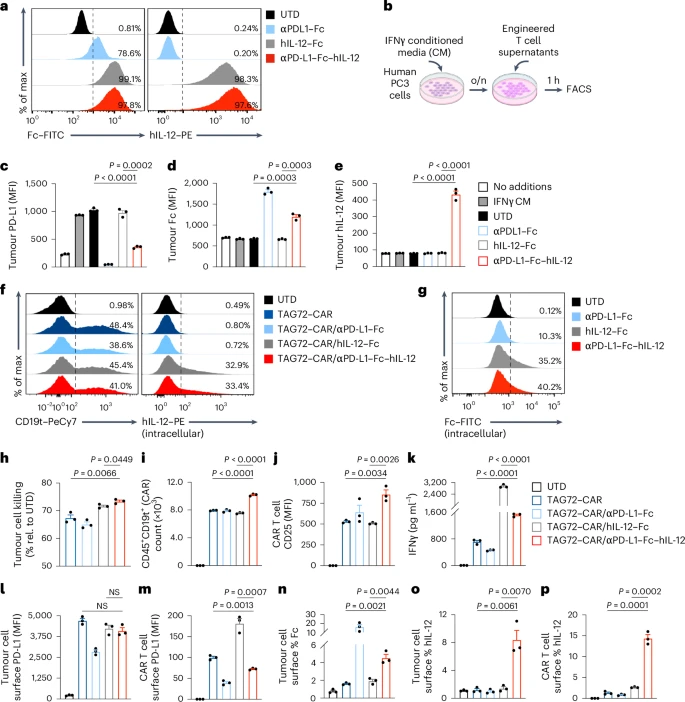
🧭结语:CAR-T疗法的下一个里程碑
本研究展示了一种创新的CAR-T细胞工程策略,通过局部分泌αPD-L1–IL-12融合蛋白,实现了在前列腺癌和卵巢癌模型中的显著疗效和安全性提升。其核心优势包括:
- 局部免疫调节,避免系统毒性;
- 重塑肿瘤微环境,激活多种免疫细胞;
- 单次治疗即可实现长期疗效。
未来,该策略有望推广至更多实体瘤类型,并与其他免疫检查点抑制剂或细胞因子联合使用,开启CAR-T疗法的新纪元。