🔬【JACS】突破100微米!三种光控荧光探针实现活细胞与组织级别成像新高度
文章信息
📚文章标题:Two-Photon Light-Activatable Fluorophores for Organelle Imaging in Living Cells and Tissue-Level Imaging 作者:Chunyan Tan* 等 期刊:Journal of the American Chemical Society 链接:https://doi.org/10.1021/jacs.5c14442
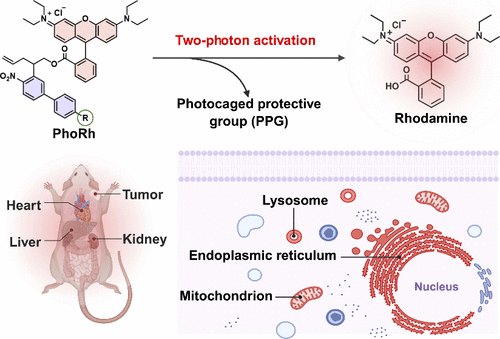
在生物成像领域,如何实现对细胞器的精准定位与深层组织的高分辨率观察,一直是科研人员面临的挑战。近日,《美国化学会志》(JACS)发表了一项前沿研究,报道了三种新型双光子激活荧光探针(PAFs),可用于线粒体、内质网和溶酶体的特异性成像,并成功实现了活细胞、离体组织乃至活体肿瘤的三维成像,成像深度突破100微米 1。
🌟研究亮点:三种器官靶向探针,双光子激活,低毒高亮
本研究由深圳清华研究院与深圳职业技术大学联合完成,设计了一系列基于4-硝基联苯光敏保护基的荧光探针,分别命名为:
- PhoRh-Mito:靶向线粒体
- PhoRh-ER:靶向内质网
- PhoRh-Lyso:靶向溶酶体
- PhoRh:非靶向对照探针
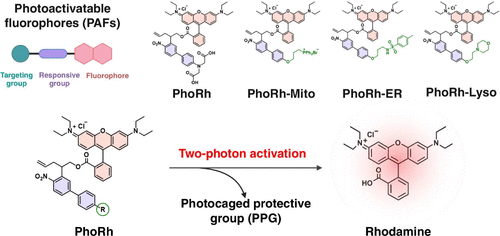 这些探针在未激活状态下几乎无荧光,激光照射后可迅速释放荧光团,实现“开关式”成像。其优势包括:
这些探针在未激活状态下几乎无荧光,激光照射后可迅速释放荧光团,实现“开关式”成像。其优势包括:
- 高亮度与光稳定性
- 一光子与双光子激活兼容
- 低细胞毒性(HeLa细胞存活率 >95%)
- 快速膜渗透与器官定位(3分钟内完成)
🧬机制解析:双光子激活实现深层成像与单细胞控制
传统荧光探针多依赖紫外激活,存在光毒性强、组织穿透力差等问题。该研究采用双光子激活技术,使用800 nm激光实现探针的局部激活,具备以下优势:
- 激发光波长长,组织穿透力强
- 激活区域限于焦点体积,空间分辨率高
- 减少背景荧光与自发荧光干扰
实验显示,PhoRh探针在双光子激活下荧光增强达11.8倍,且可实现单细胞级别的选择性激活,适用于异质性细胞群体的动态追踪。 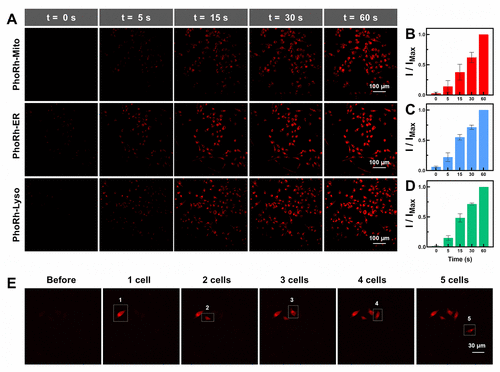
🧪细胞实验:三种探针精准定位,共定位系数高达0.96
通过共定位实验,研究团队验证了三种探针在HeLa细胞中的器官特异性:
- PhoRh-Mito与MitoTracker Green共定位系数达0.94
- PhoRh-ER与ER-Tracker Green共定位系数达0.94
- PhoRh-Lyso与LysoTracker Green共定位系数达0.96
此外,探针在激活后30分钟内的定位稳定性也有所差异:
- PhoRh-Mito定位稳定性最高(R值保持在0.95)
- PhoRh-ER略有下降(R值从0.89降至0.86)
- PhoRh-Lyso定位逐渐丧失(R值从0.94降至0.80)
这种差异与细胞器的膜电位、pH值及脂质组成密切相关,提示未来探针设计需考虑微环境适配性。 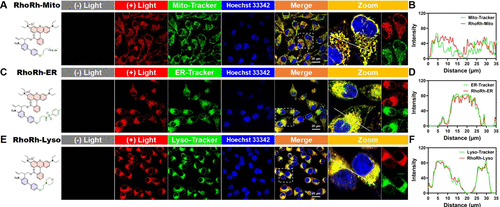
🧫组织成像:成像深度达100微米,揭示原位线粒体结构
在小鼠肝脏、肾脏与心肌组织中,PhoRh-Mito探针展现出卓越的深层成像能力:
- 一光子成像穿透深度仅约10微米
- 双光子成像穿透深度达100微米
- 可清晰观察线粒体网络的动态变化
这一突破为原位器官成像提供了新工具,尤其适用于高代谢器官的功能研究。 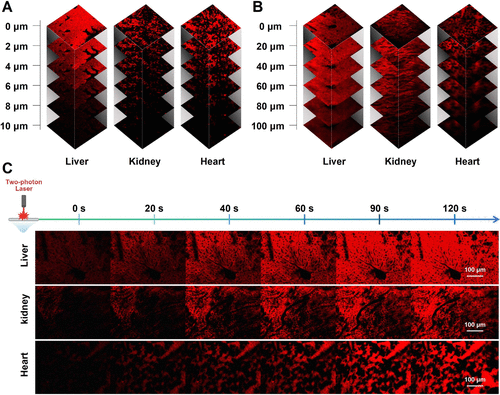
🐁活体成像:肿瘤组织三维重建,分辨率高,背景低
研究进一步在小鼠皮下肿瘤模型中验证了PhoRh-Mito的活体成像性能:
- 注射后可实现肿瘤区域的均匀荧光分布
- 成像深度达160微米,分层间隔仅2微米
- 可清晰分辨细胞边界、细胞间界面与微血管结构
相比传统单光子成像,双光子技术在空间分辨率与组织穿透力方面均表现优异,适合用于肿瘤微环境研究与药物递送监测。 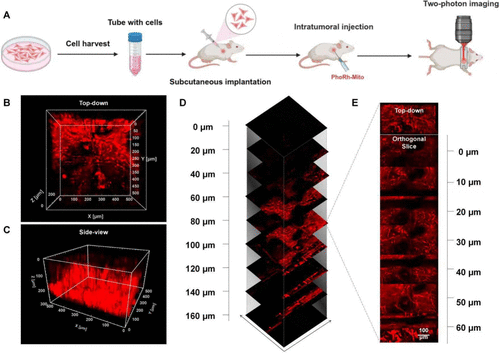
🔮未来展望:超分辨成像与药物共封装的潜力
该系列探针不仅适用于常规成像,还具备以下潜力:
- 超分辨成像:可用于PALM等技术,实现亚细胞器结构观察
- 双重光控探针:结合识别基团,实现激活与靶向双重控制
- 药物共封装:与治疗分子共同递送,实现可视化药物释放
这些应用前景使PhoRh系列探针成为研究细胞器动态、疾病机制与精准治疗的理想工具。
📌结语:双光子探针开启器官成像新纪元
本研究首次系统性地开发了三种器官靶向的双光子激活荧光探针,兼具高亮度、低毒性与深层成像能力,填补了活体组织器官成像的技术空白。随着探针设计的不断优化,其在生物医学研究、临床诊断与药物开发中的应用将愈加广泛。