【JACS】30分钟直达视网膜:葡萄糖驱动超小型趋化纳米机器人延缓退化新突破
文章标题:Glucose-Powered Ultrasmall Chemotactic Nanorobots for Retinal Degeneration Treatment
通讯作者:Martin Pumera
文章链接:https://doi.org/10.1021/jacs.5c15651
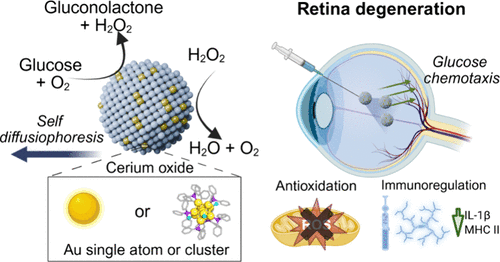
文章概要
疾病背景与挑战
视网膜退行性疾病(如年龄相关性黄斑变性 AMD 和糖尿病性视网膜病变)影响全球数亿人,预计到2040年仅AMD患者就将达到2.88亿。现有治疗方式主要依赖玻璃体腔内注射抗VEGF药物或抗氧化剂补充,但玻璃体是一种致密的凝胶状屏障,严重限制药物扩散,导致疗效有限且伴随风险。炎症与氧化应激被认为是疾病进展的重要驱动因素,尤其是小胶质细胞的过度激活会加速光感受器和视网膜色素上皮的损伤。因此,突破玻璃体屏障并实现高效药物递送成为亟待解决的难题。
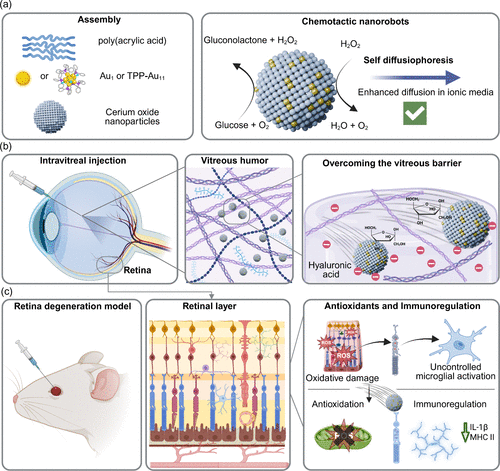
创新设计理念
本研究提出了一种基于单原子工程的超小型化学趋化纳米机器人,尺寸小于10纳米。其核心原理是利用金单原子或金团簇催化葡萄糖氧化反应,产生机械推进力,从而在玻璃体内实现主动运动。研究团队将金原子或金团簇锚定在聚丙烯酸修饰的氧化铈纳米颗粒上,形成兼具催化活性与生物相容性的复合结构。氧化铈不仅能分解反应副产物过氧化氢,还具备抗氧化与免疫调节功能,为纳米机器人赋予双重治疗潜力。
结构与性能表征
研究通过高分辨透射电子显微镜、紫外-可见光谱、X射线光电子能谱等方法确认了金团簇与氧化铈的结合状态。结果显示,Au11团簇稳定性高,催化效率优于单原子金。纳米机器人在葡萄糖存在下表现出显著的自扩散与趋化行为:在生理浓度下运动速度提升约两倍,并能在微流控通道中沿葡萄糖浓度梯度定向迁移。
玻璃体与细胞实验
在模拟玻璃体的透明质酸溶液中,纳米机器人展现出明显的葡萄糖依赖性扩散增强,最高提升达36%。在体外细胞实验中,纳米机器人可快速进入细胞并与溶酶体共定位,部分Au11团簇甚至显示出线粒体靶向潜力。进一步在离体猪眼模型中,纳米机器人在30分钟内即可穿越玻璃体到达视网膜层,效率远超传统被动扩散方式。
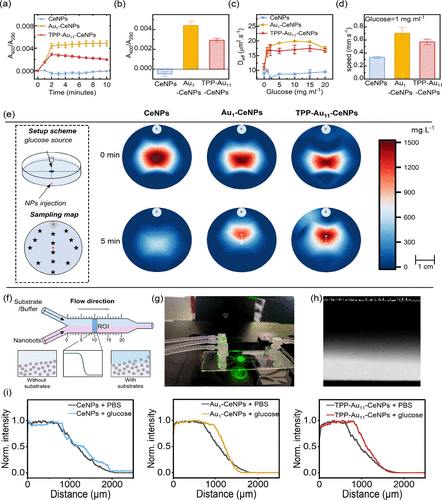
动物模型验证
在健康小鼠体内,纳米机器人通过玻璃体注射后能在视网膜细胞中实现剂量依赖性渗透,且未观察到明显毒性或免疫反应。相比对照组,Au基纳米机器人在视网膜细胞中的摄取率更高。在视网膜退化模型中,纳米机器人渗透率提升至约1%,并表现出更强的治疗效果:
- Au单原子纳米机器人:主要抑制炎症相关基因(GFAP、Galectin-3)。
- Au11团簇纳米机器人:显著提升视紫红质表达,保护光感受器,同时下调炎症与氧化应激标志物。
- CeNPs对照组:主要降低促凋亡基因Bax。
免疫调节作用
进一步的体外免疫细胞实验表明,纳米机器人可被骨髓来源的CD11b+CD45+细胞吞噬,并在不影响细胞活性的情况下调控其功能。它们能下调IL-1β、TNF-α和VEGF等关键炎症与血管生成因子,同时抑制MHC II分子和一氧化氮的产生,从而避免过度免疫激活。这一发现凸显了纳米机器人在维持视网膜免疫稳态方面的潜力。
结论与展望
该研究首次在动物模型中验证了葡萄糖驱动的超小型化学趋化纳米机器人能够自主穿越玻璃体屏障并到达视网膜,不仅作为药物递送平台,还能直接发挥抗氧化与免疫调节作用。其超小尺寸使其进入“准分子药物”范畴,减少免疫识别并提升组织穿透力。与依赖外部磁场或光驱动的微机器人相比,这种自主推进系统更具临床可行性与安全性。未来研究需进一步评估其长期分布、降解与安全性,但该成果已为非侵入性眼科治疗开辟了新路径。
综上,本研究展示了单原子工程与纳米机器人技术结合的巨大潜力,为视网膜退行性疾病的精准治疗提供了突破性思路。