【JACS】一键突破革兰阴性菌屏障!单一喹啉修饰让万古霉素抗菌谱拓展至2类超级细菌
文章标题:Unanticipated Quinoline Modification on Vancomycin as an Effective Strategy to Alter the Antibacterial Profile and Combat Multidrug Resistance 通讯作者:Jinyong Zhang, Dongliang Guan 文章链接:https://doi.org/10.1021/jacs.5c14268
文章概要
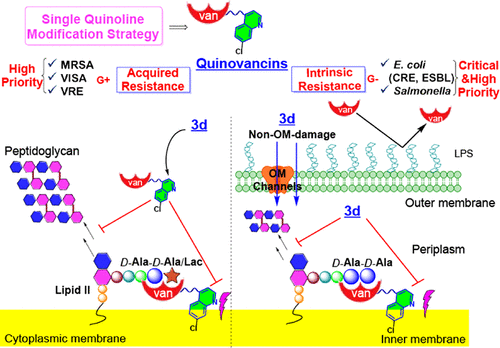
抗菌药物耐药性(AMR)正迅速演变为全球公共卫生的重大威胁,预计到2050年将导致超过1000万人死亡。其中,革兰氏阴性菌如大肠杆菌(E. coli)和沙门氏菌(Salmonella)因其外膜屏障对多种抗生素天然耐药,成为抗感染治疗中的“硬骨头”。而万古霉素,作为治疗革兰氏阳性菌感染的“最后防线”,却因无法穿透革兰氏阴性菌的外膜而对其无效。本文报道了一项突破性发现:通过在万古霉素分子上引入一个简单的喹啉基团,研究人员意外地获得了一类新型衍生物“喹万素”(quinovancins),不仅恢复了对耐药革兰氏阳性菌的活性,还首次实现了对部分革兰氏阴性菌的有效杀菌,开辟了抗菌药物再开发的新路径。
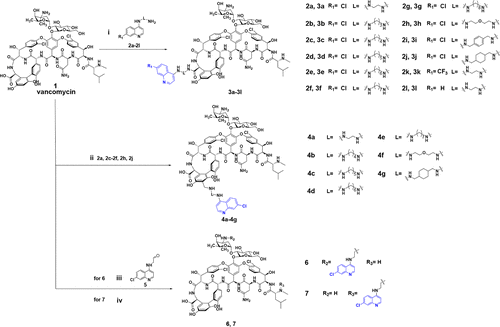
研究团队以临床常用抗疟药氯喹中的4-氨基-7-氯喹啉片段为基础,分别将其连接至万古霉素的四个不同位点(C-末端、R-位点、V-位点和N-末端),系统构建了多个喹啉修饰衍生物。通过多种合成策略(酰胺缩合、Mannich反应、还原胺化等),成功获得了结构多样、合成简便、水溶性良好的喹万素系列化合物。
在体外抗菌活性测试中,喹万素对多种耐药革兰氏阳性菌(如MRSA、VISA、VRE)表现出显著增强的抑菌效果,最低MIC值可达原始万古霉素的1/128。其中,C-末端修饰的3d化合物表现最为优异。更令人惊喜的是,3d对天然耐药的大肠杆菌和沙门氏菌也展现出前所未有的活性,MIC值低至4–8 μg/mL,远优于万古霉素(MIC ≥ 128 μg/mL),甚至在某些菌株中优于多粘菌素E和环丙沙星等临床常用药物。对比实验表明,若将喹啉换为萘环,则完全丧失对革兰氏阴性菌的活性,凸显喹啉结构中氮原子的关键作用。
机制研究显示,喹万素在革兰氏阳性菌中通过“细胞壁-膜双重抑制”机制克服获得性耐药;而在革兰氏阴性菌中,喹啉基团则充当“穿膜穿梭器”,协助万古霉素跨越外膜屏障到达Lipid II靶点,且不破坏外膜完整性,区别于传统的膜破坏型抗生素。电子显微镜观察证实,3d处理后大肠杆菌细胞形态严重畸变,细胞壁结构受损,胞质外泄,提示其通过抑制Lipid II合成导致细胞裂解死亡。
在体内药效和安全性评估中,3d表现出良好的药代动力学特性(半衰期5.47小时,AUC为万古霉素的41倍),低细胞毒性和极低溶血率(<2%),小鼠单剂量耐受性高达70 mg/kg。小鼠感染模型进一步验证了其卓越的体内疗效:在MRSA致死模型中,3d单剂量治疗使小鼠100%存活,而万古霉素仅为20%;在CRE(碳青霉烯耐药大肠杆菌)感染模型中,3d显著降低肾脏和肺部细菌负载,优于万古霉素。
综上所述,本研究首次揭示了单一喹啉修饰即可显著拓展万古霉素抗菌谱的现象,尤其在对革兰氏阴性菌的活性提升方面具有里程碑意义。喹万素3d不仅在体内外均展现出优异的抗菌活性和药物特性,还具备快速合成、结构简洁、安全性高等优势,为老药新用提供了全新策略,也为应对多重耐药菌感染提供了有力武器。该研究为糖肽类抗生素的再开发打开了新思路,具有重要的科学价值和临床转化潜力。