【JACS】精准癌症治疗新突破:双功能生物正交平台实现 2 种蛋白降解与影像引导
文章标题:A Versatile Bioorthogonal Theranostic Platform Enables Relay Activation of Tumor Cell Imaging and Targeted Protein Degradation
通讯作者:Qiumeng Zhang, Yi Chen, Xuan Zhang
文章链接:https://doi.org/10.1021/jacs.5c11564
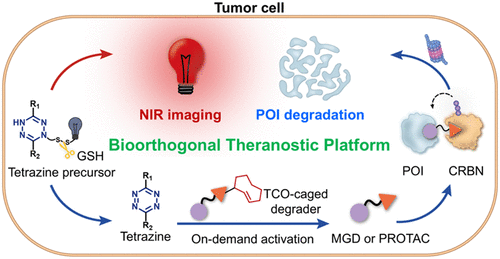
文章概要
背景与挑战
近年来,靶向蛋白降解(Targeted Protein Degradation, TPD)作为新型药物研发策略,凭借分子胶(MGDs)与蛋白酶体靶向嵌合体(PROTACs)的出现,成功突破了“不可成药”靶点的限制。然而,传统系统给药方式常导致健康组织中目标蛋白的意外降解,产生严重的“靶向但非肿瘤组织”毒性。这一问题成为临床转化的最大障碍。因此,如何在肿瘤组织内实现精准、可控的蛋白降解,同时兼顾诊断与治疗功能,成为亟待解决的科学难题。
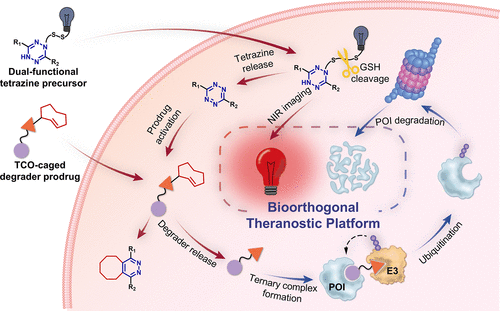
创新平台设计
本研究团队提出了一种全新的双功能生物正交治疗诊断平台,核心分子为 XZ2223。该分子通过谷胱甘肽(GSH)敏感的二硫键连接结构,实现了以下两大功能:
- 肿瘤细胞成像:释放近红外(NIR)荧光探针 CyNH₂,用于实时标记癌细胞。
- 蛋白降解激活:同时释放四嗪(tetrazine),触发与反式环辛烯(TCO)封装的降解剂前药发生逆电子需求 Diels–Alder (IEDDA) 反应,恢复其活性。
该平台可同时激活两类前药:
- Pro-CC-885:针对 GSPT1 的分子胶降解剂。
- Pro-dBET6:针对 BET 家族蛋白的 PROTAC 降解剂。
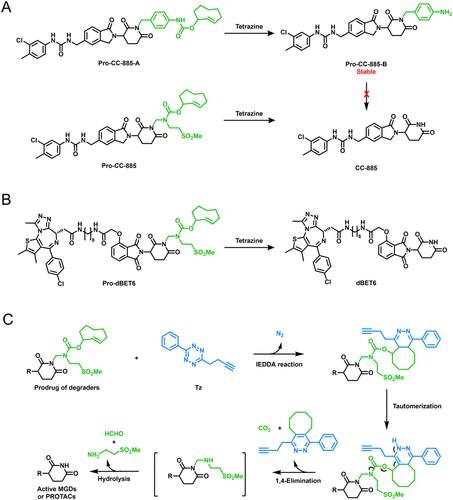
体外实验结果
在肺癌细胞 A549 与肝癌细胞 Huh-7 的实验中,XZ2223表现出以下特性:
- 成像效果:在肿瘤细胞中,XZ2223被高水平 GSH 激活,产生强烈的近红外荧光信号,而在正常细胞(如 MRC-9 纤维母细胞)中信号极弱,显示出良好的选择性。
- 蛋白降解:Pro-CC-885 与 Pro-dBET6单独使用时无活性,但在XZ2223存在下可迅速恢复降解能力,分别有效降低 GSPT1 与 BET 蛋白水平。
- 机制验证:降解过程依赖于泛素-蛋白酶体系统(UPS),通过抑制剂阻断实验得到确认。
- 细胞毒性:激活后的前药在肿瘤细胞中表现出与母药相当的杀伤力,而在正常细胞中毒性显著降低。
动物模型验证
在小鼠异种移植瘤模型中,研究团队采用 肿瘤内注射 XZ2223 与 腹腔注射前药 的联合策略,取得了以下成果:
- 肿瘤成像:XZ2223在肿瘤部位产生强烈且持久的荧光信号,几乎不在心脏、肝脏、肾脏等器官中出现。
- 蛋白降解:与XZ2223联合给药的前药在肿瘤组织中实现了显著的 GSPT1 与 BET 蛋白降解。
- 抗肿瘤疗效:XZ2223与Pro-dBET6联合治疗显著抑制肿瘤生长,疗效优于单独使用母药 dBET6,同时避免了体重下降等系统性毒性。
平台优势与未来展望
该平台的最大优势在于 诊断与治疗的双重功能整合:
- 通过影像实时监测药物激活过程,确保精准定位。
- 通过生物正交反应实现前药的“按需释放”,显著降低健康组织毒性。
未来优化方向包括:
- 影像升级:从 NIR-I(650–900 nm)过渡到 NIR-II(1000–1700 nm),以提升组织穿透力与成像分辨率。
- 特异性增强:利用四嗪衍生物上的炔基位点,进一步偶联抗体或小分子配体,实现更高的肿瘤选择性。
- 临床转化:需系统优化药代动力学特性,确保药物在体内的稳定性与靶向性。
总结
本研究首次提出了一种 可同时实现肿瘤成像与靶向蛋白降解的生物正交平台。通过 GSH 响应性触发机制,XZ2223成功激活两类前药,展现出强大的抗肿瘤潜力与良好的安全性。这一策略不仅拓宽了靶向蛋白降解的应用范围,也为精准肿瘤治疗提供了新的思路。未来,该平台有望发展为临床可用的影像引导型治疗工具,推动精准医学的进一步落地。