【JMC】ROR1靶向影像学新突破:5种18F/68Ga标记肽探针的系统研究
文章标题:18F-/68Ga-Labeled Peptide-Based Probes for PET Imaging of ROR1 Expression
通讯作者:Hongwu Liu, Zhide Guo
文章链接:https://doi.org/10.1021/acs.jmedchem.5c02016
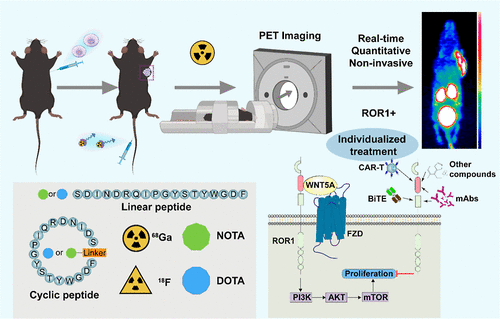
文章概要
背景与研究意义
受体酪氨酸激酶样孤儿受体1(ROR1)在正常成人组织中几乎不表达,但在多种血液系统和实体瘤中高水平表达,包括慢性淋巴细胞白血病、黑色素瘤、肺腺癌、乳腺癌、肝细胞癌和结直肠癌等。其高表达与不良预后密切相关,因此被视为理想的肿瘤靶点。近年来,针对ROR1的治疗策略如小分子抑制剂、单克隆抗体、抗体偶联药物、CAR-T细胞和双特异性T细胞连接器等均取得了积极进展。然而,如何实时、定量地监测患者体内ROR1的表达仍是临床亟待解决的问题。传统的组织学和免疫组化方法依赖侵入性取材,且无法反映肿瘤异质性和动态变化。正电子发射断层扫描(PET)作为一种高灵敏度的分子影像学手段,为非侵入性监测ROR1提供了可能。
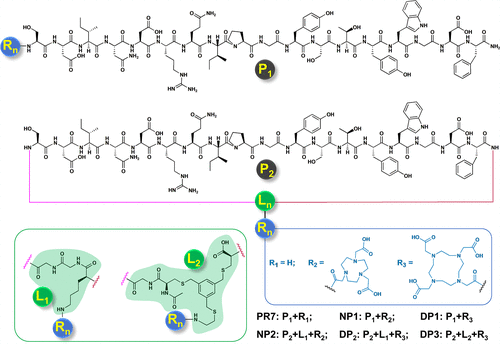
探针设计与合成
研究团队基于已知的ROR1靶向肽PR7,设计并合成了五种线性与环状结构的肽前体:DP1、DP2、DP3、NP1和NP2,并分别标记为[^68Ga]Ga-DP1、[^68Ga]Ga-DP2、[^68Ga]Ga-DP3、[^18F]AlF-NP1和[^18F]AlF-NP2。所有探针均表现出较高的放化纯度(>90%)和良好的水溶性。合成过程中,研究者采用DOTA或NOTA螯合剂进行标记,最终产率和摩尔活度均处于理想范围。稳定性实验显示,这些探针在生理条件下具有良好的稳定性。
分子对接与体外实验
通过分子对接分析,研究者发现不同结构修饰影响探针与ROR1结合的氢键数量和结合能。DP1和NP1表现出更高的结合亲和力,与细胞摄取实验结果一致。在MC38结肠癌细胞中,[^68Ga]Ga-DP1和[^18F]AlF-NP1的摄取率显著高于其他探针,并且在阻断实验中可被PR7有效抑制,证明其特异性。饱和结合实验进一步显示,DP1和NP1的解离常数(K_D)较低,提示其与ROR1结合更紧密。
动物模型中的PET成像
在多种肿瘤荷瘤小鼠模型中,PET成像结果显示[^68Ga]Ga-DP1和[^18F]AlF-NP1在肿瘤组织中有较高的摄取和良好的靶/非靶比。尤其在MC38模型中,这两种探针的肿瘤摄取明显高于低ROR1表达的B16F10黑色素瘤模型。阻断实验进一步证实了其特异性。值得注意的是,[^68Ga]Ga-DP1和[^18F]AlF-NP1在肾脏中有较高的摄取,提示未来需优化结构以降低潜在肾毒性。
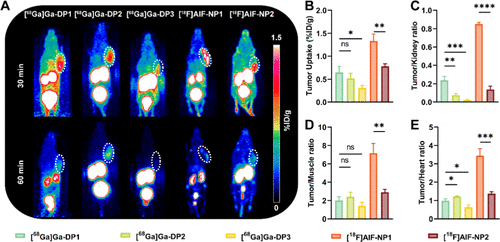
生物分布与代谢稳定性
在体内分布实验中,两种优势探针主要在肿瘤、血液和肾脏中积聚,且在肌肉和心脏等非靶组织中背景信号较低,显示出良好的成像对比度。然而,[^18F]AlF-NP1在体内代谢较快,稳定性不足,提示未来需通过结构修饰提高其抗酶降解能力。
转录组学分析与机制探索
研究者通过转录组学分析发现,PR7处理的MC38肿瘤中有396个差异表达基因,其中117个上调,279个下调。差异基因富集于PI3K/AKT、IL-17、TNF等信号通路,提示ROR1可能通过激活AKT促进肿瘤细胞增殖并抑制凋亡。这一发现为ROR1靶向治疗的机制研究提供了新的证据。
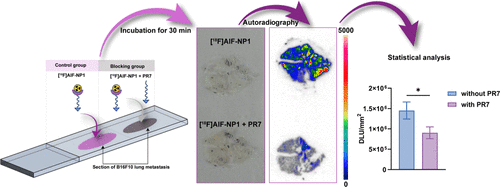
讨论与临床前景
相比抗体类影像剂,肽类探针具有分子量小、肿瘤穿透力强、清除速度快等优势,更适合实体瘤的成像。研究结果表明,[^68Ga]Ga-DP1和[^18F]AlF-NP1在多种肿瘤模型中均表现出良好的成像性能和特异性,尤其在黑色素瘤转移灶中能够清晰显示病灶。与传统的[^18F]FDG相比,这些探针在脑和心脏等高背景组织中信号较低,成像对比度更佳。未来,这些探针有望作为临床诊断和疗效监测的补充工具,并为个体化治疗提供依据。
结论
本研究成功开发了五种新型ROR1靶向PET探针,其中[^68Ga]Ga-DP1和[^18F]AlF-NP1在体外和体内实验中表现最为突出,显示出优异的肿瘤靶向能力和成像性能。尽管仍存在代谢稳定性和肾脏高摄取等问题,但该系列探针为ROR1靶向影像学和个体化癌症治疗提供了新的可能性。未来通过结构优化和临床转化研究,这些探针有望成为精准肿瘤诊疗的重要工具。