【Angew.Chem.】化学动力疗法的前沿突破:从芬顿化学到自由基驱动的生物应用
文章标题:The Expanding Horizons of Chemodynamic Therapy: From Fenton Chemistry to Radical‐Driven Biological Applications
通讯作者:Prof. Wenbo Bu
文章链接:https://doi.org/10.1002/anie.202522670
文章概要
引言
恶性肿瘤长期以来威胁人类健康,如何开发高效、低毒且具肿瘤特异性的治疗策略一直是生物医学的核心目标。自2016年芬顿化学被引入生物医学以来,化学动力疗法(Chemodynamic Therapy, CDT)迅速发展为跨学科研究的前沿领域。其核心机制是利用铁基或铜基纳米材料在肿瘤微环境(酸性且富含过氧化氢)中触发芬顿反应,生成高活性的羟基自由基(·OH),从而选择性杀伤肿瘤细胞。短短不到十年,CDT已成为纳米医学的重要分支,并不断拓展应用范围。
化学动力过程的优化
1. 电子态调控
研究者通过调控反应中心的电子态来提升·OH的生成效率。例如,银掺杂的ZnSe量子点在超声作用下促进电子转移,增强Fe³⁺/Fe²⁺循环;放射性核素¹²⁵I标记的MIL-88B Fe-MOF通过辐射产生水合电子,加速Fe³⁺还原;CeO₂纳米棒负载单原子Pt显著提升·OH产量。这些策略均突破了芬顿反应速率受限的瓶颈。
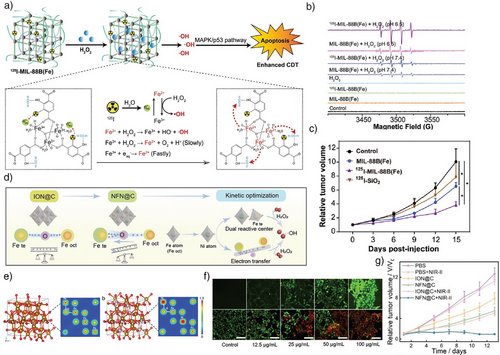
2. 局域电子密度调控
通过异质原子掺杂或分子设计改变Fe离子的局域电子密度,可有效提升反应速率。例如,Mn掺杂的磷化物纳米颗粒提高了H₂O₂亲和力,Ni掺杂的Fe₃O₄形成NiFe₂O₄结构,显著加快水分子解吸过程,增强·OH生成。
3. 新型反应中心设计
除了传统的过渡金属,研究者还探索了非金属或金属氧化物反应中心,如含氧空位的钛酸盐或多金属氧酸盐(POM),均展现出优异的CDT活性。这些新材料不仅提升了安全性,也为临床转化提供了可能。
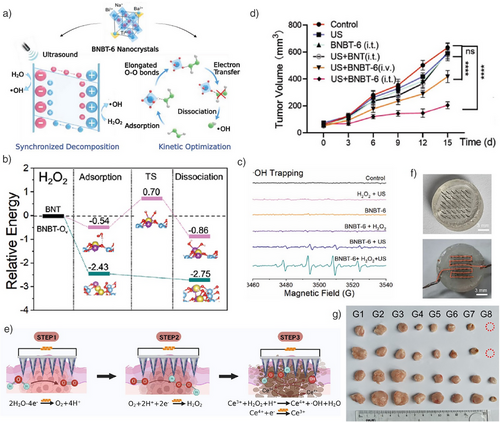
4. 反应环境优化
通过调控细胞内H₂O₂水平、pH值和谷胱甘肽浓度,进一步提高CDT效率。例如,利用纳米酶催化生成H₂O₂,或通过葡萄糖氧化酶降低细胞内pH,均能显著增强芬顿反应。
生物动力过程与细胞死亡机制
CDT不仅诱导传统的凋亡,还能触发多种受调控的细胞死亡模式:
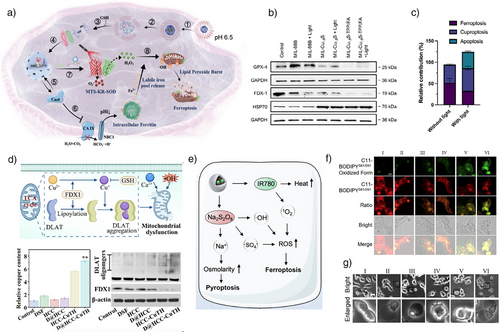
- 铁死亡(Ferroptosis):由脂质过氧化驱动,伴随GPX4失活。
- 铜死亡(Cuproptosis):由铜离子与线粒体TCA循环蛋白结合引发。
- 焦亡(Pyroptosis):通过气体dermin介导的膜孔形成,导致细胞裂解。
- 免疫原性细胞死亡(ICD):释放ATP、HMGB1等信号分子,激活免疫系统。
这些机制不仅拓展了CDT的生物学内涵,也为联合免疫治疗提供了新思路。
亚细胞靶点与器官互作
研究发现,·OH的作用半径极短,因此其效应依赖于亚细胞定位:
- 溶酶体:酸性环境加速金属离子循环,触发膜通透性变化。

- 线粒体:局部·OH破坏电子传递链,引发能量崩溃。
- 内质网:氧化应激加剧蛋白折叠压力,诱导细胞死亡。
- 质膜与核糖体:脂质过氧化和蛋白合成障碍成为新靶点。
此外,器官间的互作(如溶酶体与内质网的串扰)也成为CDT放大效应的重要机制。
新兴应用领域
CDT的应用已超越肿瘤治疗:
- 抗菌:通过·OH破坏细菌膜和生物膜,突破耐药屏障。
- 伤口愈合:调控ROS生成促进血管新生和胶原沉积,加速慢性伤口修复。
- 免疫调控:诱导免疫原性死亡,重塑肿瘤免疫微环境,增强免疫治疗效果。
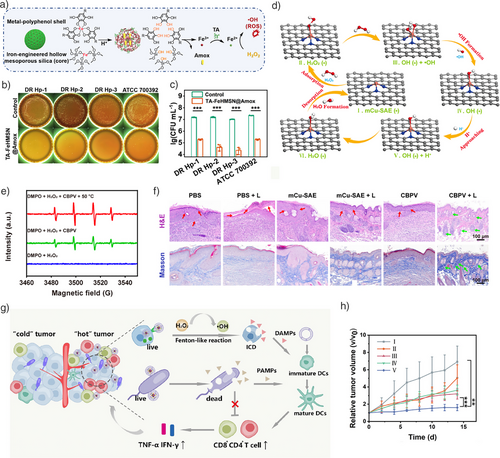
总结与展望
CDT在不到十年的时间里已形成完整的理论框架和多尺度应用平台。未来研究方向包括:
- 精准调控反应动力学,实现可编程自由基生成。
- 建立实时监测体系,量化自由基生成与生物效应。
- 探索更多亚细胞靶点与新型机制。
- 与人工智能结合,实现个体化精准治疗。
- 推动临床转化,尤其在浅表肿瘤、慢性伤口和感染治疗中展现潜力。
总体而言,CDT不仅是纳米医学的重要突破,更是跨越化学、生物学与临床医学的桥梁。它通过对自由基的精细调控,正在为癌症治疗、抗感染和组织再生开辟全新的道路。