【JACS】突破95%对映选择性!构建24种轴手性茚类配体的新策略
文章标题: Atropisomeric Indene (AroInd) Libraries: Design, Catalytic Synthesis, and Applications 通讯作者: Zhuangzhi Shi 文章链接: https://doi.org/10.1021/jacs.5c13866
文章概要
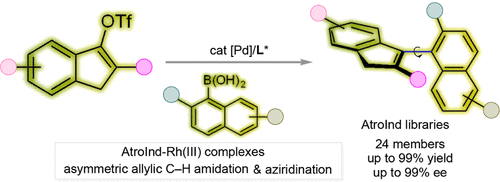
茚类金属配体因其独特的电子结构和“茚效应”在过渡金属催化中展现出巨大潜力,然而其手性版本的合成长期受限于复杂的多步合成和低效率的拆分方法。本文由南京大学石庄志教授团队发表于《美国化学会志》,提出了一种高效构建轴手性茚类配体(AtroInds)的新策略,成功建立了一个包含24种结构多样的AtroInds配体库,并展示了其在不对称催化中的卓越性能。
研究背景与挑战
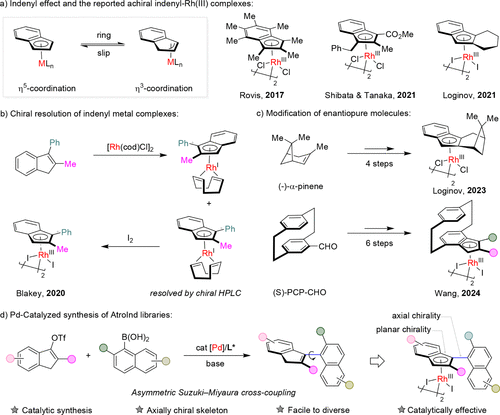
传统的茚类配体由于其Cp环与苯环共轭结构,具有独特的η⁵/η³配位模式转换能力,但在Rh(III)等晚期过渡金属中,未修饰的茚配体易于解离,导致催化活性低下。尽管已有研究通过手性拆分或天然产物改造获得手性茚配体,但这些方法普遍存在步骤繁琐、产率低、结构选择性差等问题,亟需一种通用、高效的合成策略。
创新策略:轴手性设计 + Suzuki-Miyaura偶联
作者巧妙地引入轴手性设计理念,通过在茚环的邻位引入非共面取代基,限制其旋转自由度,从而赋予分子轴手性。采用不对称Suzuki–Miyaura交叉偶联反应,以茚基三氟甲磺酸酯为底物,与萘基硼酸类进行偶联,使用PdCl₂·L6手性催化剂体系,在室温下实现高效构建AtroInds骨架。
- 反应优化中,PdCl₂·L6催化剂在甲苯/水体系中表现最佳,产率达83%,对映选择性高达95%。
- 温度对反应影响显著,低温(0°C)可进一步提升对映选择性至99%,但产率略降。
- 通过底物拓展,成功合成了24种AtroInds,涵盖多种烷基、芳基、醚基等取代基,展现出良好的官能团兼容性。
配体稳定性与结构验证
所构建的AtroInds在100°C加热84小时后无消旋现象,显示出优异的构型稳定性。进一步与Rh源配位,制备出四种Rh(III)茚配体复合物,并通过X射线单晶衍射确认其绝对构型。
催化应用:C–H胺化与氮化环丙烷构建
作者将AtroInd–Rh(III)复合物应用于两类典型不对称反应:
烯烃的C–H胺化反应
- 使用[Rh(Ind6)I₂]₂催化辛烯与对硝基苯磺酰胺反应,产率达97%,对映选择性94%。
- 适用于多种烯烃底物及磺酰胺类,展现广泛底物适应性。
不对称氮化反应构建氮杂环丙烷
- 使用[Rh(Ind6)I₂]₂与氮源试剂反应,成功构建氮杂环丙烷结构,ee值高达93%。
理论计算揭示反应机理
通过密度泛函理论(DFT)计算,作者深入解析了Suzuki–Miyaura反应的关键步骤:
- 氧化加成步骤能垒为11.2 kcal/mol;
- 转金属化步骤为控制对映选择性的关键,磷酸盐与氢氧根形成的“ate”复合物可显著降低能垒;
- 最终还原消除步骤为速率决定步骤,能垒为23.4 kcal/mol;
- π–π堆积作用在转金属化过渡态中起稳定作用,促进S-构型产物生成。
总结与展望
本研究首次实现了轴手性茚类配体的模块化构建,建立了一个结构多样、性能优异的AtroInds配体库,并展示了其在不对称C–H胺化与氮化反应中的广泛应用。该策略不仅解决了手性茚配体合成的瓶颈,也为未来手性配体设计提供了新范式,预示着在不对称催化领域的广泛潜力。
这项工作为配体工程和催化科学提供了重要突破,值得在有机合成、药物化学和材料科学领域进一步探索与应用。