【Biomaterials】5 大亮点解读:一种可激活的一体化光动力免疫治疗平台如何突破肿瘤缺氧难题?
文章标题: All-in-one molecular design of activatable phototheranostic platform for potent hypoxia-tolerant photodynamic immunotherapy of cancer
通讯作者: Jianli Li
文章链接: https://doi.org/10.1016/j.biomaterials.2025.123900
文章概要
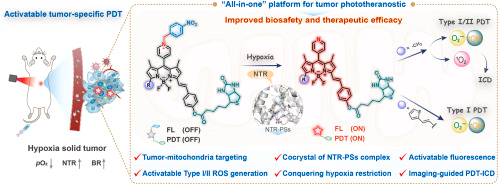
光动力治疗(Photodynamic Therapy, PDT)作为一种新兴的肿瘤治疗方式,因其微创、高选择性等优势而备受关注。然而,传统的 II 型光敏剂高度依赖氧气,在肿瘤普遍存在的缺氧微环境中疗效显著下降。此外,光敏剂在体内的靶向性不足,也限制了其临床应用潜力。针对这些关键瓶颈,本文作者提出了一种创新性的一体化分子设计策略,构建了一个可激活、可成像、可治疗的光诊疗平台 NO₂/BDP-BT,并进一步拓展为适用于严重缺氧环境的 I 型光敏剂 NO₂/BDPS-BT,为未来精准肿瘤治疗提供了新的解决方案。
一、研究背景:缺氧肿瘤微环境是 PDT 的最大障碍
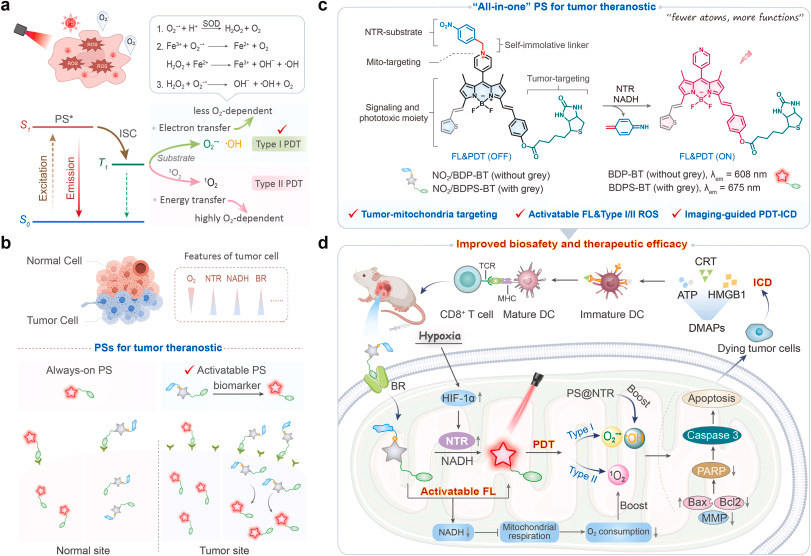
肿瘤组织由于血管结构异常,常处于持续缺氧状态,而传统 II 型 PDT 依赖氧气生成单线态氧(¹O₂),因此在缺氧条件下疗效显著受限。与此同时,光敏剂在体内的非特异性分布可能导致正常组织损伤,降低治疗安全性。研究者亟需一种能够在缺氧环境中仍保持高效 ROS 生成能力,并具备精准靶向性的光敏剂。
本文提出的 NO₂/BDP-BT 平台正是为解决这两个核心难题而设计:
一是通过 NTR(硝基还原酶)激活机制实现“肿瘤特异性启动”;
二是通过一体化结构实现“靶向 + 成像 + 治疗”三位一体的功能整合。
二、创新设计:一体化策略构建可激活光诊疗平台
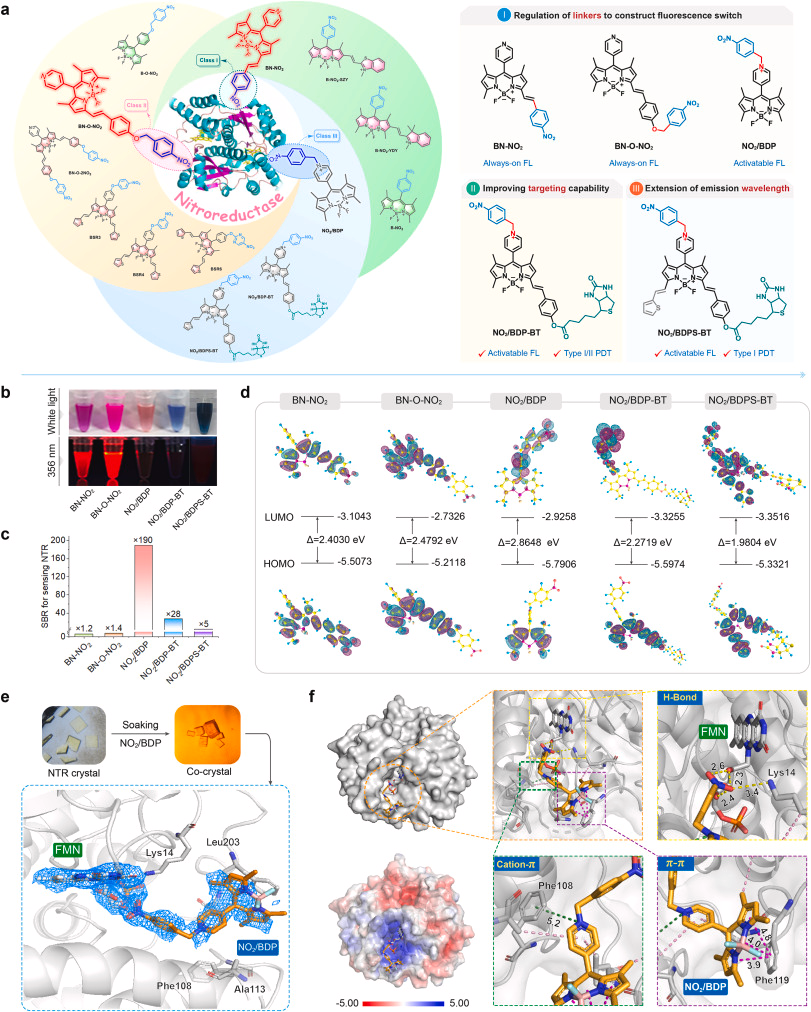
研究团队采用“原子经济性”的 all-in-one 分子设计策略,将多种功能模块整合到单一分子中,使 NO₂/BDP-BT 同时具备以下特性:
肿瘤细胞器靶向能力
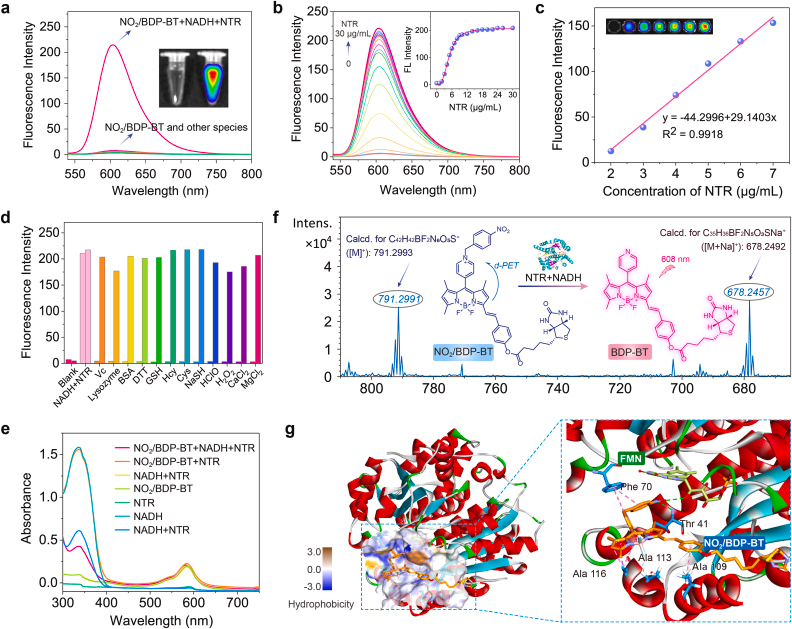
分子结构经过精确调控,可主动富集于肿瘤细胞特定细胞器(如线粒体),提高治疗精准度。NTR 激活的荧光增强
肿瘤细胞中高表达的 NTR 可特异性还原分子中的 NO₂ 基团,使光敏剂从“关闭”状态转变为“开启”状态,实现肿瘤特异性成像。I/II 型 ROS 双通道生成
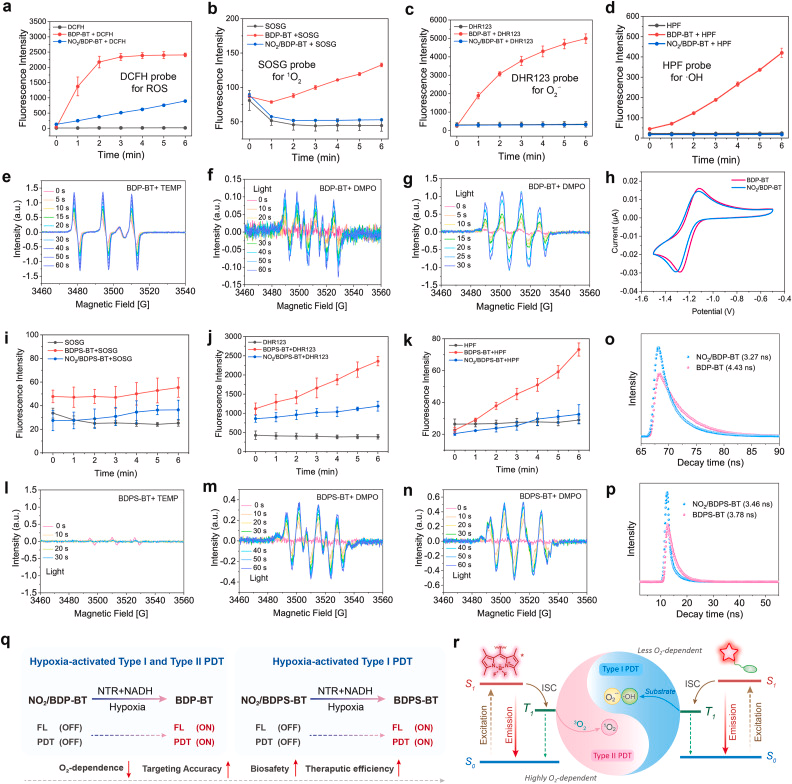
激活后的 NO₂/BDP-BT 可同时产生 I 型与 II 型 ROS,显著提升在缺氧环境中的治疗效果。
这种一体化策略不仅减少了分子设计的复杂性,也提高了光敏剂的稳定性与生物相容性。
三、突破性成果:缺氧条件下依然实现强效抗肿瘤作用
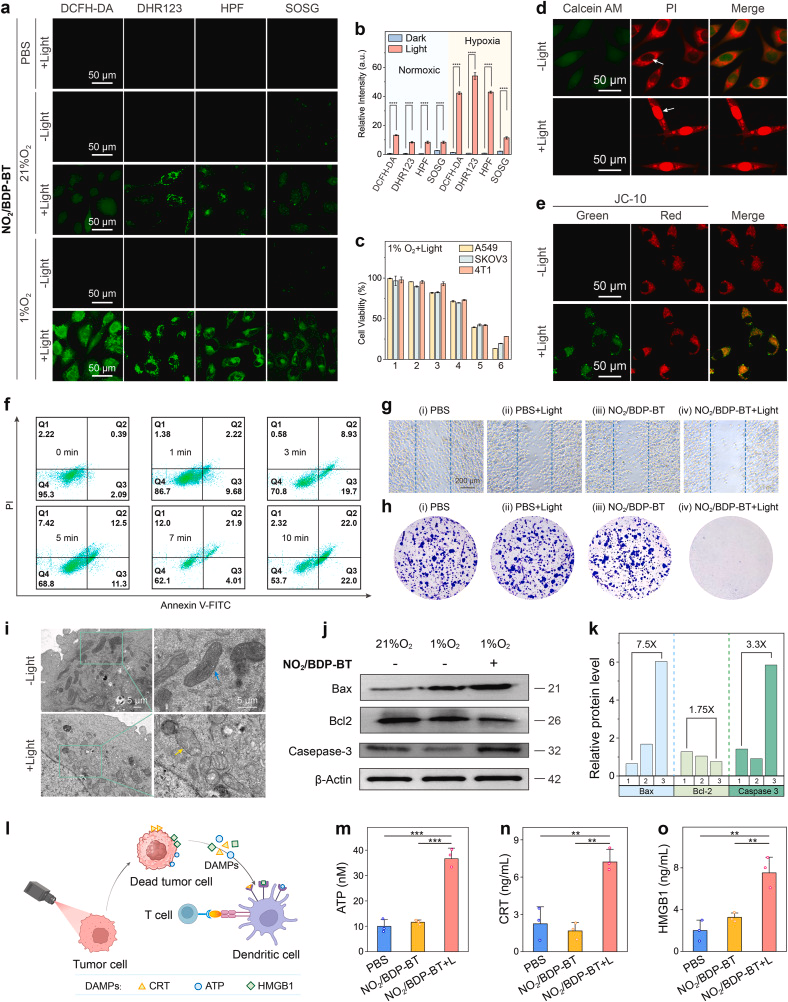
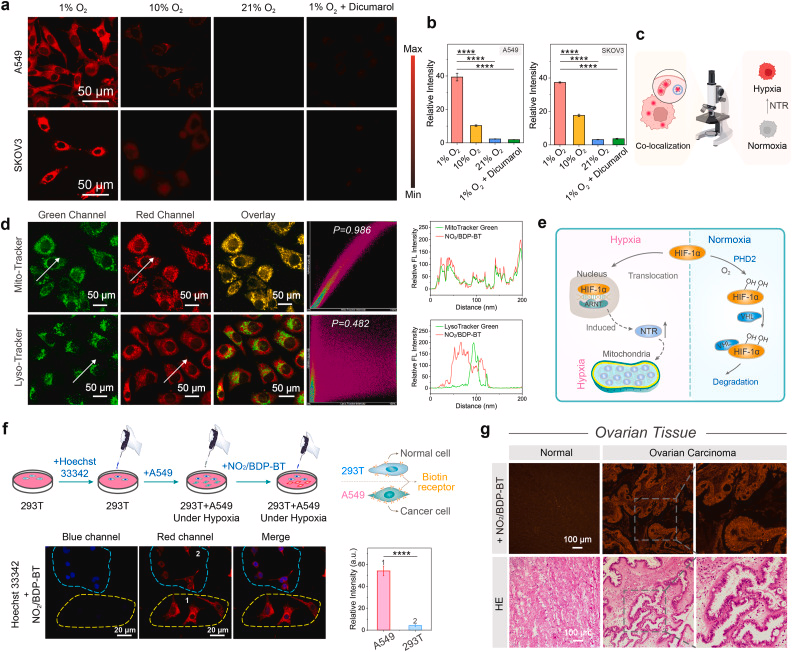
研究显示,NO₂/BDP-BT 在 NTR 激活后可在细胞内原位生成 ROS,诱导线粒体介导的细胞凋亡,并进一步触发免疫原性细胞死亡(ICD)。在动物实验中,该平台实现了 93.2% 的肿瘤生长抑制率,显示出极高的治疗潜力。
更重要的是,研究者通过解析 NO₂/BDP-BT 前体与 NTR 蛋白的共晶结构(PDB: 7XWW,分辨率 2.80 Å),首次揭示了其高亲和力结合的分子机制,包括氢键、π–π 堆叠等多种非共价作用力。这一结构信息为未来设计更高效的可激活光敏剂提供了重要依据。
四、进一步拓展:构建适用于极端缺氧环境的 I 型光敏剂
为了进一步提升在严重缺氧环境中的 PDT 效果,研究团队在 NO₂/BDP-BT 的基础上引入噻吩单元,构建了 NO₂/BDPS-BT,使其更偏向 I 型 ROS 生成路径。I 型 PDT 对氧气依赖更低,因此在缺氧肿瘤中具有更强的适应性。
这一拓展展示了该平台的可塑性,也为未来开发多模式 PDT 光敏剂提供了新方向。
五、临床潜力:成像 + 治疗 + 免疫激活的综合优势
NO₂/BDP-BT 不仅可用于体外细胞成像,还可在临床患者组织切片及活体动物中实现肿瘤缺氧成像,为术前诊断、术中导航提供可能。同时,其诱导的 ICD 可增强机体免疫反应,有望与免疫治疗联用,实现更持久的抗肿瘤效果。
该平台在精准性、安全性、治疗深度等方面均展现出显著优势,具备良好的临床转化前景。