【Biomaterials】一种可注射相变水凝胶如何触发双重 DNA 损伤并诱导 PANoptosis,实现前列腺癌免疫激活的新策略
文章标题: Dual-targeting nuclear and mitochondrial DNA damage drives immunogenic activation via PANoptosis for synergistic magneto-thermodynamic-chemotherapy 通讯作者: Bing Liang 文章链接: https://doi.org/10.1016/j.biomaterials.2025.123924
文章概要
一、研究背景:从“冷肿瘤”到“热肿瘤”的关键挑战
前列腺癌(PCa)作为典型的免疫“冷肿瘤”,具有突变负荷低、细胞毒性 T 细胞浸润不足、免疫抑制微环境强等特点,使得免疫治疗效果受限 。传统根治性手术虽可切除肿瘤,但伴随尿失禁、性功能障碍等严重并发症,患者生活质量显著下降。因此,开发一种微创、精准定位、可诱导免疫激活的局部治疗策略成为临床迫切需求。
磁热疗(MHT)利用 Fe₃O₄ 纳米颗粒在交变磁场(AMF)下产热,可实现局部肿瘤消融,但仍存在热穿透不足、材料植入创伤大、纳米颗粒易被清除等问题。与此同时,基于自由基的治疗策略虽能利用肿瘤微环境(酸性、高 H₂O₂)产生毒性自由基,但受限于氧依赖性和自由基扩散不足。
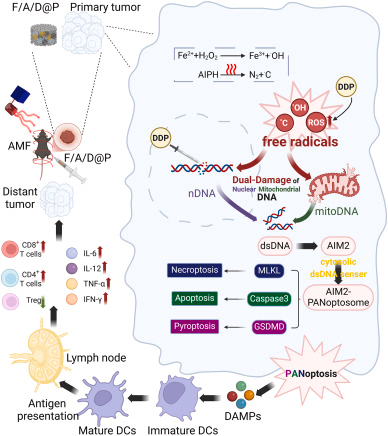
本研究提出一种突破性方案:构建可注射液-固相变水凝胶 F/A/D@P,通过 AMF 触发热效应、自由基放大、化疗药物释放,并诱导核 DNA 与线粒体 DNA 的双重损伤,最终激活 PANoptosis,实现强免疫应答与远端抗肿瘤效应。
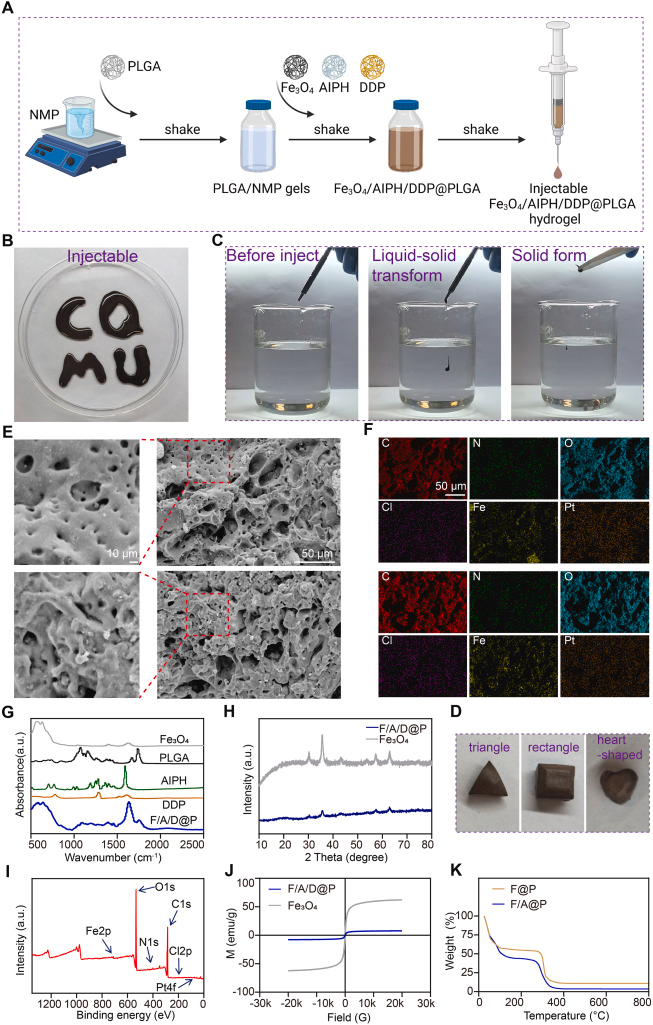
二、材料设计:三组分协同的可注射相变水凝胶
研究团队利用 FDA 批准的 PLGA 作为基体,将三种关键成分共同封装:
- Fe₃O₄ 纳米颗粒:AMF 下产热,实现磁热疗
- AIPH:一种氧气无关的热触发自由基前体,可释放烷基自由基(•C)
- DDP(顺铂):经典化疗药物,可诱导核 DNA 交联损伤
该水凝胶具有以下特性 :
- 注射性强:低黏度溶液可通过普通注射器注入肿瘤
- 遇水快速相变:注射后迅速固化,精准定位
- 形状适应性:可根据肿瘤形态固化成不同形状
- AMF 触发孔隙放大:孔径可增大 8.85 倍,促进药物释放与自由基扩散
这一设计确保药物在肿瘤内长时间滞留,并避免系统毒性。
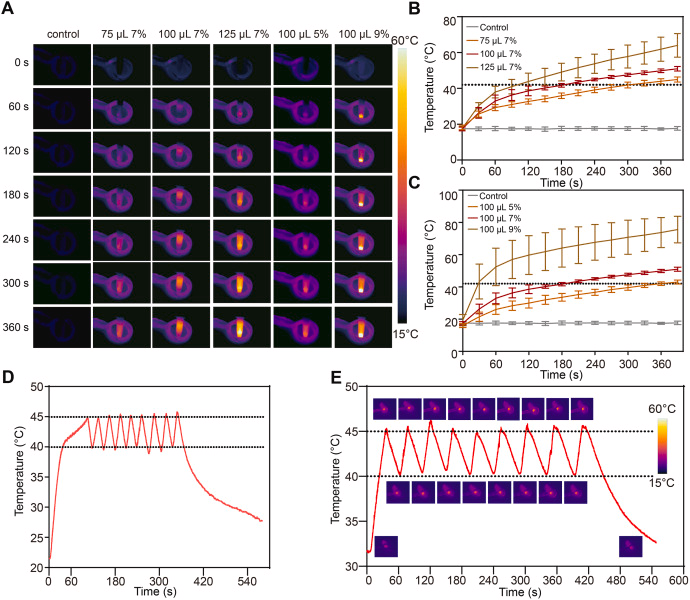
三、磁热调控:精准温控实现多重治疗触发
研究发现,当 Fe₃O₄ 含量为 7%、注射体积为 100 μL 时,可在 AMF 下稳定维持 40–45°C 的温和热疗温度,既能杀伤肿瘤细胞,又避免损伤正常组织。
AMF 触发的多重效应包括:
- AIPH 热分解 → 释放烷基自由基
- Fe²⁺ 参与 Fenton 反应 → 生成羟基自由基(•OH)
- DDP 热响应释放 → 增强 DNA 交联损伤
三者协同产生大量 ROS,自由基积累显著增强。
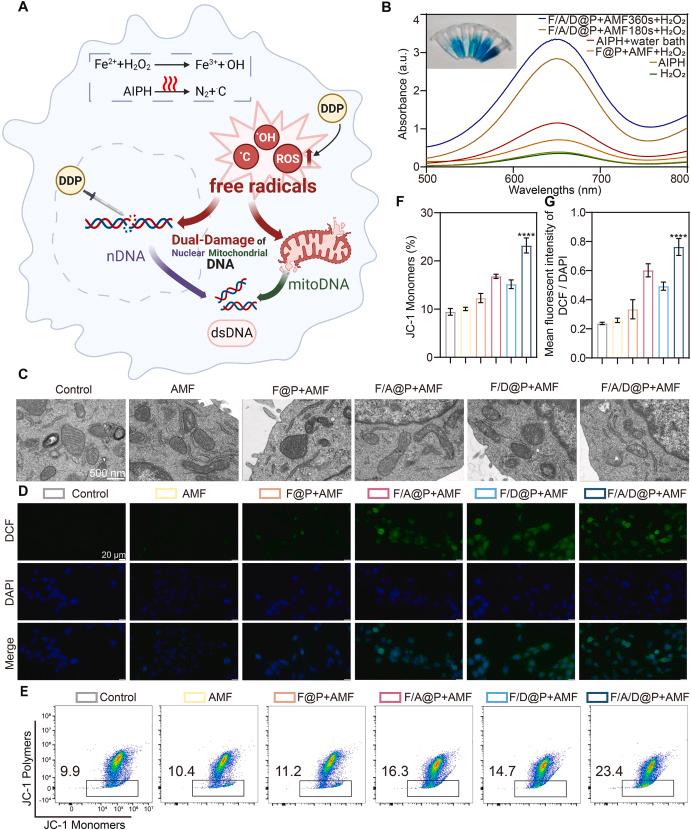
四、双重 DNA 损伤:nDNA + mitoDNA 的协同破坏
研究系统验证了 F/A/D@P 在 AMF 下可同时诱导:
1. 线粒体 DNA(mitoDNA)损伤
- TEM 显示线粒体严重肿胀、空泡化
- JC-1 染色表明线粒体膜电位显著下降
- mPTP 开放导致 mitoDNA 泄漏至胞质
2. 核 DNA(nDNA)损伤
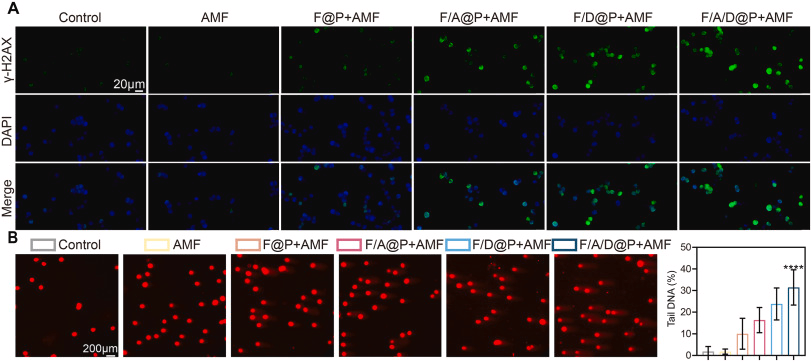
- γ-H2AX 明显升高,提示双链断裂
- 彗星实验显示 DNA 尾长显著增加,断裂率达 52.94%
大量 nDNA 与 mitoDNA 泄漏至胞质,形成强烈的免疫危险信号(DAMPs)。
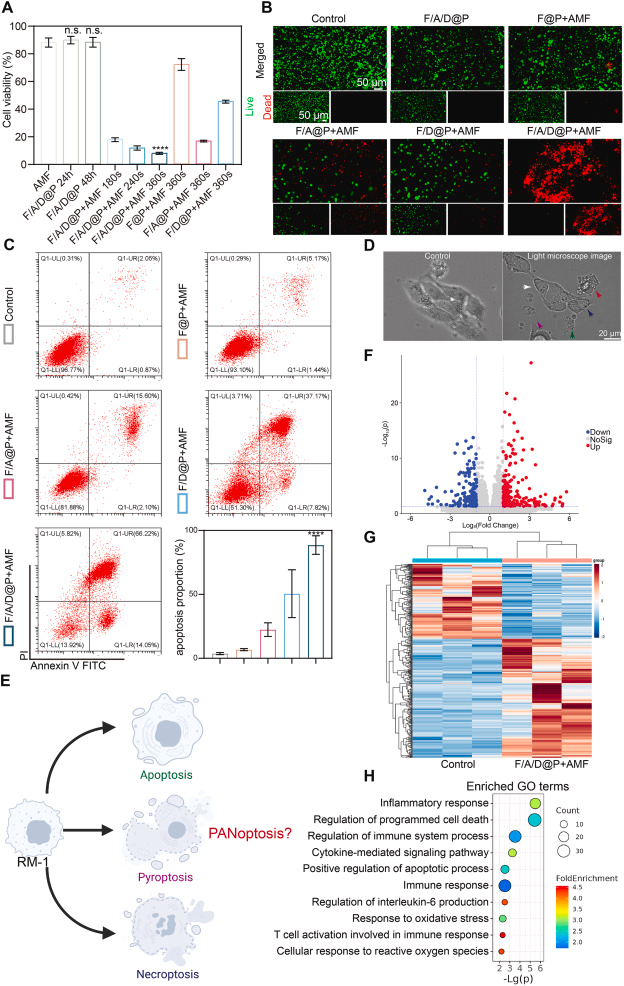
五、PANoptosis:三种细胞死亡途径的整合激活
胞质 dsDNA 激活 AIM2 受体,进而组装 AIM2-PANoptosome,触发 PANoptosis——一种整合:
- 焦亡(pyroptosis)
- 凋亡(apoptosis)
- 坏死性凋亡(necroptosis)
的炎症性细胞死亡模式。
研究通过多种分子标志物验证:
- 焦亡:Caspase-1、GSDMD 激活
- 凋亡:Caspase-3、Caspase-8 上调
- 坏死性凋亡:p-MLKL、p-RIPK3 增加
- PANoptosome 组分:AIM2、ZBP1、Pyrin 均显著升高
AIM2 siRNA 实验进一步证明 PANoptosis 的关键依赖 AIM2 信号通路。
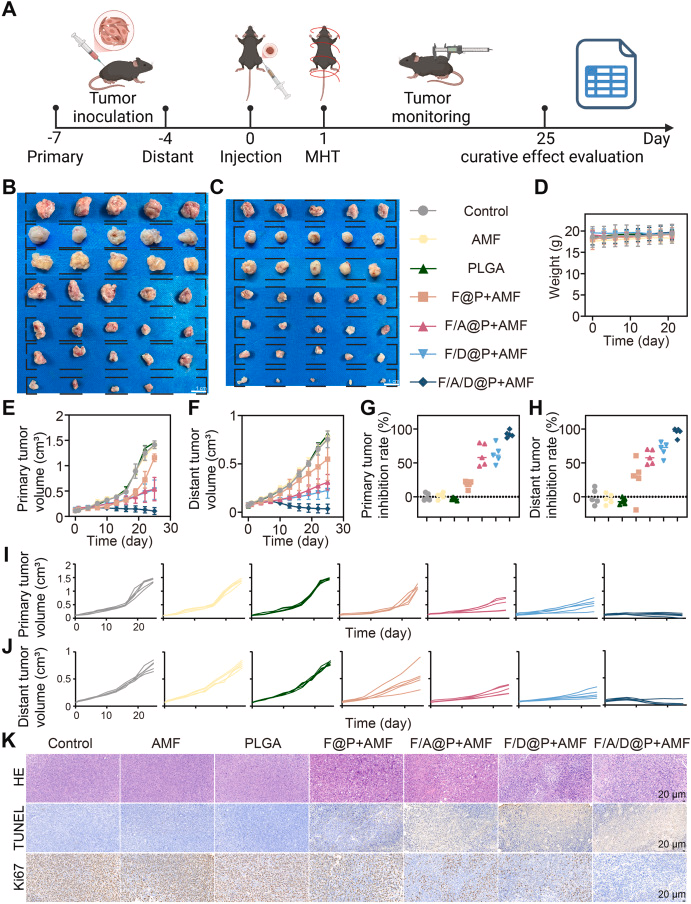
六、体内治疗效果:原位肿瘤消失 + 远端肿瘤强抑制
在双侧前列腺癌小鼠模型中:
- F/A/D@P + AMF 可完全清除原发瘤
- 远端未处理肿瘤抑制率 > 90%
- 体重稳定,无明显毒性
- 组织学显示大量细胞死亡与增殖抑制
相比单独的 F@P、F/A@P 或 F/D@P,三者协同效果最强。
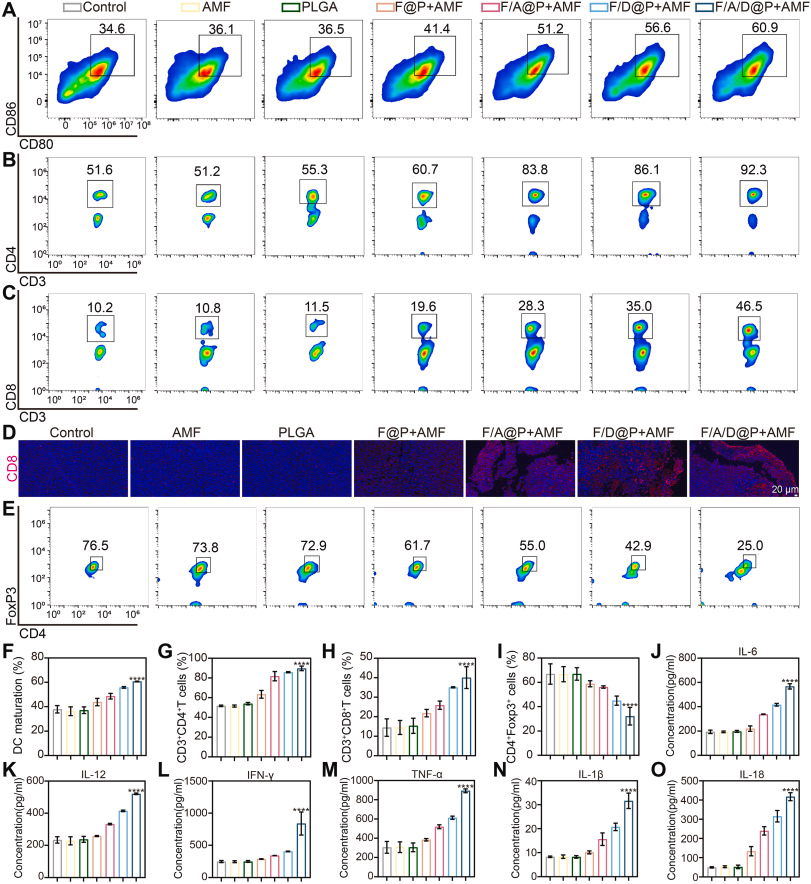
七、免疫激活:从“冷”到“热”的关键转变
PANoptosis 诱导的免疫激活表现为:
- 树突状细胞(DC)成熟显著提升
- CD8⁺ T 细胞大量浸润原发瘤与远端瘤
- Treg 显著减少
- 多种促炎细胞因子(IL-1β、TNF-α、IFN-γ 等)大幅升高
- 再挑战实验显示 100% 肿瘤拒绝率
这表明该策略不仅清除局部肿瘤,还能建立持久的系统性抗肿瘤免疫记忆。
八、结论:一种具有临床潜力的非手术前列腺癌治疗方案
该研究提出的 F/A/D@P 相变水凝胶具备:
- 微创注射
- 精准定位
- AMF 控制释放
- 双重 DNA 损伤
- PANoptosis 诱导
- 强免疫激活与远端抑瘤
所有材料均为 FDA 批准,具备良好转化潜力,为前列腺癌及其他实体瘤提供了新的非手术免疫治疗策略。