🔬【JACS】突破RNA药物设计瓶颈:揭秘1种新型共价小分子如何精准调控核糖开关
文章信息
📚文章标题:Structure-Guided Design of a Bioactive Covalent Small Molecule Targeting a Riboswitch 作者:Chungen Li等 期刊:Journal of the American Chemical Society 链接:https://doi.org/10.1021/jacs.5c13219
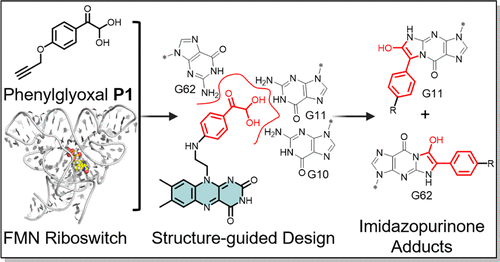
RNA作为治疗靶点的潜力近年来备受关注,但如何实现高选择性、强效性的RNA调控仍是药物研发的难题。本文介绍了一项最新研究成果:通过结构引导策略,科学家成功设计出一种名为A1的共价小分子,能精准修饰FMN核糖开关中的特定鸟嘌呤残基,从而调控基因表达。这项研究不仅展示了RNA靶向共价药物的可行性,还揭示了其在细胞内的功能机制,为RNA药物开发开辟了新路径。
🧠背景:RNA靶点与共价修饰的挑战
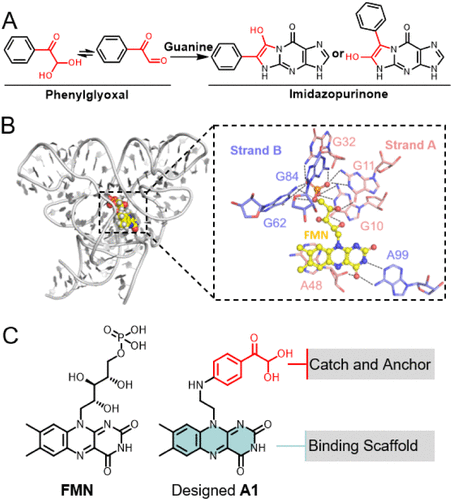
RNA分子结构复杂,传统小分子药物难以实现高选择性结合。尤其是RNA中的鸟嘌呤残基,其N7位点具有高亲核性,容易被多种电亲试剂修饰,导致选择性差。为解决这一问题,研究团队聚焦于未配对鸟嘌呤的Watson-Crick面(N1和N2位点),并选用苯基乙二醛(phenylglyoxal)作为反应基团,因其具有良好的反应性、结构刚性和π–π堆积能力,有望实现更精准的RNA修饰。
🧪设计策略:结构引导定位反应位点
研究者以FMN核糖开关为模型系统,该RNA结构位于细菌mRNA的5′端,能感应核黄素代谢物并调控基因表达。通过分析其晶体结构,发现FMN结合口袋周围存在多个未配对的鸟嘌呤残基(G10、G11、G62等),为苯基乙二醛提供了理想的反应位点。
团队设计了一个新型小分子A1,将苯基乙二醛基团连接至FMN类似结构上,使其既能结合核糖开关,又能实现位点特异性共价修饰。分子对接分析显示,A1的反应基团可精准定位于G11和G62附近,具备形成共价键的空间构象。
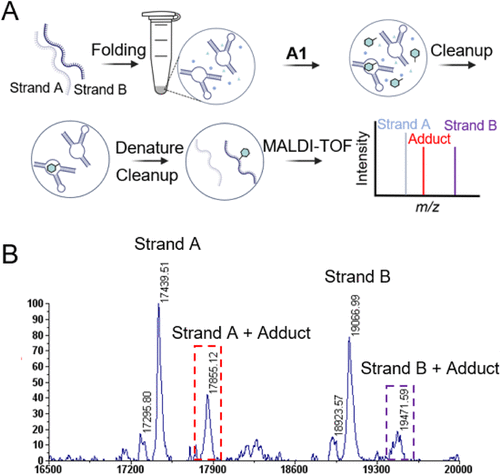
🧬实验验证:A1的选择性与反应性
通过荧光标记实验和凝胶电泳,研究者比较了A1与对照探针P1(仅含苯基乙二醛基团)的反应性。结果显示:
- A1在200 μM浓度下可修饰约33%的RNA链A和24%的链B;
- P1在相同条件下仅修饰6%和4%,显示出明显的选择性提升;
- A1的修饰效果呈剂量和时间依赖性,验证了其结构引导的反应机制。
此外,竞争实验表明,天然配体FMN和其前体核黄素可阻止A1的修饰作用,进一步证明A1的结合位点与FMN相同,修饰行为由结合诱导的近距离效应驱动。
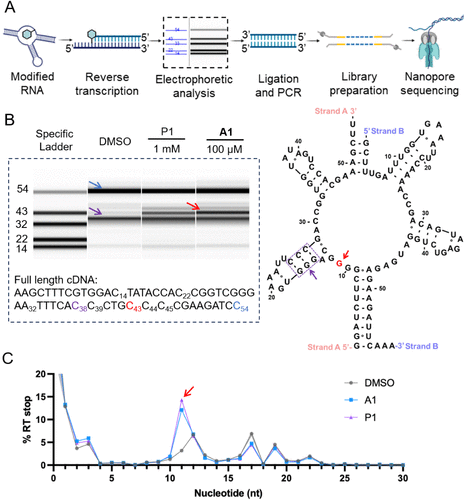
🧫定位修饰位点:RT停顿与纳米孔测序
为精确识别A1的修饰位点,研究者采用逆转录酶(RT)停顿实验和纳米孔测序技术。结果发现:
- A1在链A的G11处诱导明显的RT停顿;
- 在链B的G6(对应G62)也观察到弱停顿信号;
- 与P1相比,A1在10倍低浓度下即可产生相似停顿效果,显示其高效性。
这些数据与分子对接预测高度一致,验证了A1通过结构引导实现对特定鸟嘌呤的共价修饰。
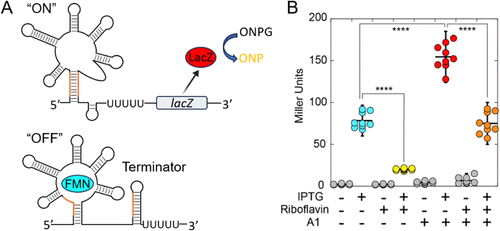
🧫细胞功能验证:反向激动剂效应
在Bacillus subtilis细胞中,研究者构建了一个FMN核糖开关-LacZ报告系统,检测A1对基因表达的调控作用。结果显示:
- FMN可抑制LacZ表达(终止构象);
- A1则增强表达(反终止构象),表现为反向激动剂;
- A1与FMN共同存在时,表达水平下降,说明两者竞争结合核糖开关。
此外,DMS甲基化测序揭示A1与FMN在结合口袋周围诱导相似的结构变化,但在G11附近的核苷酸构象变化不同,提示A1可能稳定一种新的RNA二级结构。
🔍意义与展望:RNA共价药物的新范式
这项研究首次展示了通过结构引导设计,实现RNA靶向共价小分子的高选择性修饰与功能调控。A1不仅能精准修饰未配对鸟嘌呤,还能在细胞中诱导RNA构象变化,调控基因表达,表现出与天然配体相反的生物效应。
更重要的是,苯基乙二醛作为反应基团,其选择性优于传统电亲试剂,适用于多种含未配对鸟嘌呤的RNA结构,如TPP核糖开关、r(G4C2)重复序列、MYC mRNA的IRES结构等,为RNA药物开发提供了广泛适用的工具。
📌结语
这项研究不仅拓展了RNA靶向药物的设计思路,也为共价小分子在RNA调控领域的应用奠定了基础。未来,随着更多RNA结构的解析与反应模块的优化,RNA共价药物有望在疾病治疗中发挥更大作用。