🔬【JACS】突破传统抗生素瓶颈:3个模块构建的短肽新药对抗MRSA的精准策略
文章信息
📚文章标题:Gelatinase-Responsive Short Peptide Conjugate as a Precision Therapy Against Methicillin-Resistant Staphylococcus aureus 作者:Snehanka Bose等 期刊:Journal of the American Chemical Society 链接:https://doi.org/10.1021/jacs.5c11249
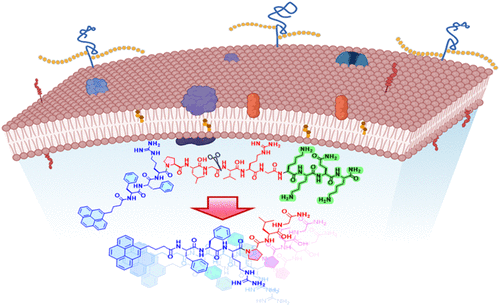
甲氧西林耐药金黄色葡萄球菌(MRSA)作为全球抗生素耐药性危机的代表性病原体,长期困扰着临床治疗。近期发表于《美国化学会志》的研究提出了一种创新性的短肽治疗策略——通过整合3个功能模块,构建出一种对MRSA具有高度选择性和强效杀菌能力的短肽药物Py-FGGK,为抗菌治疗带来了新的希望 1。
🧩模块化设计:3个功能单元协同作用
该研究设计的短肽Py-FGGK由以下三部分组成:
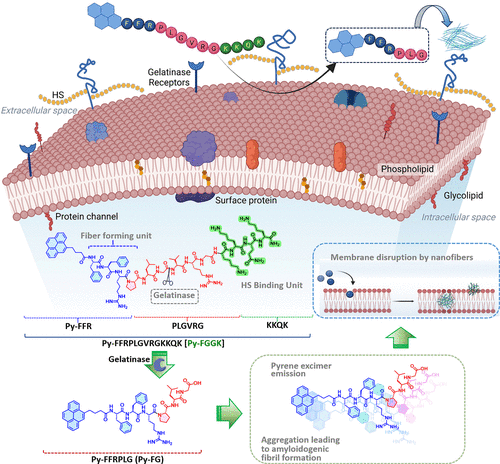
- Py-FFR结构单元:由荧光团芘(Pyrene)与双苯丙氨酸(FF)和精氨酸(R)构成,具备自组装形成纤维的能力,并可用于荧光标记。
- PLGVRG酶响应连接体:可被MRSA分泌的明胶酶(gelatinase)特异性切割,触发药物活性释放。
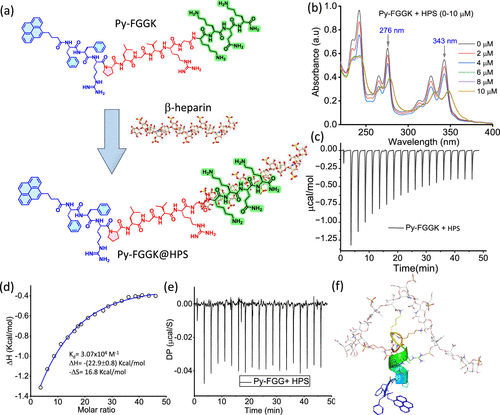
- KKQK硫酸乙酰肝素(HS)结合序列:用于靶向MRSA感染部位的HS分子,增强定位与细胞摄取。
这种模块化设计使得Py-FGGK在MRSA感染部位精准定位,并在酶作用下释放活性成分Py-FG,形成具有杀菌能力的淀粉样纤维。
🧪机制详解:从定位到杀菌的全过程
1. 靶向定位与酶响应释放
- KKQK序列与MRSA感染部位的HS结合,增强药物在病灶处的富集。
- PLGVRG序列在MRSA分泌的明胶酶作用下被切割,释放出Py-FG。
2. 自组装形成淀粉样纤维
- Py-FG在MRSA表面自组装形成纤维结构,破坏细菌膜完整性。
- 芘基团间的π-π堆积促进纤维形成,并产生特征性荧光信号。
3. 多重杀菌机制
- 破坏细胞膜,导致DNA/RNA泄漏。
- 诱导活性氧(ROS)生成,造成细胞氧化损伤。
- 有效穿透并杀死生物膜中的嵌入细胞。
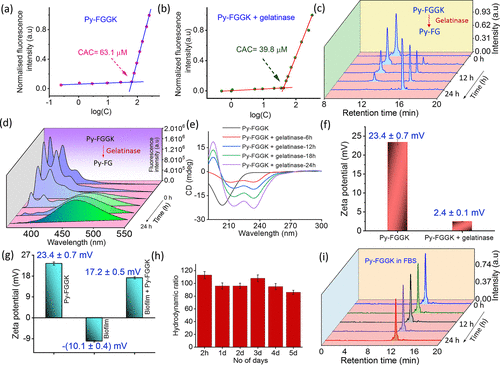
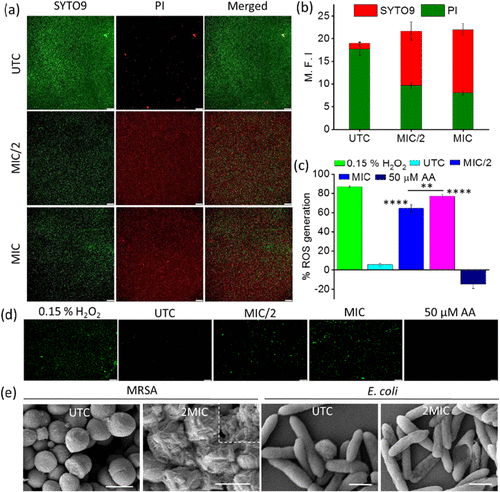
📊实验结果亮点:Py-FGGK的强效与安全性
1. 杀菌效力显著
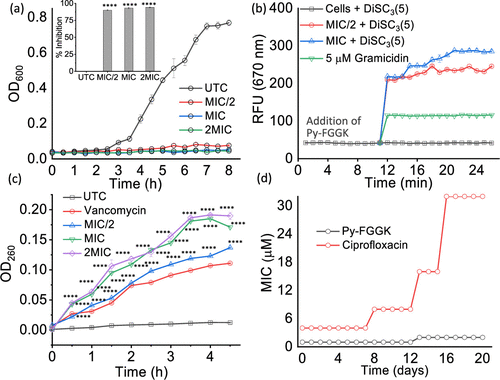
- 对MRSA的最低抑菌浓度(MIC)仅为1 μM,远低于对照肽。
- 20天连续培养仅出现2倍MIC升高,显示低耐药性风险。
2. 生物膜清除能力强
- 对预形成和新形成的MRSA生物膜清除率分别高达81%和76%。
- SYTO-9/PI染色显示生物膜中细胞死亡率显著提升。
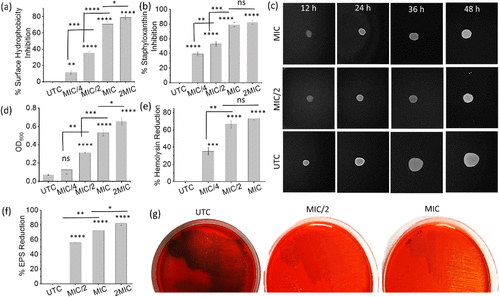
3. 抗毒力作用全面
- 抑制MRSA表面疏水性达79%,减少其黏附能力。
- 抑制金黄色素(staphyloxanthin)生成达82%,削弱其抗氧化防御。
- 减少滑动运动、细胞聚集与α-溶血素分泌,全面削弱MRSA毒力。
4. 安全性良好
- 在HEK293和WI38细胞中,25 μM以下无明显毒性,远高于有效浓度。
- 血液溶解实验显示2MIC以下溶血率低于5%,安全性高。
🧬动物实验验证:加速伤口愈合的潜力
在MRSA感染的Wistar大鼠模型中,Py-FGGK展现出显著的伤口修复能力:
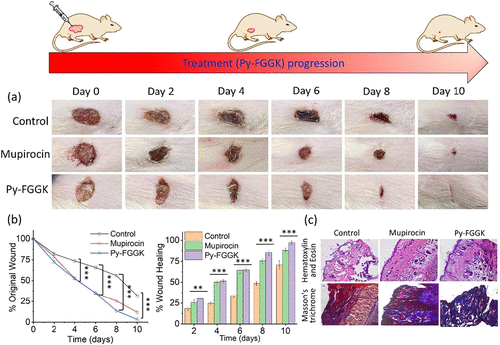
- 第10天伤口闭合率达90%,远高于PBS对照组。
- 组织切片显示表皮和真皮再生良好,毛囊和血管密度显著增加。
- Masson染色显示胶原沉积丰富,组织重建效果优异。
🔍结语:精准抗菌的未来方向
Py-FGGK的设计理念体现了“精准抗菌”的新趋势——通过病原体特异性酶响应、靶向定位与自组装机制,实现高效杀菌与低副作用的完美结合。其在MRSA治疗中的表现,不仅突破了传统抗生素的局限,也为抗生素耐药性问题提供了新的解决思路。
未来,类似的模块化短肽策略有望拓展至其他耐药菌种,成为抗菌药物研发的新方向。