【JACS】100%生存率!揭秘一种新型纳米药物如何逆转胶质母细胞瘤免疫抑制
文章信息
📚文章标题:Genetically Engineered Biomimetic Nanoparticles for Synergistic Activation of Glioma-Associated Macrophages against Glioblastoma 作者:Jia-Qi Luo等 期刊:Journal of the American Chemical Society 链接:https://doi.org/10.1021/jacs.5c12775
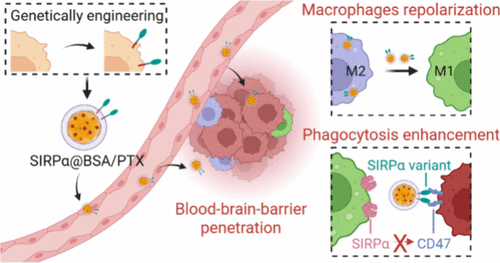
胶质母细胞瘤(GBM)是最具侵袭性的脑部肿瘤之一,传统治疗手段如手术、放疗和化疗效果有限,患者五年生存率不足10%。近期,《美国化学会志》发表的一项研究提出了一种突破性的治疗策略:通过基因工程改造的仿生纳米颗粒(SIRPα@BSA/PTX)激活肿瘤相关巨噬细胞(GAMs),在小鼠模型中实现了100%的生存率。本文将深入解析该研究的机制、实验结果及其临床潜力。
一、胶质母细胞瘤的免疫困境:M2型巨噬细胞与CD47信号
GBM的肿瘤微环境中富含M2型GAMs,这类细胞具有促肿瘤特性,抑制T细胞浸润并促进肿瘤免疫逃逸。研究发现:
- 临床样本中M2型GAMs(CD163⁺)远多于M1型(CD86⁺),形成强免疫抑制环境。
- 高级别胶瘤中M2型GAMs浸润显著增加,与患者生存期负相关。
- GBM细胞高表达“别吃我”信号CD47,阻断巨噬细胞的吞噬功能。
这些发现提示,重编程GAMs并阻断CD47信号可能是提升GBM免疫治疗效果的关键。 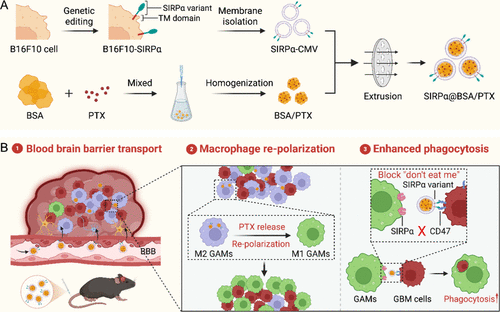
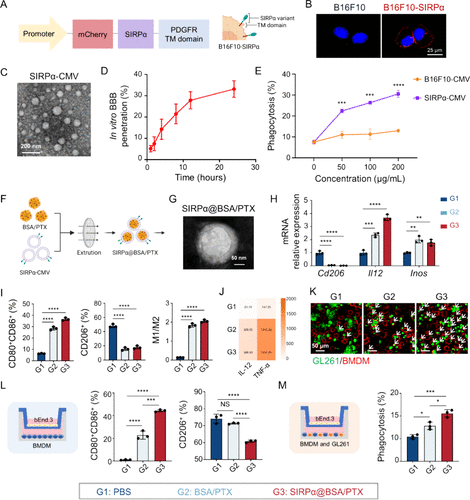
二、紫杉醇(PTX)与CD47阻断的协同效应
紫杉醇是一种经典化疗药物,研究发现其不仅能杀伤肿瘤细胞,还能:
- 将M2型巨噬细胞重新极化为M1型,增强其免疫活性。
- 与CD47抗体联合使用时,显著提升巨噬细胞对GBM细胞的吞噬能力。
- 诱导肿瘤细胞表面暴露“吃我”信号CALR,进一步增强免疫识别。
这一协同机制为后续纳米药物的设计奠定了基础。 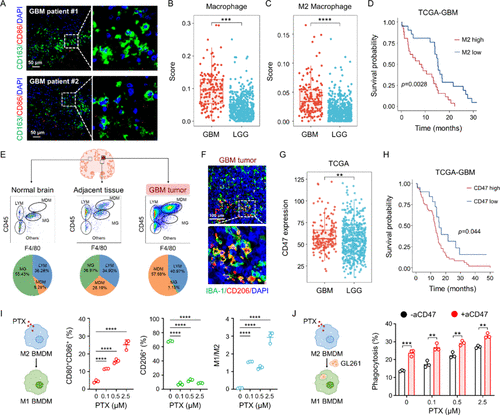
三、仿生纳米平台SIRPα@BSA/PTX的构建与特性
为实现PTX与CD47阻断的协同递送,研究团队设计了SIRPα@BSA/PTX纳米平台:
- 外壳:采用基因工程改造的黑色素瘤细胞膜,表达SIRPα变体,具备脑部趋向性与CD47阻断功能。
- 内核:白蛋白包裹的紫杉醇(BSA/PTX),高效诱导巨噬细胞极化。
- 粒径约148 nm,具备良好的血脑屏障穿透能力(穿透率达40%)。
该平台不仅能精准递送药物至脑部肿瘤,还能在局部激活巨噬细胞免疫功能。
四、体内实验:显著抑制肿瘤生长并延长生存期
在小鼠GBM模型中,SIRPα@BSA/PTX展现出卓越的治疗效果:
- 药物在肿瘤部位富集程度是未包膜药物的8.3倍。
- 抑制肿瘤生长率达89.9%,远超其他对照组。
- 小鼠体重稳定,生存期延长至51天,比对照组提高82%。
组织学分析显示,治疗组肿瘤细胞增殖显著减少,凋亡率显著增加。 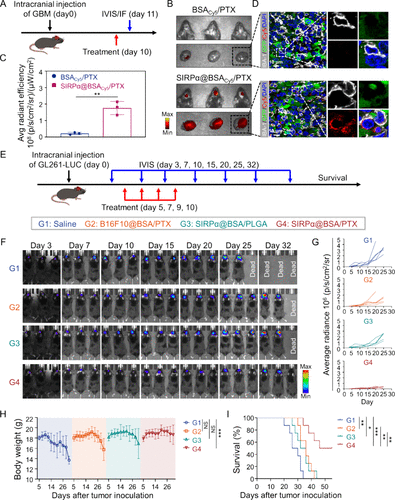
五、免疫微环境重塑:从“冷瘤”变“热瘤”
SIRPα@BSA/PTX不仅抑制肿瘤,还显著激活免疫系统:
- GAMs中M1型比例提升至55.5%,M2型下降至18.1%,M1/M2比值提高3.1倍。
- CD8⁺ T细胞浸润增加2.1倍,IFN-γ阳性细胞占比达66.4%。
- 免疫荧光显示肿瘤组织中CD8⁺ T细胞密集分布,形成“热瘤”状态。
这一转变为后续免疫治疗提供了有利基础。 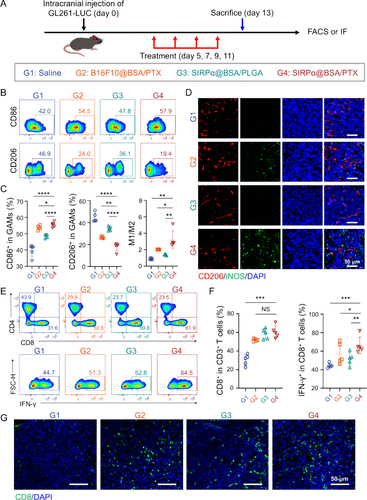
六、联合免疫检查点抑制剂:实现术后完全治愈
在术后GBM复发模型中,研究团队将SIRPα@BSA/PTX与PD-1抗体联合使用,结果令人震撼:
- 联合治疗组肿瘤完全消失,生存率达100%,持续超过150天。
- 单独使用PD-1抗体或SIRPα@BSA/PTX的治愈率分别为20%和40%。
- 重挑战实验显示,治疗后免疫记忆持续存在,部分小鼠再次植瘤后仍长期存活。
这表明该策略不仅能清除原发肿瘤,还能防止复发。 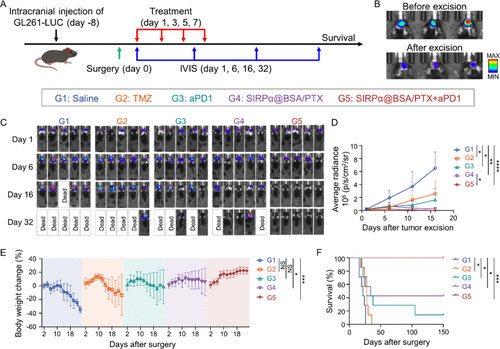
七、临床样本验证:人类GBM组织也响应治疗
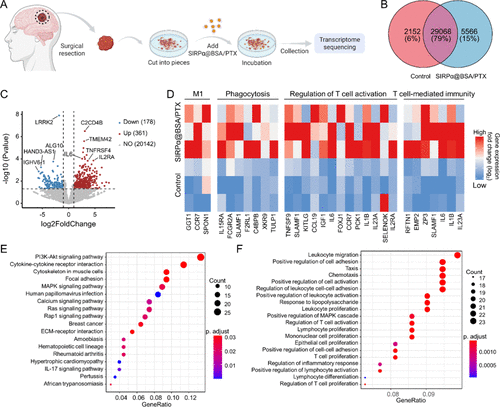
研究还在新鲜切除的人类GBM样本中进行了验证:
- 转录组分析显示361个免疫相关基因上调,178个下调。
- 富集分析表明M1极化、吞噬功能、T细胞活化等通路显著增强。
- KEGG与GO分析显示PI3K-Akt与MAPK信号通路被激活,促进免疫重塑。
这些结果表明该纳米平台具有良好的临床转化潜力。 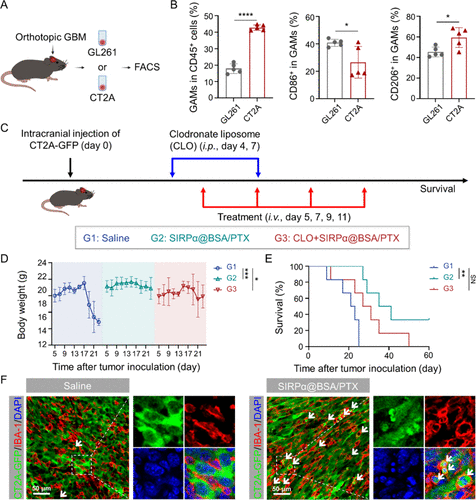
八、结语:从“不可治愈”到“完全缓解”的可能
SIRPα@BSA/PTX代表了一种全新的GBM治疗思路——通过精准递送与免疫重编程,逆转肿瘤微环境,实现协同抗癌。其在小鼠模型中实现了前所未有的100%生存率,并在人类样本中展现出强烈的免疫激活信号。未来,随着临床试验的推进,这一策略有望为GBM患者带来真正意义上的“治愈”希望。